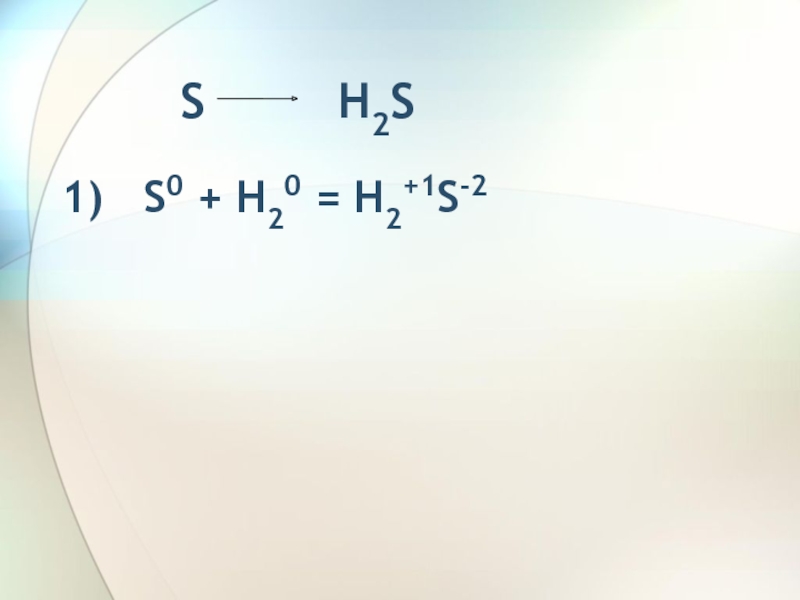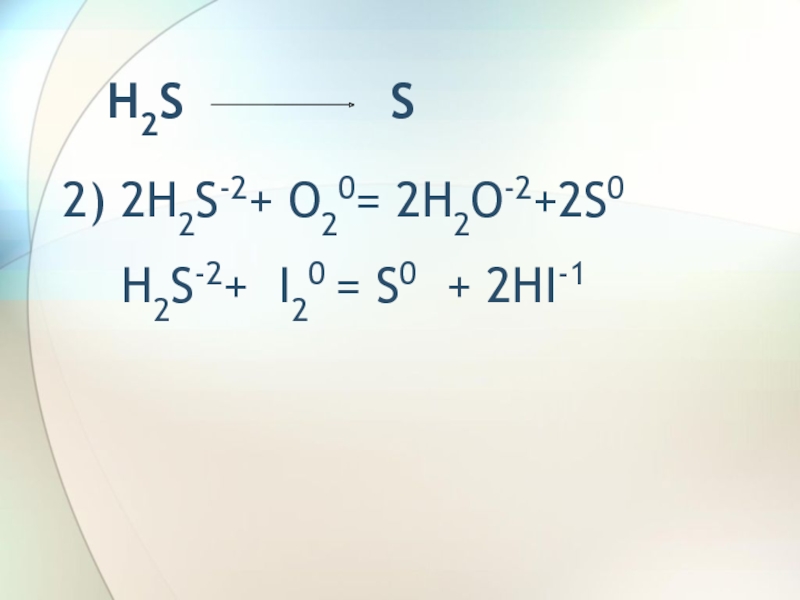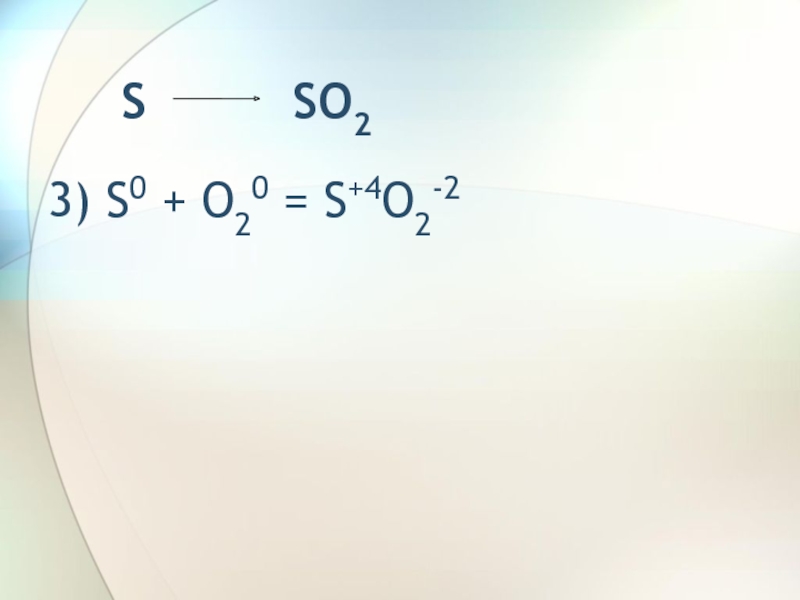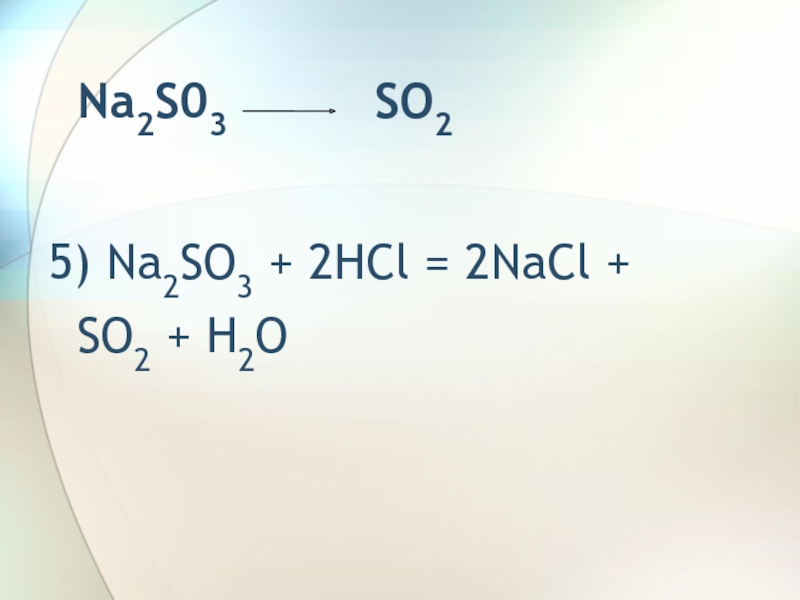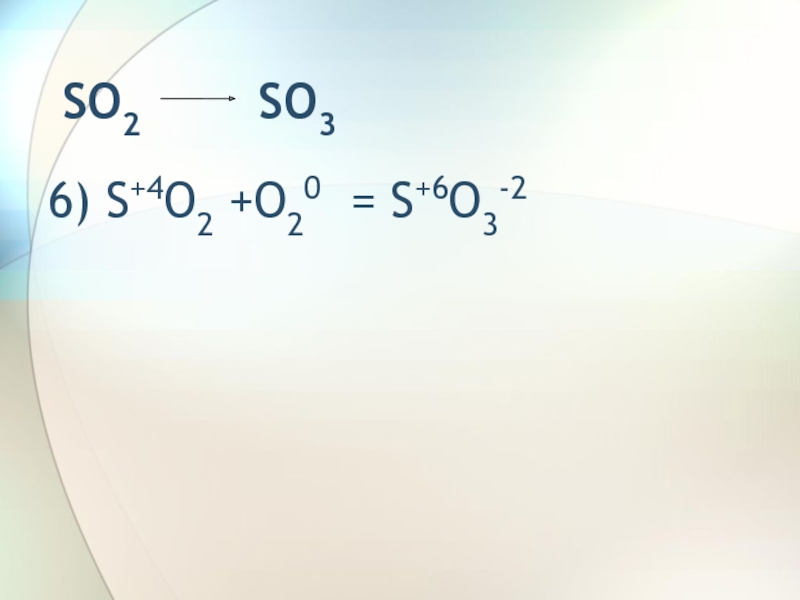Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Серная кислота (к рабочей тетради О.Г. Габриеляна «Химия- 9 класс»
Содержание
- 1. Серная кислота (к рабочей тетради О.Г. Габриеляна «Химия- 9 класс»
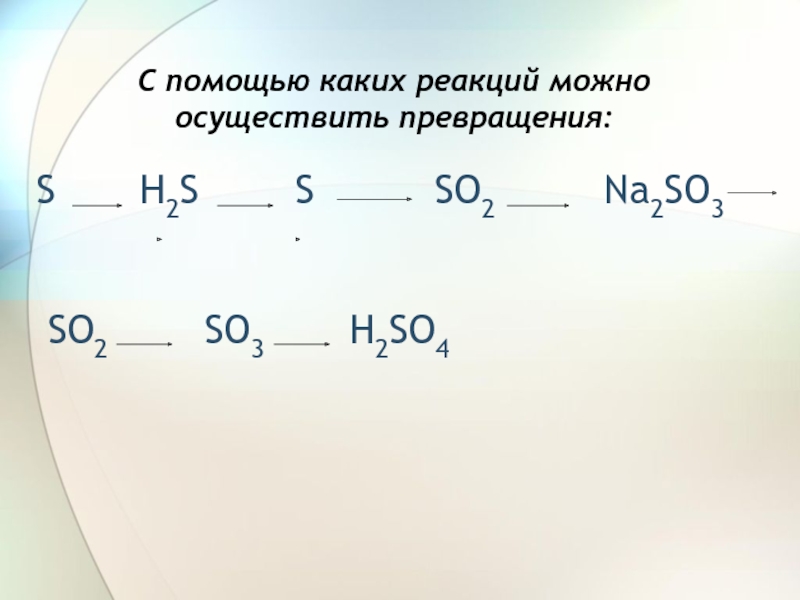
- 2. С помощью каких реакций можно осуществить превращения:S
- 3. S
- 4. H2S
- 5. S SO23) S0 + O20 = S+4O2-2
- 6. SO2
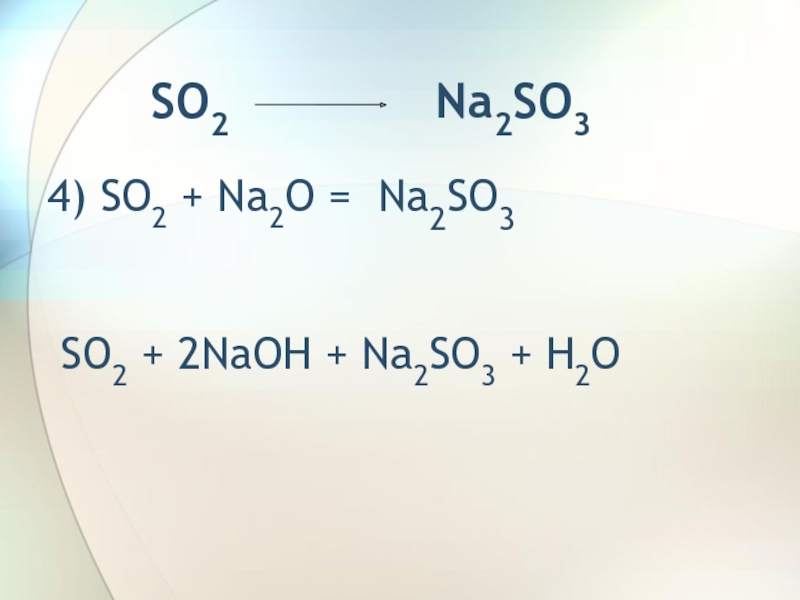
- 7. Na2S03 SO25)
- 8. SO2 SO36) S+4O2 +O20 = S+6O3-2
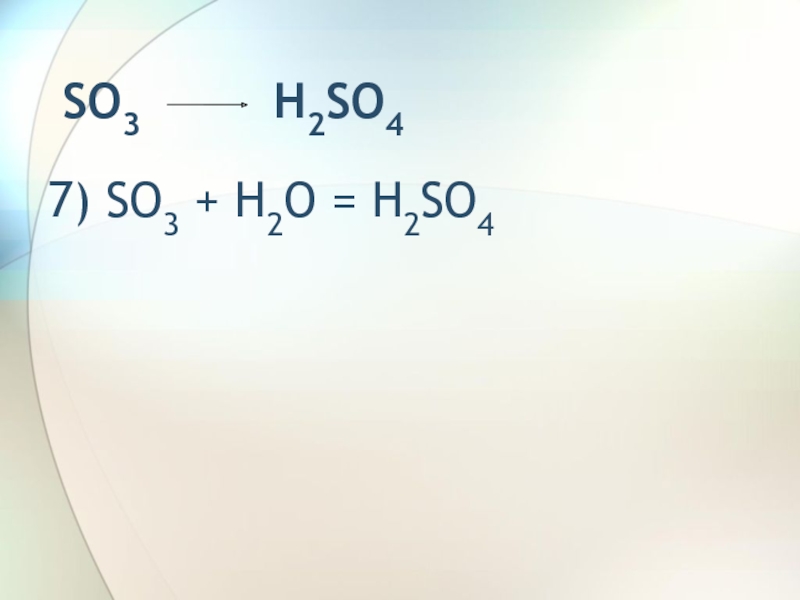
- 9. SO3 H2SO47) SO3 + H2O = H2SO4
- 10. Серная кислота
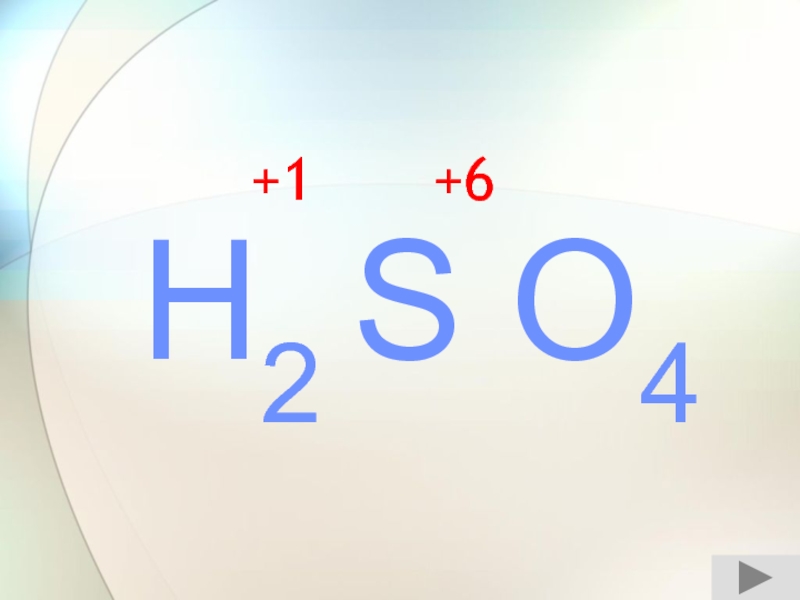
- 11. H2 S O4+1+6
- 12. Применение H2SO4
- 13. Применение H2SO4CuSO4*5H2O
- 14. Применение H2SO4красители
- 15. Применение H2SO4пластмассы
- 16. Применение H2SO4
- 17. Применение H2SO4ГИПС
- 18. Применение H2SO4Лекарства
- 19. Применение H2SO4Взрывчатые вещества
- 20. Применение H2SO4в качестве осушителя
- 21. Задачи
- 22. СЕРНАЯ КИСЛОТАХимическиесвойстваФизическиесвойстваПрименениесерной кислотыЗадачи
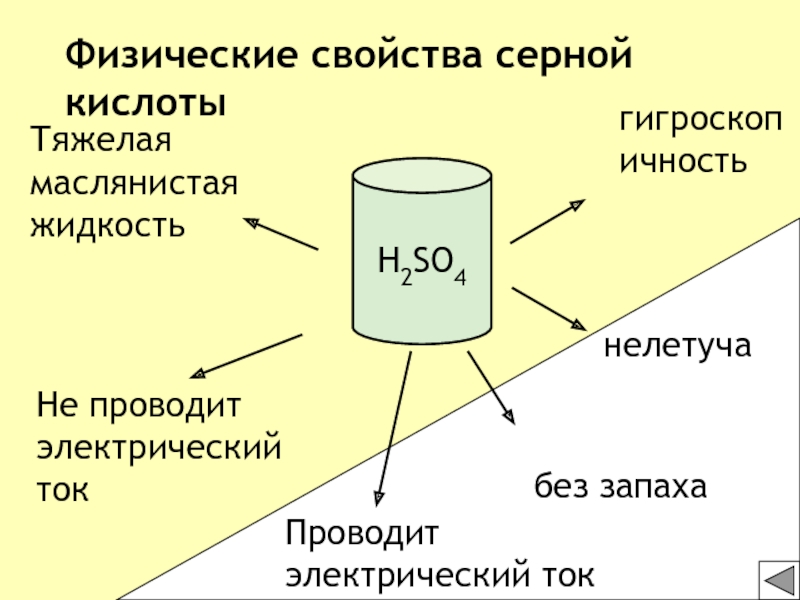
- 23. Тяжелая маслянистая жидкостьбез запаха Не проводит электрический токгигроскопичностьнелетучаФизические свойства серной кислотыH2SO4Проводит электрический ток
- 24. H2 S O4+1+6
- 25. Химические свойства H2SO4РазбавленнаяКонцентрированная
- 26. Слайд 26
- 27. Взаимодействие разбавленной серной кислоты с основаниямиH2SO4 + 2NaOH = Na2SO4 + 2H2O
- 28. Взаимодействие разбавленной серной кислоты с основными оксидами3H2SO4 + Fe2O3 = Fe2(SO4)3 +3H2O
- 29. Взаимодействие разбавленной серной кислоты с растворами солейH2SO4 + Na2CO3 = CO2 +H2O +Na2SO4
- 30. КАЧЕСТВЕННЫЕ РЕАКЦИИ- это реакции, с помощью которых распознают определенные химические вещества
- 31. Качественная реакция на сульфат-ионБелый осадок
- 32. ПРОВЕРЬ СЕБЯ:Ba2++2Cl-+2H++SO42-=BaSO4 +2H++2Cl-
- 33. Слайд 33
- 34. Химические свойства концентрированной серной кислоты Сильный окислительГигроскопичность
- 35. Сильный окислитель а) H2S+6O4 + Mg0 =
- 36. Обугливание сахара концентрированной серной кислотойC11H22O11 +
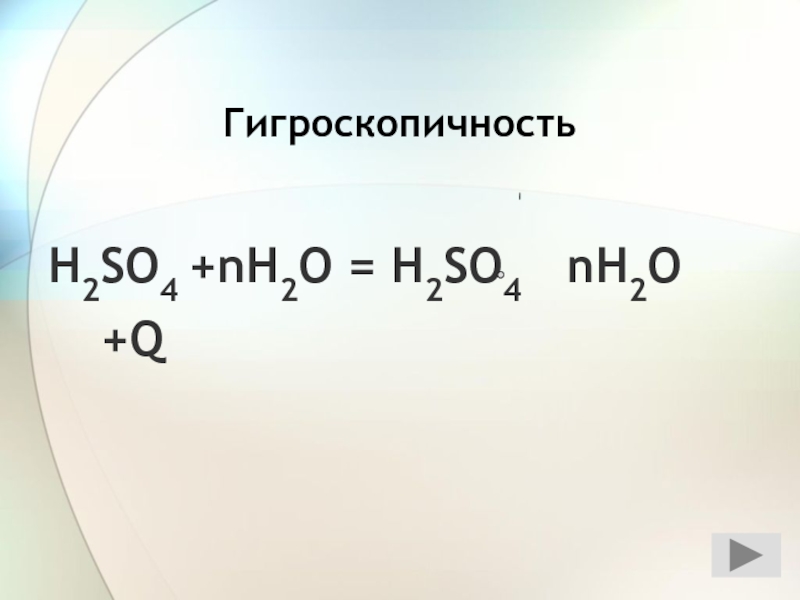
- 37. H2SO4 +nH2O = H2SO4 nH2O +Q Гигроскопичность
- 38. Техника безопасности
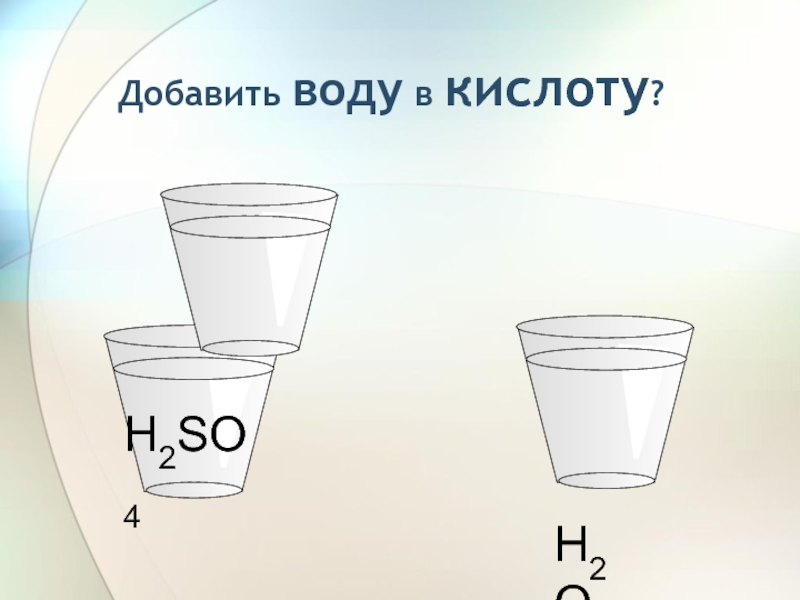
- 39. H2SO4Добавить воду в кислоту?H2OПосмотреть
- 40. H2SO4Добавить воду в кислоту?H2O
- 41. H2SO4Добавить воду в кислоту?
- 42. H2SO4Добавить воду в кислоту?
- 43. H2SO4Добавить воду в кислоту?
- 44. H2SO4Добавить воду в кислоту?
- 45. H2SO4Добавить воду в кислоту?
- 46. H2SO4Добавить воду в кислоту?
- 47. H2SO4Добавить воду в кислоту?
- 48. H2SO4Добавить воду в кислоту?
- 49. H2SO4Добавить воду в кислоту?
- 50. H2SO4Добавить воду в кислоту?БАХ!
- 51. Добавлять КИСЛОТУ в воду!H2SO4 + nH2O = H2SO4• nH2O + QH2OH2SO4
- 52. Экспериментальная задачаZn
- 53. ПРОВЕРЯЕМ5H2S+6O4+ 4Mg0
- 54. ПРОВЕРЯЕМ4H2S+6O4 +3
- 55. ПРОВЕРЯЕМ2H2S+6O4
- 56. Домашнее заданиеПрочитать текст
- 57. Скачать презентанцию
С помощью каких реакций можно осуществить превращения:S H2S S SO2 Na2SO3 SO2 SO3
Слайды и текст этой презентации
Слайд 1Серная кислота
(к рабочей тетради О.Г. Габриеляна «Химия- 9 класс»
Составитель: Малышева
А.А. -учитель химии высшей
Слайд 21 Задачи урока
-изучить свойства
разбавленной серной кислоты
-изучить свойства концентрированной серной кислоты
установить взаимосвязь свойств кислоты
и областей её примененияСлайд 23
Тяжелая маслянистая жидкость
без запаха
Не проводит электрический ток
гигроскопичность
нелетуча
Физические свойства серной
кислоты
H2SO4
Проводит электрический ток
Слайд 26 Химические свойства
разбавленной серной кислоты
1) С основаниями
2) С основными
оксидами3) С растворами солей
( качественная реакция)
4)С металлами ,стоящими в ряду активности до водорода ( исключение- свинец)
Слайд 28Взаимодействие разбавленной серной кислоты с основными оксидами
3H2SO4 + Fe2O3 =
Fe2(SO4)3 +3H2O
Слайд 29Взаимодействие разбавленной серной кислоты с растворами солей
H2SO4 + Na2CO3 =
CO2 +H2O +Na2SO4
Слайд 30 КАЧЕСТВЕННЫЕ РЕАКЦИИ
- это реакции, с помощью которых распознают определенные
химические вещества
Слайд 33
Zn0 +H2+1SO4 =
Zn+2SO4 +H20
ОКИСЛИТЕЛЬ - Н+
Взаимодействие разбавленной серной кислоты с металлами
Слайд 35
Сильный окислитель
а) H2S+6O4 + Mg0 = H2S-2 + Mg+2SO4
+ Н2О
б) H2S+6O4 + Zn0 = S0 + Zn+2SO4 +
Н2Ов) H2S+6O4 + Cu0 = S+4O2 + Cu+2SO4 + Н2О
г) C0 +2H2S+6O4 = C+4O2 +2S+4O2 + 2H2O
ОКИСЛИТЕЛЬ – S+6O4
Слайд 36Обугливание сахара концентрированной
серной кислотой
C11H22O11 + H2SO4 = 12C
+ H2SO4 . 11 H2O + SO2
Слайд 53 ПРОВЕРЯЕМ
5H2S+6O4+ 4Mg0 = 4 Mg+2SO4
+ H2S2 -+4H2O
Ок-ль S+6 + 8е
S-2 1 восстановл.8
В-ль Mg0 – 2е Mg+2 4 окисление
Слайд 54 ПРОВЕРЯЕМ
4H2S+6O4 +3 Zn0
3 Zn+2SO4 + 4H2O + S0
Ок-ль S+6 +6е
S0 1 восстановл.6
В-ль Zn0 – 2е Zn+2 3 окисление
Слайд 55 ПРОВЕРЯЕМ
2H2S+6O4 + Cu0
Cu+2SO4 + S+4O2 + 2H2O
В-ль Cu0 – 2е
Сu+2 1 окисление2
о-ль S+6 + 2е S0 1 восстановл.
Слайд 56 Домашнее задание
Прочитать текст учебника на
стр.101-104
В рабочей тетради закончить упражнения (кроме упражнения на производство серной кислоты).
К следующему уроку подготовить рассказ о свойствах разбавленной и концентрированной серной кислот.