Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Воздействие серной кислоты на углеводы
Содержание
- 1. Воздействие серной кислоты на углеводы
- 2. Слайд 2
- 3. МоносахаридыМоносахариды – углеводы,
- 4. ДисахаридыДисахариды – углеводы,
- 5. ПолисахаридыПолисахариды - крахмал, гликоген,
- 6. Серная кислотаСерная кислота
- 7. Явление дегидратации углеводов хорошо известно
- 8. Цель исследования:Определение зависимости скорости дегидратации углеводов от
- 9. Методика экспериментаВ стакан на 50 или
- 10. Практическая работаИсследуя зависимость скорости дегидратации
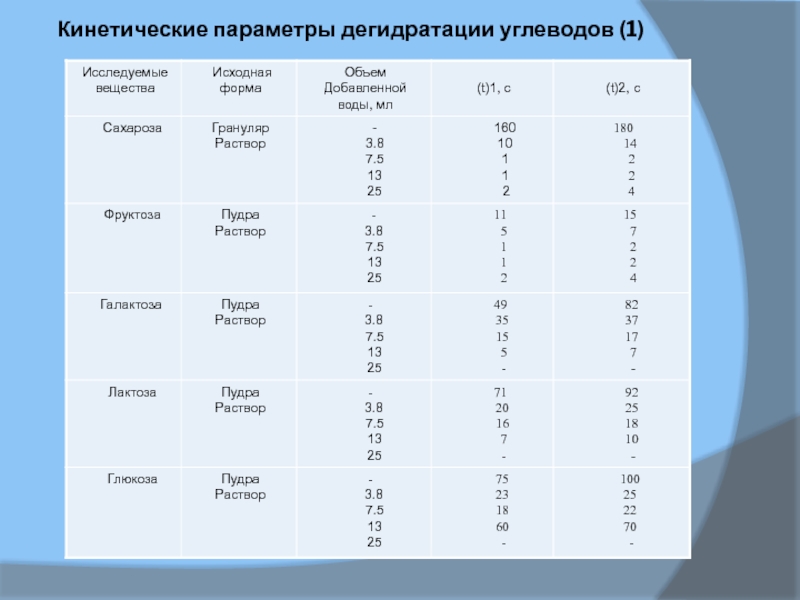
- 11. Кинетические параметры дегидратации углеводов (1)
- 12. сахароза
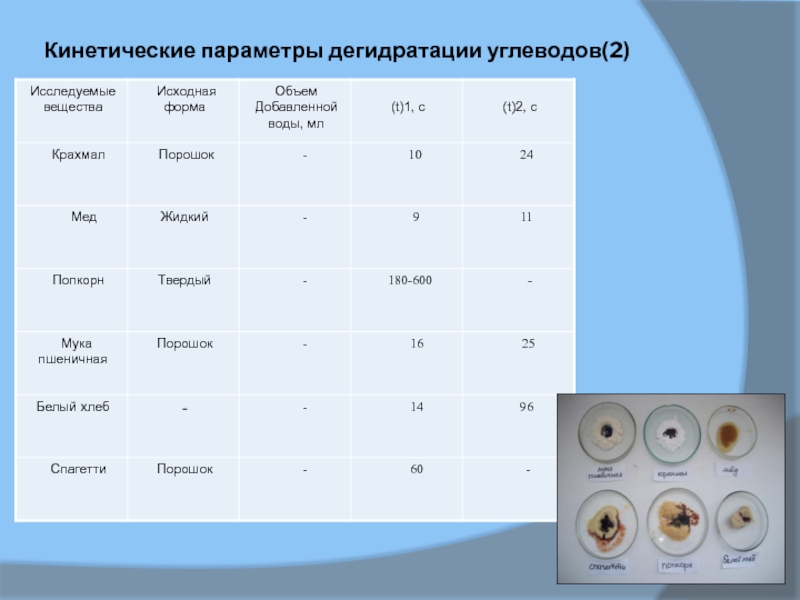
- 13. Кинетические параметры дегидратации углеводов(2)
- 14. Слайд 14
- 15. Результаты исследованияВ таблице 1и 2 приведены
- 16. Исследование основано на том, что разные углеводы
- 17. Слайд 17
- 18. Техника безопасности:Опыт выполняется в
- 19. Список литературы:1. Артеменко А. И. Органическая химия.
- 20. Спасибо за внимание
- 21. Скачать презентанцию
УглеводыУглеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем водород и кислород находятся в них, как правило, в таком
Слайды и текст этой презентации
Слайд 2 Углеводы
Углеводы – органические
вещества, молекулы которых состоят из атомов углерода, водорода и кислорода,
причем водород и кислород находятся в них, как правило, в таком же соотношении, как и в молекуле воды (2:1).Общая формула углеводов – Cn(H2O)m, т.е. они как бы состоят из углерода и воды, отсюда и название класса, которое имеет исторические корни.
Углеводы можно разделить на три основные группы: моносахариды, дисахариды и полисахариды.
Слайд 3 Моносахариды
Моносахариды – углеводы, которые не подвергаются
гидролизу. В свою очередь, в зависимости от числа атомов углевода
моносахариды подразделяются на триозы, тетрозы, пентозы, гексозы и т. д.В природе моносахариды представлены преимущественно пентозами и гексозами.
К гексозам, имеющим общую молекулярную формулу С6Н12О6, относят, например, фруктозу и глюкозу.
Слайд 4 Дисахариды
Дисахариды – углеводы, которые гидролизуются с
образованием двух молекул моносахаридов, например гексоз.
К дисахаридам относится: сахароза, мальтоза,
лактоза.Сладкий вкус разных моно- и дисахаридов различен. Так, самый сладкий моносахарид – фруктоза – в полтора раза слаще глюкозы, которую принимают за эталон.
Слайд 5 Полисахариды
Полисахариды - крахмал, гликоген, декстрины, целлюлоза…- углеводы,
которые гидролизуются с образованием множества молекул моносахаридов, чаще всего глюкозы.
Полисахариды необходимы для жизнедеятельности животных и растительных организмов. Они являются одним из основных источников энергии, образующейся в результате обмена веществ организма. Они принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях, являются основной массой органического вещества в биосфере.Слайд 6 Серная кислота
Серная кислота – один из
основных продуктов химической промышленности.
Специфические свойства концентрированной серной кислоты:
Концентрированная серная кислота – сильный окислитель: при нагревании она реагирует почти со всеми металлами (исключение Au, Pt и некоторые другие). В этих реакциях в зависимости от активности металла и условий выделяется SO2, H2S, S.
Концентрированная серная кислота энергично реагирует с водой с образованием гидратов.
Концентрированная серная кислота отщепляет от органических веществ водород и кислород в виде воды, обугливая их.
Слайд 7 Явление дегидратации углеводов хорошо известно на примере обугливания
сахара под действием концентрированной серной кислоты. Данная реакция является характерной
для углеводов. Серная кислота аналогичным образом действует на другие углеводсодержащие продукты и углеводы. Скорость протекания реакции и внешние признаки определяются типом углевода.Слайд 8Цель исследования:
Определение зависимости скорости дегидратации углеводов от условий протекания реакции.
Задачи исследования:
Познакомиться со специфическими свойствами концентрированной серной кислоты.
Выяснить как концентрированная серная кислота и раствор воздействует на углеводы.
Объекты исследования:
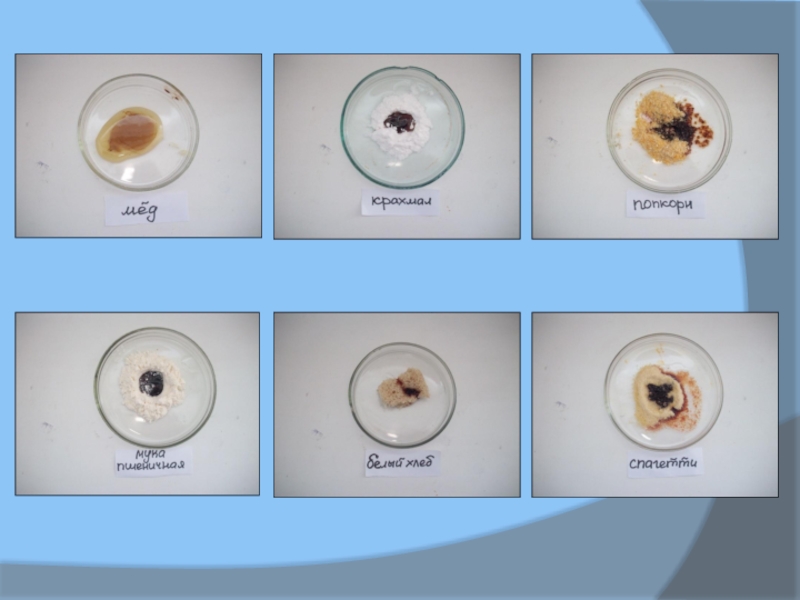
Сахароза, фруктоза, галактоза, лактоза, глюкоза, крахмал, мед, попкорн, мука пшеничная, белый хлеб, спагетти.
Слайд 9 Методика эксперимента
В стакан на 50 или 100 мл помещали
10 г образца углевода или углеводсодержащего продукта, добавляли 10 мл
концентрированной серной кислоты и аккуратно размешивали до образования однородной массы.Из соображений безопасности стакан устанавливали в чашу с песком.
Через некоторое время появляются признаки реакции: смесь приобретает желтоватый оттенок, затем темнеет и становится черной, вслед за этим начинается вспенивании: в стакане образуется пористый углеродистый столб черного цвета.
Cn(H2O)m+H2SO4 → nCn+H2SO4*mH2O
Слайд 10 Практическая работа
Исследуя зависимость скорости дегидратации от условий протекания
реакции, в стакан перед добавлением серной кислоты помещали определенный объем
воды. В процессе выполнения опыта фиксировали характерные кинетические параметры реакции: t(1) – время появления первых признаков почернения и t(2) – время, когда высота углеродистого столба достигает отметки 100 или 50 мл на стакане.Оборудование и материалы:
концентрированная серная кислота, дистиллированная вода, образцы углеводов, стаканы на 50-100 мл, чашки Петри, стеклянные палочки, секундомер, учебно-лабораторный комплекс, резиновые перчатки, защитные очки, халат, песок, питьевая сода (NaHCO3).
Слайд 15 Результаты исследования
В таблице 1и 2 приведены результаты, полученные при
дегидратации ряда углеводов в разных ситуациях. Параметры t(1) и t(2)
довольно индивидуальны для каждого углевода, однако использовать их не посредственно для идентификации разных сахаров затруднительно, так как кинетика реакции во многом определяется исходной формой реагента и количеством добавляемой воды. Например, в случае сахарозы наибольшая скорость разложения достигается для сахарной пудры, увеличение объема воды сначала повышает скорость реакции, а затем (свыше 50 мл) снижает ее до нуля.Слайд 16Исследование основано на том, что разные углеводы обугливаются серной кислотой
с разной скоростью, поэтому можно не только подтвердить химические свойства
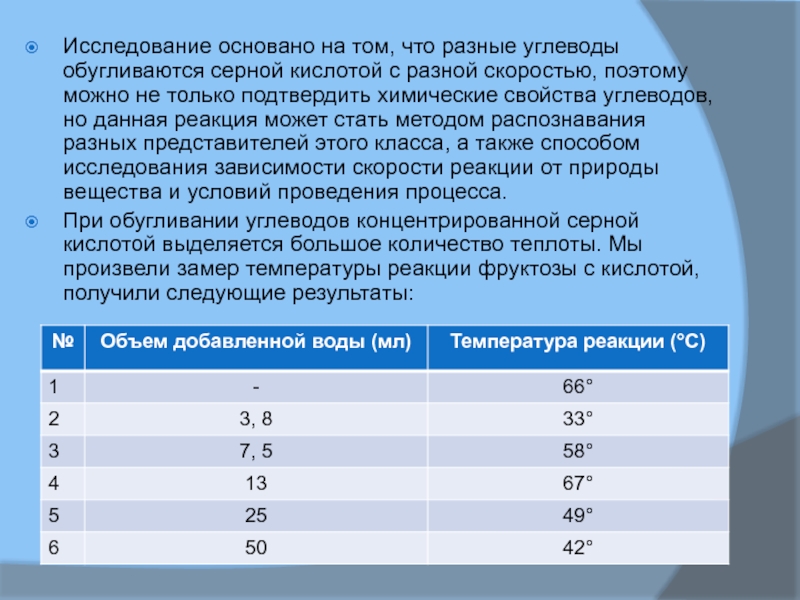
углеводов, но данная реакция может стать методом распознавания разных представителей этого класса, а также способом исследования зависимости скорости реакции от природы вещества и условий проведения процесса.При обугливании углеводов концентрированной серной кислотой выделяется большое количество теплоты. Мы произвели замер температуры реакции фруктозы с кислотой, получили следующие результаты:
Слайд 17 Выводы
Дегидратация сахаров зрелищна
и эффектна.
Мы научились экспериментально определять простейшие кинетические характеристики при обугливании
углеводов.С помощью полученных результатов можно практически распознавать углеводы.
Нужно учитывать, что концентрированная серная кислота очень опасна и при работе с ней нужно быть предельно осторожными.
Слайд 18 Техника безопасности:
Опыт выполняется в защитных очках и
резиновых перчатках. Если пена выходит за пределы стакана, необходимо накрыть
его сверху большим стаканом. Для нейтрализации остатков кислоты реакционную смесь помещают в большую емкость и обрабатывают небольшими порциями гидрокарбоната натрия (на 40 мл концентрированной серной кислоты – около 121 г питьевой соды).Слайд 19Список литературы:
1. Артеменко А. И. Органическая химия. М.: Высшая школа,
2001.
2.Головнер В. Н. Химия. Интересные уроки. Из зарубежного опыты преподавания.
8-11 классы. М.: НЦ ЭНАС, 2002.3. Карцова А. А. Покорение вещества. Органическая химия. СП.: Химиздат, 1999.
4. Цветков Л.А. Эксперимент по органической химии в средней школе. Методика и техника. М.: Школьная пресса, 2000.