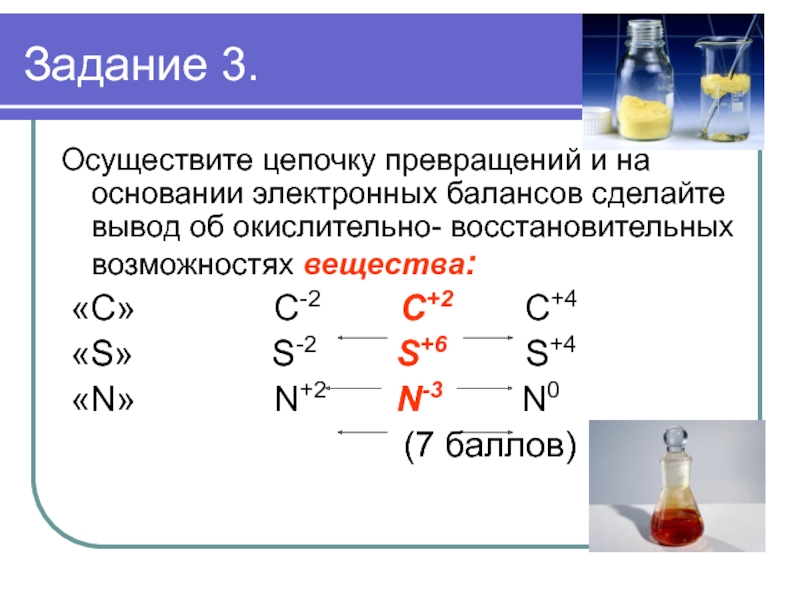
простых веществ, а также их соединений.
Закрепить понимание зависимости свойств от
типа кристаллической решётки, вида химической связи, строения атома, степени окисления элемента; знания о качественных реакциях на ионы.2. Совершенствовать навыки составления уравнений реакций в молекулярном и ионном виде, электронного баланса ОВР, проведения и наблюдения химического эксперимента.
3. Добиваться четких и лаконичных ответов, аккуратного выполнения заданий. Продолжить формирование умений анализировать, делать выводы, работать самостоятельно.
Задачи.