кристалла кварца и горного хрусталя
на его основе создано промышленное производство
керамики, стекла, цемента полупроводник
* по распространению в земной коре занимает 2-е место после кислорода (26 %) В природе встречается в виде оксидов, силикатов и алюмосиликатов
* его оксиды являются основной частью песка и глины



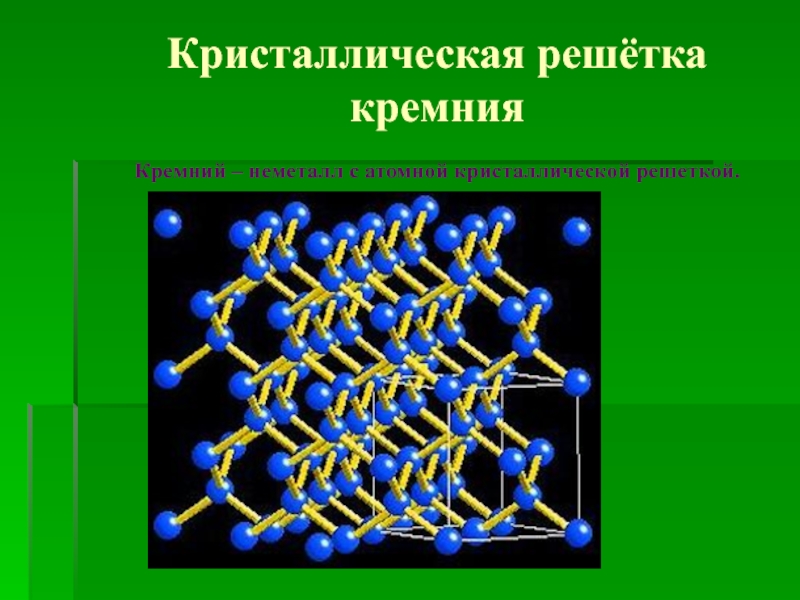
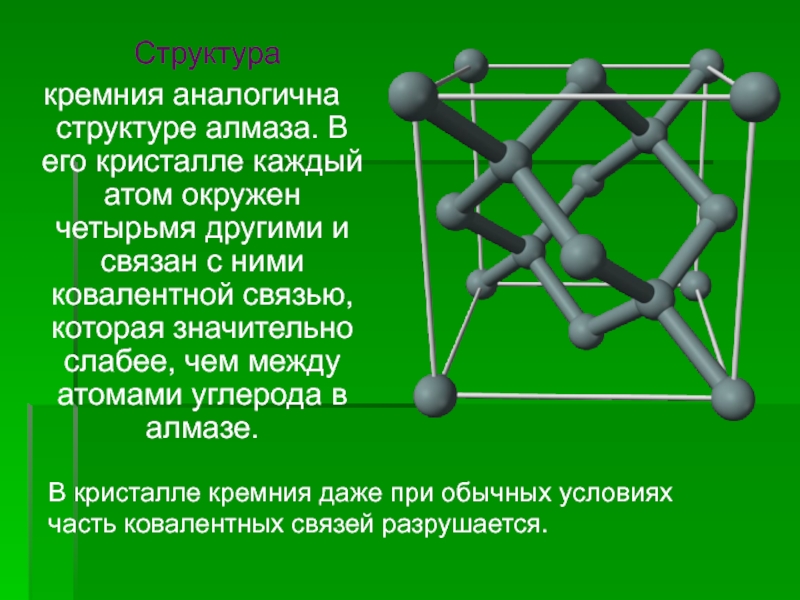
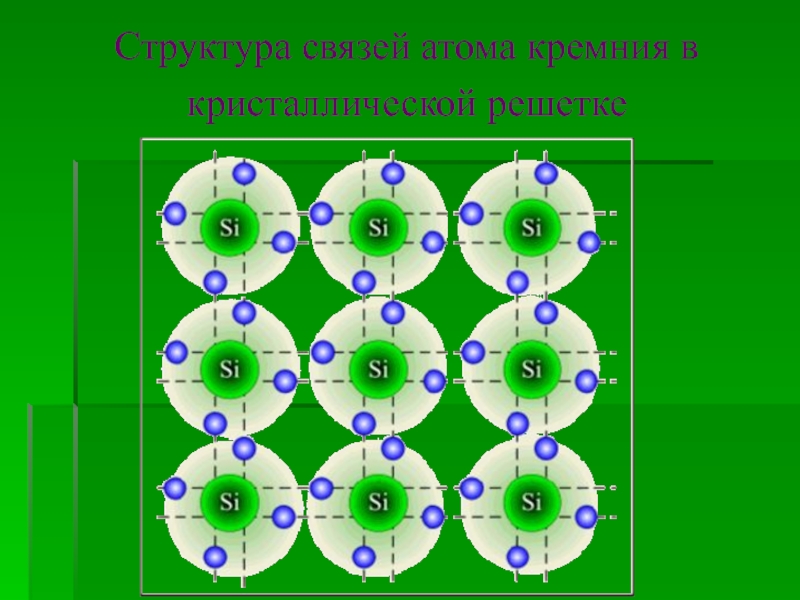
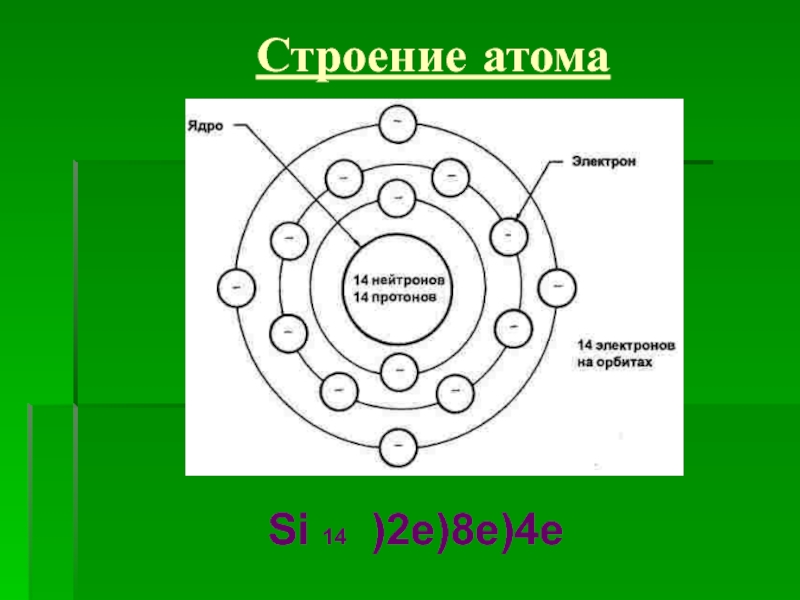







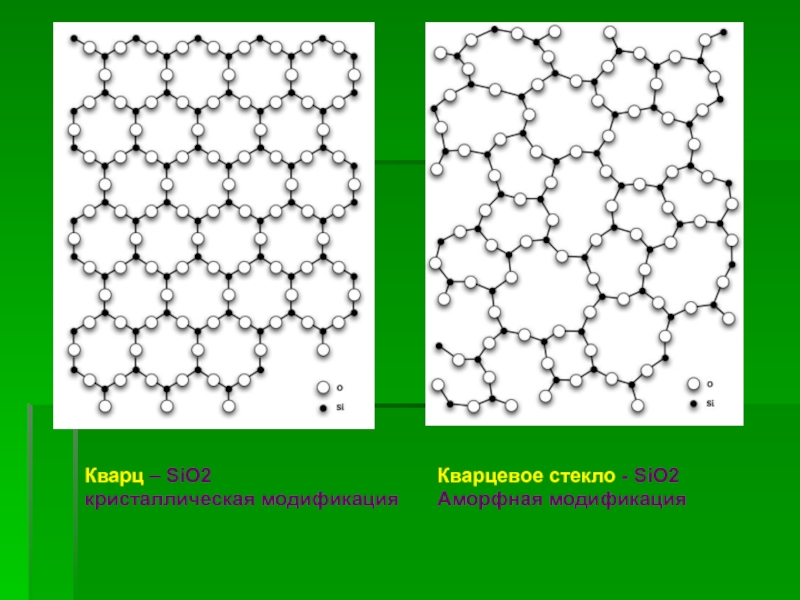
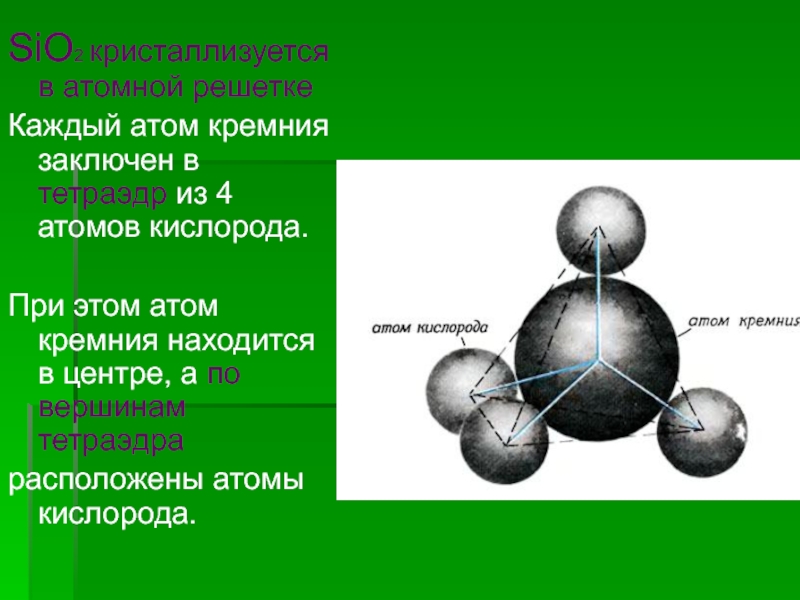





![Кремний СиликатыСиликаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа СиликатыСиликаты – химические соединения, содержащие кремнекислотные остатки различного состава [SinOm]. Основа всех силикатов - кремнекислородный тетраэдр [SiO4],](/img/tmb/2/183318/ea468d30fa3baec3dab6851ef0f500dd-800x.jpg)





















