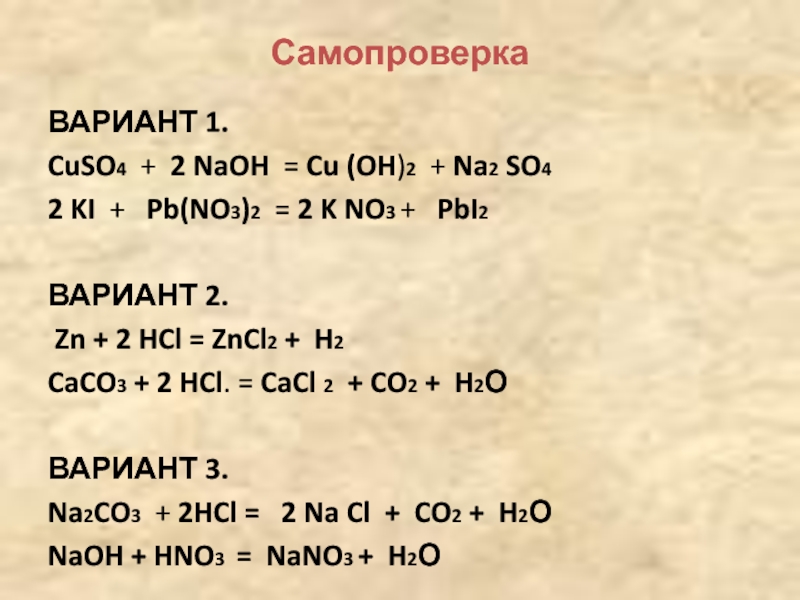
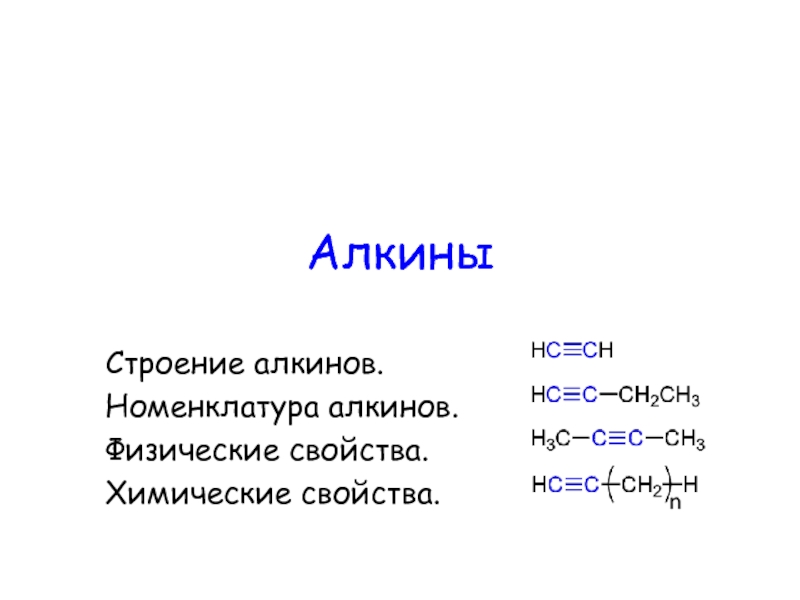
Увельского района Челябинской области
Презентация к уроку
«Обратимость химических реакций»
Выполнила: Извекова Светлана Вениаминовна,
учитель химии высшей категории.
С.Кичигино, 2014г.