Слайд 2.Общая характеристика металлов.
Большинство химических элементов относят к металлам — 92
из 114 известных элементов.
Все металлы, кроме ртути, в обычном состоянии твердые
вещества и имеют ряд общих свойств.
Общие свойства металлов: Металлы — это ковкие, пластичные, тягучие вещества, имеющие металлический блеск и способны проводить тепло и электрический ток.
Слайд 3Атомы элементов-металлов отдают электроны внешнего (а некоторые — и предвнешнего) электронного слоя,
превращаясь в положительные ионы.
Это свойство атомов металлов, определяется тем, что
они имеют сравнительно большие радиусы и малое число электронов (в основном от 1 до 3 на внешнем слое).
Исключение составляют лишь 6 металлов: атомы германия, олова, свинца на внешнем слое имеют 4 электрона, атомы сурьмы и висмута — 5, атомы полония — 6.
Слайд 4В Периодической системе химических элементов Д. И. Менделеева металлы находятся
ниже диагонали бор — астат, а также выше ее, в
побочных подгруппах.
В периодах и главных подгруппах действуют закономерности в изменении металлических, а значит, восстановительных свойств атомов элементов.
В группах сверху вниз восстановительные свойства усиливаются, так как идет увеличение радиуса атома.
В периодах слева направо восстановительные свойства уменьшаются.
Слайд 8Химические элементы, расположенные вблизи диагонали бор — астат (Be, Al, Ti, Ge,
Nb, Sb) обладают двойственными свойствами: в одних своих соединениях ведут
себя как металлы, в других проявляют свойства неметаллов.
В побочных подгруппах восстановительные свойства металлов с увеличением порядкового номера чаще всего уменьшаются.
Слайд 10атомы (ионы) элементов металлов являются составной частью соединений, определяющих обмен
веществ в организме человека, животных.
Например, в крови человека найдено
76 элементов, из них только 14 не являются металлами.
В организме человека некоторые элементы-металлы (кальций, калий, натрий, магний) присутствуют в большом количестве, т. являются макроэлементами.
А такие металлы, как хром, марганец, железо, кобальт, медь, молибден присутствуют в небольших количествах, т. е. это микроэлементы.
Слайд 13Особенности строения металлов главных подгрупп I-III групп
Щелочные металлы — это металлы главной
подгруппы I группы.
Слайд 14 Их атомы на внешнем энергетическом уровне имеют по одному электрону.
Щелочные металлы — сильные восстановители. Их восстановительная способность и химическая активность возрастают
с увеличением порядкового номера элемента (т. е. сверху вниз в Периодической таблице).
Все они обладают электронной проводимостью.
Слайд 15 Прочность связи между атомами щелочных металлов уменьшается с увеличением порядкового
номера элемента.
Также снижаются их температуры плавления и кипения.
Щелочные
металлы взаимодействуют со многими простыми веществами — окислителями.
Слайд 18мягкий щелочной металл серебристо-белого цвета.
литий и его соли окрашивают пламя в карминово-красный цвет, это
является качественным признаком для определения лития.
Слайд 24Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень
лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы.
Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет
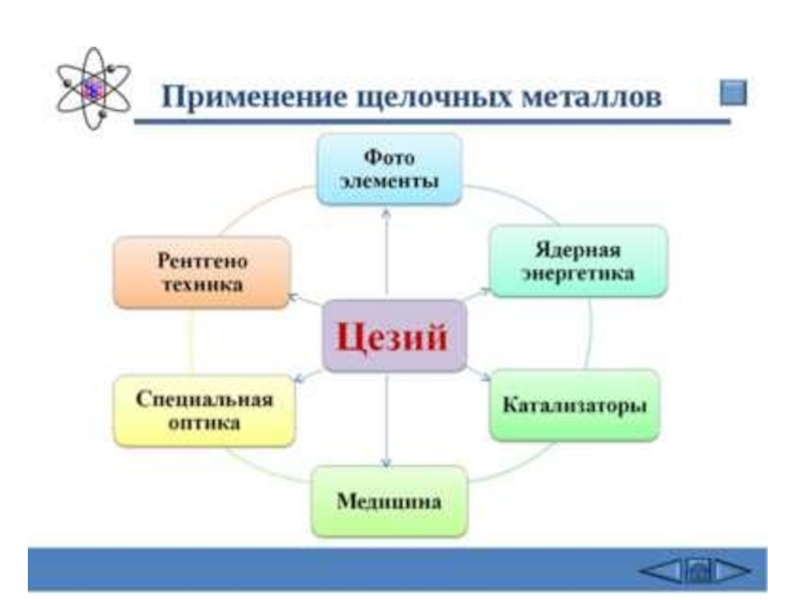
Слайд 33применение
Радоактивный металл. Вследствие высокой радиоактивности исследования проводятся с микроскопическими количествами.
Хлорид
франция FrCl использовался для обнаружения раковых опухолей, но по причине
чрезвычайно высокой стоимости эту соль в масштабных разработках использовать невыгодно.
В настоящее время франций и его соли применения пока что не имеют, в связи с малым периодом полураспада и высокой радиоактивностью.
Слайд 34Химические свойства
1. Активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH +
H2
2Li + 2H2O → 2LiOH + H2
2. Реакция с кислотами:
2Na +
2HCl → 2NaCl + H2
Слайд 353. Реакция с кислородом:
4Li + O2 → 2Li2O(оксид лития)
2Na + O2 → Na2O2 (пероксид
натрия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под
слоем органических растворителей (керосин и др.).
Слайд 364. В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2 →
2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
5. Качественная реакция на катионы
щелочных металлов - окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Слайд 38Щелочноземельными
элементами называются элементы главной подгруппы II группы.
Атомы этих элементов содержат на
внешнем энергетическом уровне по два электрона.
Слайд 39Они являются восстановителями, имеют степень окисления +2.
В этой главной подгруппе соблюдаются
общие закономерности в изменении физических и химических свойств, связанные с
увеличением размера атомов по группе сверху вниз, также ослабевает и химическая связь между атомами.
С увеличением размера иона ослабевают кислотные и усиливаются основные свойства оксидов и гидроксидов.
Слайд 52применение
Добавляет с плавам ковкость и пластичность. В смеси с барием и
кальцием взрывоопасен.
компонент пиротехнических веществ для сигнальных ракет.
SrSO4 – наполнитель для
красок и резины.
SrCrO4 — компонент лаков и грунтовок в авиастроении.
SrTiO3 – материал производства диэлектрических антенн, проводников и датчиков.
SrCl2 – компонент пиротехнических составов, косметических средств и медицинских препаратов.
90 Стронций 137 цезий используют как компонент радиоактивного топлива.
Самое полезное вещество на основе органических соединений — стронция ранелат — стимулятор роста костной ткани. Данным препаратом проводят лечение остеопороза.
Слайд 54применение
Широко применяются соединения Бария. Пероксид ВаО2 служит для получения пероксида водорода,
для отбеливания шелка и растительных волокон, как дезинфицирующее средство и
как один из компонентов запальных смесей в алюминотермии. Сульфидом BaS удаляют волосяной покров со шкур. Перхлорат Ва(ClО4)2 - один из лучших осушителей. Нитрат Ba(NO3)2 используют в пиротехнике. Окрашенные соли Бария - хромат BaCrO4 (желтый) и манганат ВаМnO4 (зеленый) - хорошие пигменты при изготовлении красок.
Слайд 59Главную подгруппу III группы
составляют элементы бор, алюминий, галлий, индий и
таллий, элементы относятся к р-элементам. На внешнем энергетическом уровне они имеют по
три (s2p1) электрона, чем объясняется сходство свойств.
Степень окисления +3.
Внутри группы с увеличением заряда ядра металлические свойства увеличиваются.
Слайд 62Бор — элемент-неметалл, а у алюминия уже металлические свойства. Все
элементы образуют оксиды и гидроксиды.
В реакциях с водой они образуют растворимые
в воде основания (щелочи).