обозначается символом Cr
Электронная формула:
24Cr )2)8)13)1 1s22s22p63s23p63d54s1
ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
Степень окисления:
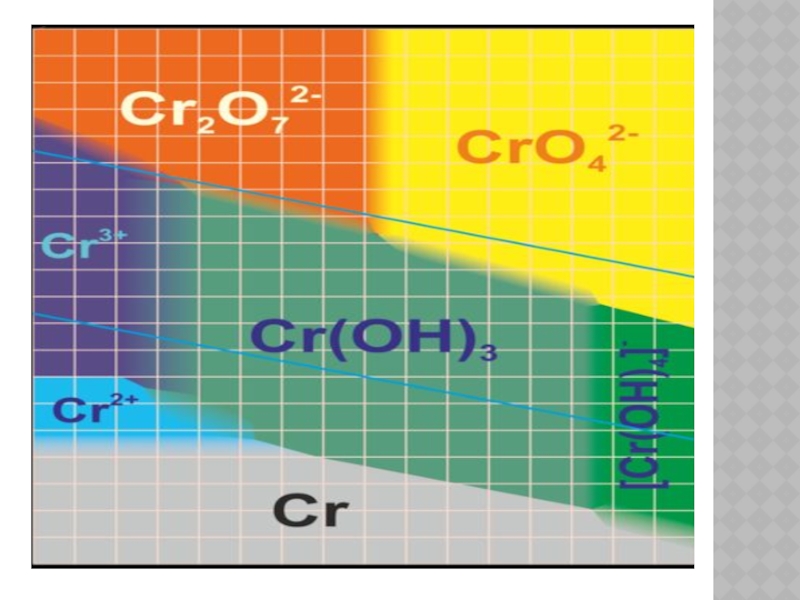
+1; +4; +5; +2; +3; +6; - (наиболее устойчивы в соединениях хрома).