Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация по химии на тему "Щелочные металлы"
Содержание
- 1. Презентация по химии на тему "Щелочные металлы"
- 2. Положение в периодической системеНачальные элементы образуют главную
- 3. Нахождение в природе
- 4. Вследствие очень легкой окисляемости щелочные металлы встречаются
- 5. Физические свойства щелочных металловЛитий, натрий, калий, рубидий
- 6. В кристаллическом состоянии все они имеют объемоцентрированную
- 7. Слайд 7
- 8. Химические свойстваВзаимодействие с неметалламиЩелочные металлы легко реагируют
- 9. ПолучениеМеталлы, относящиеся к 1-й группе, в промышленности
- 10. ПрименениеЛитий служит сырьем в атомной энергетике, используется
- 11. Литератураhttp://www.syl.ru/article/141071/mod_schelochnyie-metallyi-stroenie-fizicheskie-i-himicheskie-svoystva-primeneniehttp://ido.tsu.ru/schools/chem/data/res/neorg/uchpos/text/g4_2_5.htmlhttp://ido.tsu.ru/schools/chem/data/res/neorg/uchpos/text/g4_2_4.html
- 12. Скачать презентанцию
Положение в периодической системеНачальные элементы образуют главную подгруппу I группы и называются щелочными металлами. Свое название они получили от названия соответствующих им гидроксидов, хорошо растворимых в воде, — щелочей.
Слайды и текст этой презентации
Слайд 4Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно
в виде соединений. Натрий и калий принадлежат к распространенным элементам:
содержание каждого из них в земной коре равно приблизительно . Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлорид натрия содержится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлорида или двойных солей с натрием и магнием. Однако большие скопления солей калия, имеющие промышленное значение, встречаются редко. Наиболее важными из них являются соликамские месторождения в СССР, страссфуртские в ГДР и эльзасские — во Франции. Залежи натриевой селитры находятся в Чили. В воде многих озер содержится сода. Наконец, огромные количества сульфата натрия находятся в заливе Кара-Богас-Гол Каспийского моря, где эта соль в зимние месяцы толстым слоем осаждается на дне.Значительно меньше, чем натрий и калий, распространены литий, рубидий и цезий. Чаще других встречается литий, но содержащие его минералы редко образуют большие скопления. Рубидий и цезий содержатся в небольших количествах в некоторых литиевых минералах.
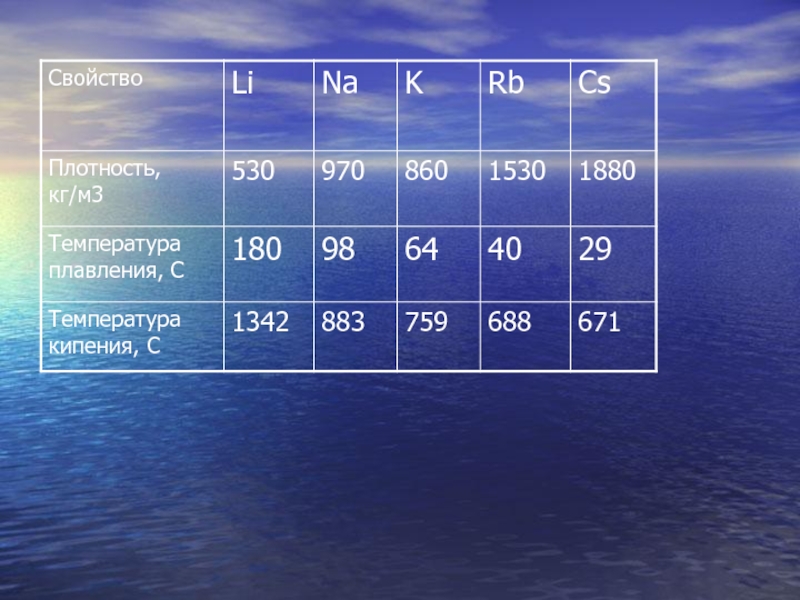
Слайд 5Физические свойства щелочных металлов
Литий, натрий, калий, рубидий в свободном состоянии
серебристо-белые металлы, цезий имеет золотисто-желтый цвет.
Все металлы очень мягкие и
пластичные. Наибольшей твердостью обладает литий, остальные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Слайд 6В кристаллическом состоянии все они имеют объемоцентрированную кристаллическую решетку с
металлическим типом химической связи, что обуславливает их высокую тепло- и
электропроводность.Все щелочные металлы имеют небольшую плотность, самый легкий металл – литий, его плотность составляет всего 0,53 г/см3.
Металлы имеют достаточно низкие температуры плавления и кипения, причем с увеличением порядкового номера элемента температура плавления металла понижается.
Все металлы очень активны, поэтому их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Слайд 8Химические свойства
Взаимодействие с неметаллами
Щелочные металлы легко реагируют с кислородом, но
каждый металл проявляет свою индивидуальность
Взаимодействие с водой
Все щелочные металлы
реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывомВзаимодействие с кислотами
Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой. При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно. Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся.
Взаимодействие с органическими веществами
Щелочные металлы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства