Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация для урока "Подгруппа азота"
Содержание
- 1. Презентация для урока "Подгруппа азота"
- 2. Девиз урока:«Нет жизни без азота, ибо он
- 3. Слайд 3
- 4. История открытияАзот (N2) – это один из элементов
- 5. Химические свойства азотаПри обычных условиях азот малоактивен.
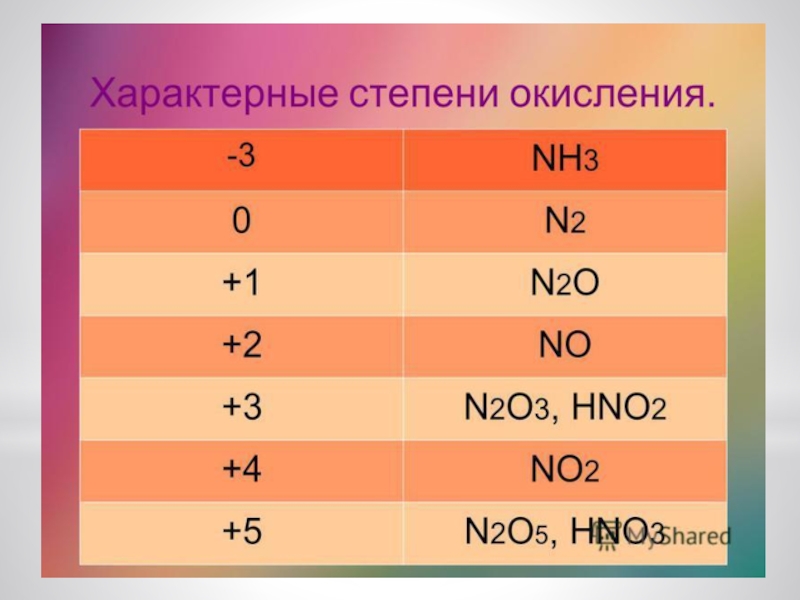
- 6. Проверь себя!N2+3H2 2NH3 +QОбратимаяСоединения ЭкзотермическаяГомогеннаяКаталитическая N2+O2 2NO –QОбратимаяСоединенияЭндотермическаяГомогеннаяНекаталитическая
- 7. Слайд 7
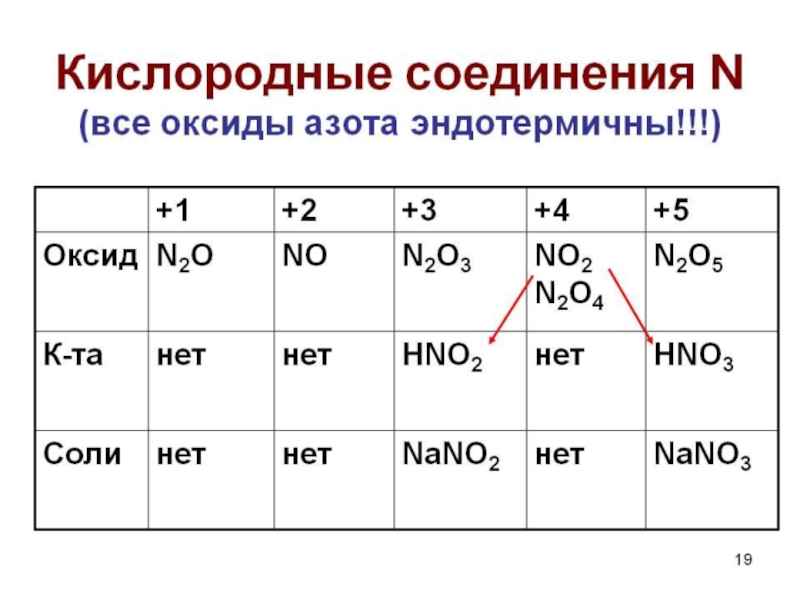
- 8. Оксиды азота
- 9. Слайд 9
- 10. Слайд 10
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. В состав растений входят около
- 16. Слайд 16
- 17. Слайд 17
- 18. АммиакАммиа́к— NH3, нитрид водорода, при нормальных условиях
- 19. Промышленный способ получения аммиака основан на прямом
- 20. «Извержение вулкана» (разложение бихромата аммония)(NH4)2Cr2O7=Cr2O3+N2↑+4H2O для большего эффекта добавляется Mg
- 21. Жидкий азот способен за считанные секунды заморозить
- 22. Применение жидкого азотаВ косметологии жидкий азот применяется
- 23. Вещества в жидком азоте становятся хрупкими.
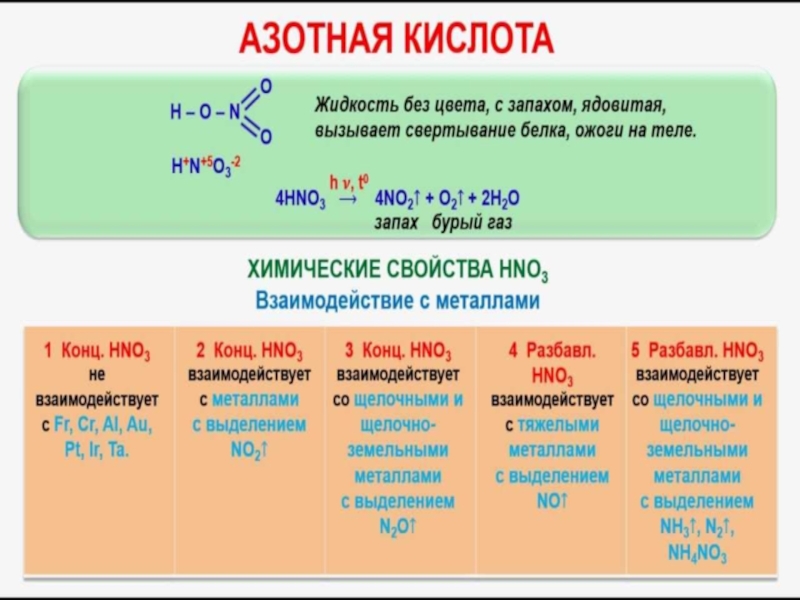
- 24. Домашнее задание:1.Написать уравнения реакций азотной кислоты (концентрированной
- 25. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Муниципальное бюджетное общеобразовательное учреждение «Батагайская средняя общеобразовательная школа»
МО «Верхоянский
район» Республики Саха (Якутия)
Слайд 2Девиз урока:
«Нет жизни без азота, ибо он является непременной составной
частью белков.»
Д.Н.Прянишников Слайд 4История открытия
Азот (N2) – это один из элементов жизни: он входит
в состав белков и нуклеиновых кислот.
В1772 году английский химик Дэниэл
Резерфорд описал его как «испорченный воздух», неспособный поддерживать горение, не вступающий в реакцию со щелочами и непригодный для дыхания. Само слово «азот» (от греческого – «безжизненный») предложил 15 лет спустя Антуан Лавуазье.При нормальных условиях это газ, не имеющий цвета, запаха и вкуса, тяжелее воздуха и практически инертный. При температуре -195,8 °C он переходит в жидкое состояние; при -209,9 °C – кристаллизуется, напоминая снег.
Азот входит в состав: NaNO3 KNO3 NH4NO3 (NH4)2SO4 NH3 HNO3 HNO2 NH4OH NH4CL .
Слайд 5Химические свойства азота
При обычных условиях азот малоактивен. Это объясняется прочностью
химических связей в молекуле. При высоких температурах связи между атомами
ослабевают и азот становится реакционноспособным. Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид:6Li + N2 = 2Li3 N
При повышенной температуре реагирует с некоторыми металлами:
3Mg + N2 = Mg3 N2
С повышением температуры активность молекулярного азота увеличивается. При взаимодействии азота с водородом при нагревании, повышенном давлении и присутствии катализатора образуется аммиак:
N2 + 3H2 = 2 NH3
С кислородом азот соединяется только в электрической дуге с образованием оксида азота (II):
N2 + O2 = 2 NO-Q ( t=2000 °C)
Такая же реакция происходит и при электрических разрядах в атмосфере во время грозы.
Слайд 6Проверь себя!
N2+3H2 2NH3 +Q
Обратимая
Соединения
Экзотермическая
Гомогенная
Каталитическая
N2+O2
2NO –Q
Обратимая
Соединения
Эндотермическая
Гомогенная
Некаталитическая
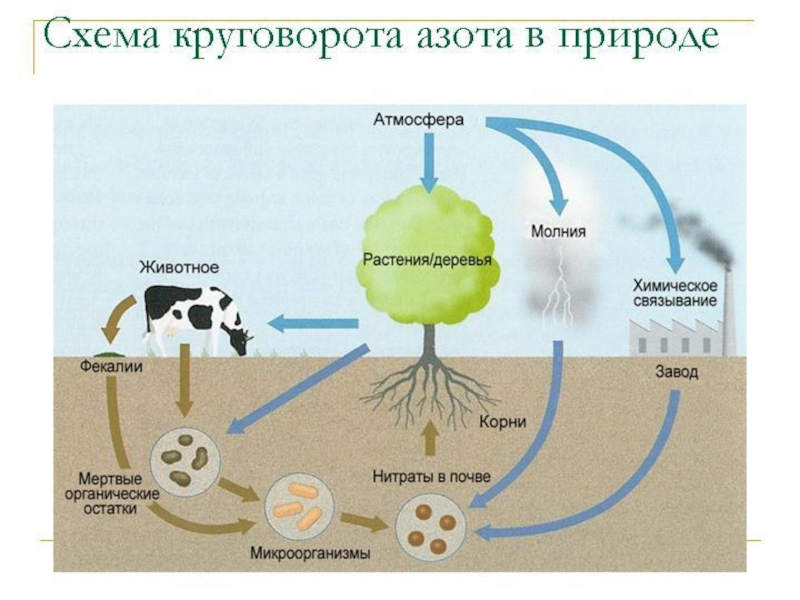
Слайд 15 В состав растений входят около 70 элементов. Некоторые
из них макроэлементы- необходимы растениям в больших количествах; другие же
микроэлементы-требуются в незначительных количествах.Макроэлементы-углерод,кислород,водород,азот,фосфор,сера,магний.калий,кальций.
Три важнейших элемента- азот N, фосфор Р и калий К- необходимы растениям в больших количествах. Поэтому удобрения, содержащие эти элементы, получают в промышленных масштабах.
Азот входит в состав белков. Входит он и в нуклеиновые кислоты, вторые по важности вещества любой живой клетки, представляющие особое значение для построения белков и несущие наследственные признаки организма. Живые катализаторы – ферменты — тоже белковые тела. Азот содержится в хлорофилле, без которого растения не могут усваивать солнечную энергию. Азот входит в липоиды, алкалоиды и многие другие органические соединения, возникающие в растениях.
При его недостатке задерживается образование зеленой массы, растения плохо растут, их листья становятся бледно-зелеными и даже желтеют. Азотные удобрения особенно нужны в весенний период.
Вещества, содержащие три важнейших элемента N, Р и К и способные в почвенном растворе диссоциировать на ионы, используют в качестве минеральных удобрений.
Минеральные удобрения: NaNO3 KNO3 NH4NO3 (NH4)2SO4.
Слайд 18Аммиак
Аммиа́к— NH3, нитрид водорода, при нормальных условиях — бесцветный газ
с резким характерным запахом (запах нашатырного спирта).
Аммиак почти вдвое легче
воздуха,очень хорошо растворим в воде.Получение NH3 в лаборатории:
NH4Cl + NaOH = NH3↑ + NaCl + H2O
(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O
NH3 + H2O= NH4OH= NH4+ + OH¯ аммиачная вода
25% водный раствор аммиака называется НАШАТЫРНЫМ СПИРТОМ.
Малиновая окраска фенолфталеина в растворе NH4OH доказывает наличие OH¯
Слайд 19Промышленный способ получения аммиака основан на прямом взаимодействии водорода и
азота:
N2 + 3H2 = 2 NH3 + Q
Условия:
катализатор – пористое
железотемпература – 450 – 500 ˚С
давление – 25 – 30 атм
Химические свойства аммиака
NH3 – сильный восстановитель.
1. Горение аммиака (при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
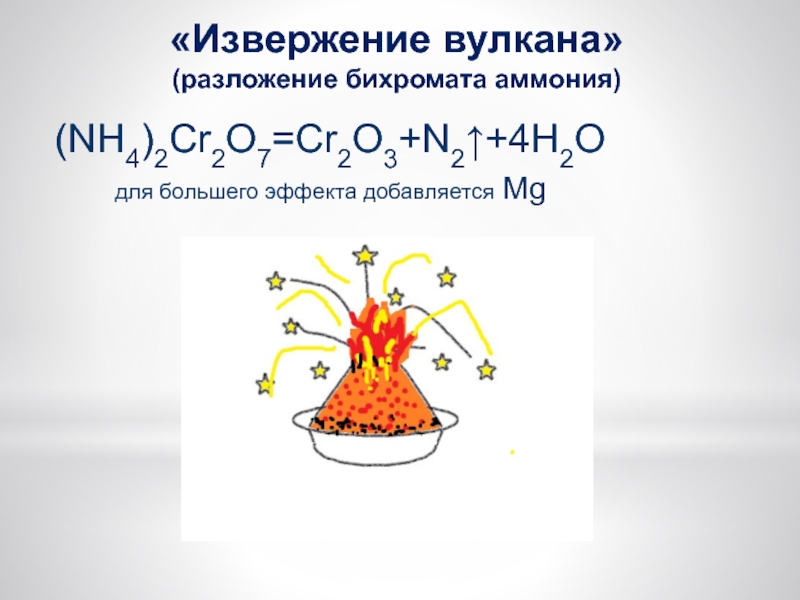
Слайд 20«Извержение вулкана»
(разложение бихромата аммония)
(NH4)2Cr2O7=Cr2O3+N2↑+4H2O
для большего эффекта
добавляется Mg
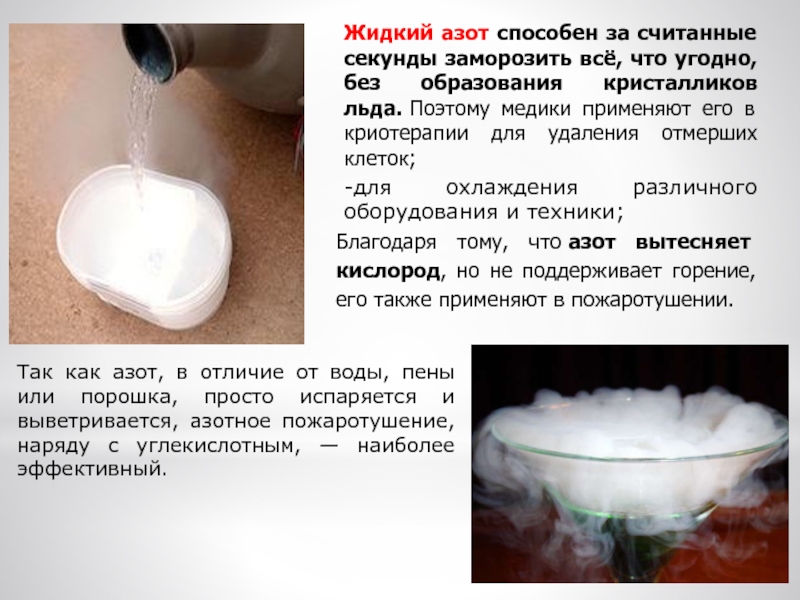
Слайд 21Жидкий азот способен за считанные секунды заморозить всё, что угодно,
без образования кристалликов льда. Поэтому медики применяют его в криотерапии для
удаления отмерших клеток;-для охлаждения различного оборудования и техники;
Благодаря тому, что азот вытесняет кислород, но не поддерживает горение, его также применяют в пожаротушении.
Так как азот, в отличие от воды, пены или порошка, просто испаряется и выветривается, азотное пожаротушение, наряду с углекислотным, — наиболее эффективный.
Слайд 22Применение жидкого азота
В косметологии жидкий азот применяется для лечения вульгарных,
подошвенных и плоских бородавок, папиллом, гипертрофических рубцов, вульгарной угревой сыпи,
угрей.В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения, хладагент, а жидкий азот применяется при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре.
Слайд 24Домашнее задание:
1.Написать уравнения реакций азотной кислоты (концентрированной и разбавленной) с
металлами (серебро, цинк). По электронному балансу поставить коэффициенты.
2. Написать уравнения
разложение нитратов:-нитрат натрия
-нитрат свинца
-нитрат цинка
-нитрат алюминия
-нитрат магния