Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация для урока "металл войны и мирного труда"
Содержание
- 1. Презентация для урока "металл войны и мирного труда"
- 2. КластерFeПростое веществоХимический элементFe2. Строение
- 3. Древние изделия из железа. Самые древние
- 4. ЖелезоFe (лат.
- 5. А знаете ли Вы,
- 6. Самый крупный железный метеорит, получивший название «Гоба»,
- 7. Железо не только основа всего мира, самый
- 8. В бою железо дороже золотаБолее 90% всех
- 9. Где кровь, там
- 10. Железо – орудие войны Чтобы судить о
- 11. Алхимический знак
- 12. Железо – орудие мирного трудаВсего несколько железных
- 13. В 1813 году во время войны с
- 14. Кутубская колонна В Индии недалеко
- 15. Кровавый водопадВ Антарктиде из ледника Тейлора временами
- 16. Химический элемент железоЗадание 1: опишите положение
- 17. Положение Fe в ПТХЭЗадание
- 18. Строение
- 19. Слайд 19
- 20. Строение
- 21. Строение
- 22. Распространенность в природе
- 23. Нахождение в природе Fe3O4Fe2O32Fe2O3. 3H2OFeCO3FeS2
- 24. Физические свойства
- 25. Физические свойства Железо имеет четыре модификации: При
- 26. Химические
- 27. Взаимодействие с
- 28. Взаимодействие с простыми веществами – с
- 29. Взаимодействие со сложными
- 30. Химически чистое
- 31. а) Железо растворяется в HCl
- 32. Слайд 32
- 33. Взаимодействие со сложными
- 34. Взаимодействие со сложными
- 35. Слайд 35
- 36. Взаимодействие
- 37. а) Fe + CuCl₂
- 38. Слайд 38
- 39. Проверьте себя:1) 3 Fe2O3
- 40. Железо сегодняГидроэлектро-станции и опорылиний электропередачТрубопроводы для воды,нефти и газаАвтомобили ,Тракторы,Подводные лодки,Бытовые приборы,Другие предметы
- 41. Применение железа
- 42. Fe В организме здорового
- 43. Основная роль железа в организме – участие
- 44. Содержание железа в продуктах
- 45. Недостаток железа в организме В случае недостаток железа в организме наблюдаются следующие симптомы:
- 46. Недостаток железа в организме
- 47. «Ржавое железо не блестит» (никчемность и бездеятельность
- 48. Заключение «Железные рудокопи доставляют человеку
- 49. отрывок из «Поэмы о периодическом
- 50. Скачать презентанцию
Слайды и текст этой презентации
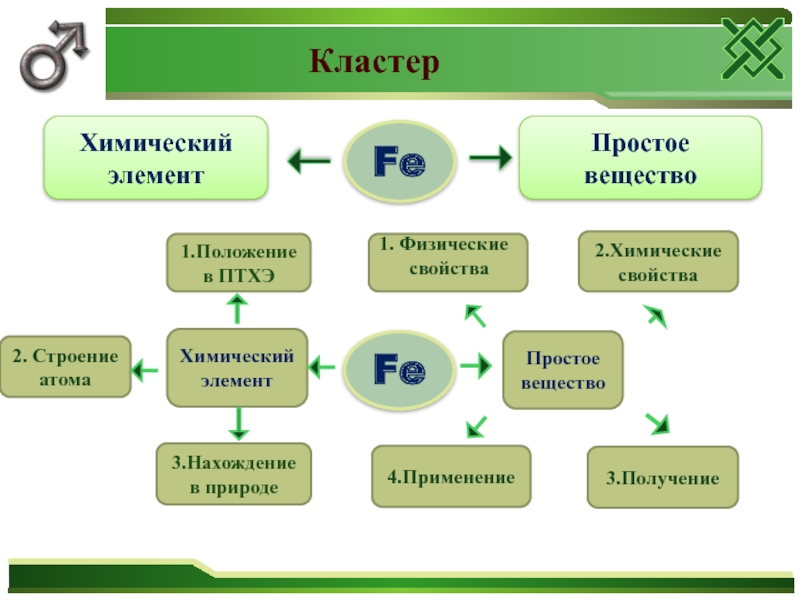
Слайд 2Кластер
Fe
Простое вещество
Химический элемент
Fe
2. Строение атома
1.Положение в ПТХЭ
Химический
элемент
Простое вещество
3.Нахождение
в природе
1. Физические
свойства
4.Применение
3.Получение
2.Химические свойства
Слайд 3 Древние изделия из железа.
Самые древние изделия из железа, найденные
при раскопках, имеют возраст около 6 000 лет. И ,
кто бы знал, что именно железом платили дань некоторые плененные народы! И что вплоть до 14 века из железа делались украшения, и ценились они не ниже золотых!
Слайд 4 Железо
Fe (лат. ferrum, от греко-лат
fars. – быть твердым).
В древнем Египте Fe называли
«бе – нипет»- упавший с неба; древнегреческое sideros – звезда, небесное телоИнтересно, что метеориты бывают практически целиком железные (это каждый 16-тый падающий на Землю метеорит). Они состоят более чем на 90% из железа.
Слайд 5 А знаете ли Вы, что такое «лунное»
железо?
Да-да, это железо, которое было обнаружено
в доставленном на Землю образце лунного грунта! Лунная пыль, а в ней распыленное железо! Да, еще какое!
«Лунное» железо.
Это металлическое железо совсем не окисляется на воздухе! Ученые предполагают, что «виноват» в этом солнечный ветер, воздействующий на незащищенную атмосферой поверхность Луны. Бомбардировка поверхности Луны ионами и протонами солнечного ветра значительно повышает коррозионную устойчивость железа.
Слайд 6Самый крупный железный метеорит, получивший название «Гоба», был найден в
Африке и весил 60 тонн. Метеоритное железо очень прочное и
трудно поддается ковке.Однако, в истории все-таки известны образцы оружия, выкованные из метеоритного железа, таковы, например, шпаги Боливара и русского царя Александра I.
Метеоритное железо
Слайд 7Железо не только основа всего мира, самый главный металл окружающей
нас природы,
оно – основа культуры и промышленности, оно –
орудие войны и мирного труда.И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества.
А. Е. Ферсман.
А.Е Ферсман
Слайд 8В бою железо дороже золота
Более 90% всех металлов, которые использовались
в Великой Отечественной Войне, приходиться на железо.
Колоссальная масса железа
истрачена на земном шаре в ходе войн. За первую мировую войну было израсходовано не менее 200 млн. тонн стали. За Вторую Мировую - примерно 800 млн. тонн. Слайд 9 Где кровь, там и железо
За последние
три года войны
было произведено
660 тыс. орудий,
1 млн. 350 тыс.
ручных и
станковых пулеметов,
около 6 млн.
автоматов.
Слайд 10Железо – орудие войны
Чтобы судить о масштабах расхода железа
в минувшей войне, назовем одну цифру –
миллион бомб сброшено фашистской авиацией
на Сталинград!
Слайд 12Железо – орудие мирного труда
Всего несколько железных изделий было найдено
в гробнице фараона Тутанхомона, среди них железный амулет бога Гора,
небольшой кинжальчик с железным клинком и золотой рукояткой, маленькая железная скамеечка “Урс”.Слайд 13В 1813 году во время войны с Наполеоном прусская принцесса
Мариана придумала способ пополнения казны. Немецким женщинам предложили обменивать золотые
украшения на аналогичные ювелирные предметы из железа, на которых был надпись «Gold gab ich für Eisen» («Золотом отдам я за Железо»). Ношение таких украшений быстро вошло в моду и подчёркивало патриотизм обладательницы. Похожая идея способствовала созданию в том же 1813 году одной из самых знаменитых немецких наград, орден Железного креста. В отличие от других существующих медалей, Железный крест из драгоценного имел только скромную серебряную оправу.Слайд 14 Кутубская колонна
В Индии недалеко от города Дели под
открытым небом стоит огромная железная колонна высотой более 7 метров,
весом 6,5 тонн, изготовленная практически из чистого железа (99,7%), которая, несмотря на свой многовековой возраст (установлена в 5 веке н.э.), не ржавеет!
Любопытно: когда ученые из Англии взяли кусочки железа Кутубской колонны на анализ, образцы по приезду в Лондон,
проржавели…
Слайд 15Кровавый водопад
В Антарктиде из ледника Тейлора временами выходит Кровавый водопад.
Вода в нём содержит двухвалентное железо, которое, соединяясь с атмосферным
воздухом, окисляется и образует ржавчину. Это и придаёт водопаду кроваво-рыжий цвет. Двухвалентное железо в воде производят бактерии, живущие в глубоко подо льдом. Они перерабатывают остатки органики, а «дышат» трёхвалентным железом из окружающих пород.Слайд 16Химический элемент железо
Задание 1: опишите положение железа в периодической
системе по плану:
а) порядковый номер, Аr;
б) номер периода;
в) номер группы, подгруппа.
Вспомните: каков физический смысл порядкового
номера элемента, номера периода?
Задание 2: охарактеризуйте строение атома железа:
а) заряд ядра атома;
б) общее число электронов в атоме;
в) число энергетических уровней в атоме
Слайд 17 Положение Fe в ПТХЭ
Задание (взаимоконтроль)
1.Составить
электронную формулу атома железа.2. Составить графическую формулу атома железа.
Запомни!
Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.
Вставьте пропущенные слова:
Химический элемент Fe в периодической таблице расположен в
4
большом
периоде,
в 8
группе,
4
нечетном
ряду,
побочной
подгруппе. Ar (Fe) = 56
Порядковый номер
26,
следовательно
заряд ядра +26
число электронов
Находится в
4
периоде, следовательно
4
энергетических уровней.
Число протонов
26,
26,
число нейтронов
30.
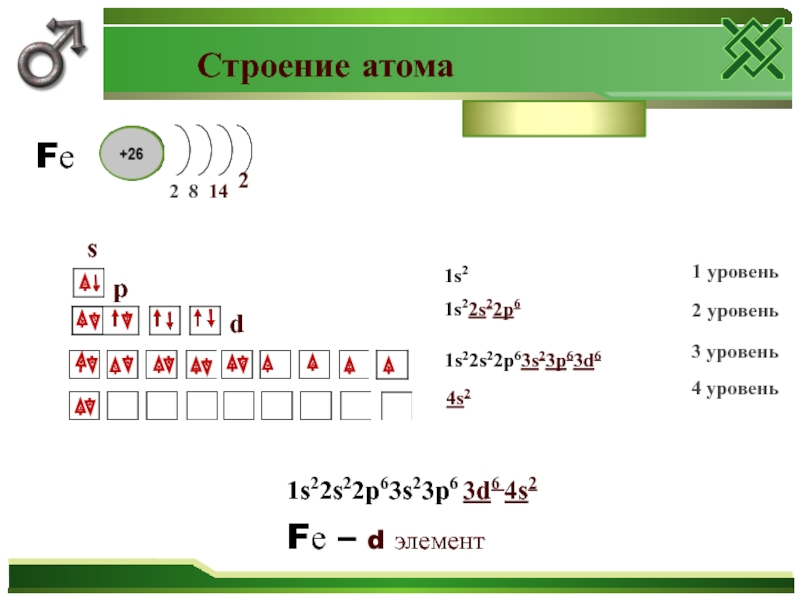
Слайд 18 Строение атома
Fе
2
8
14
2
1 уровень
2 уровень
3 уровень 4 уровень
1s2
1s22s22p6
4s2
1s22s22p63s23p63d6
s
p
d
1s22s22p63s23p6 3d6 4s2
Fе – d элемент
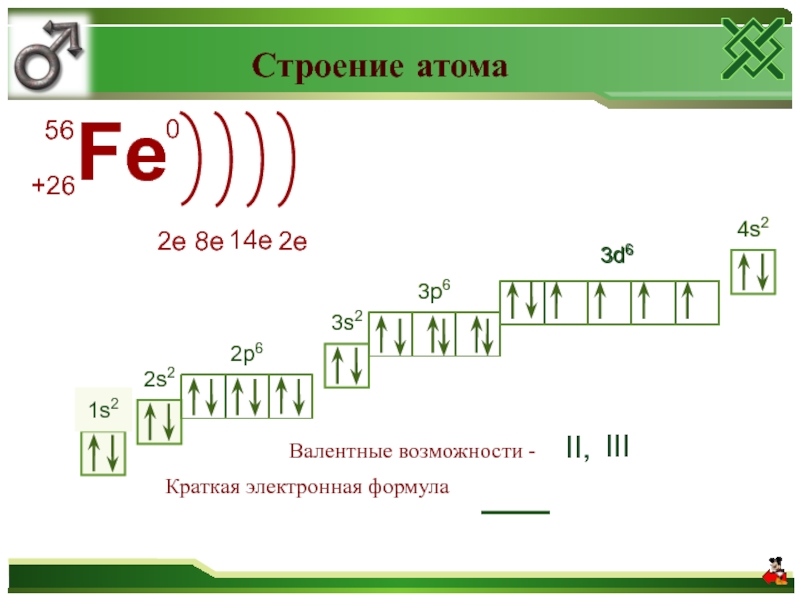
Слайд 19 Строение атома
1s2
2s2
2p6
3s2
3p6
1s2
2s2
2p6
3s2
Краткая электронная формула
Валентные возможности -
II,
III
4s2
Fe
+26
56
0
2e
8e
2e
14e
3p6
4s2
3d6
3d6
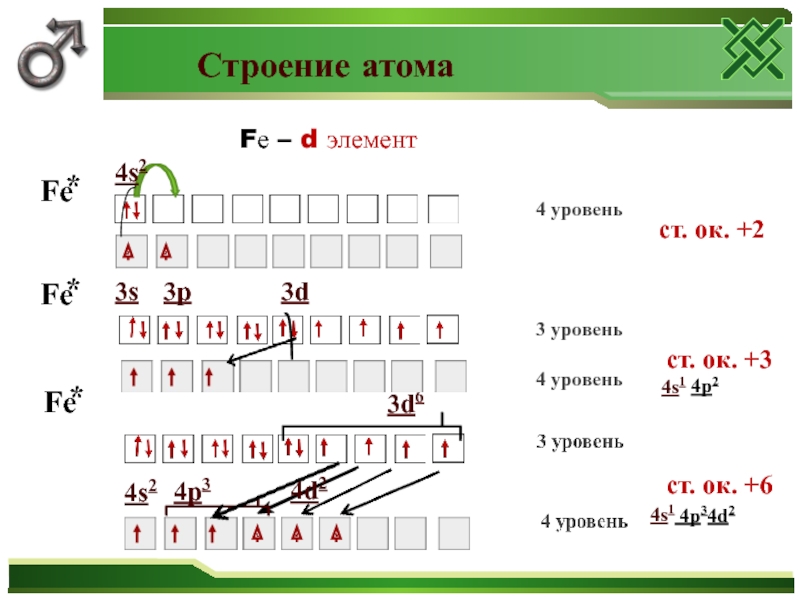
Слайд 20 Строение атома
ст. ок.
+2
4 уровень
3 уровень
4 уровень
4s2
ст. ок. +3
3d6
4s2
4p3
ст. ок. +6
Fe⃰
Fe⃰
Fe⃰
3s
3p
3d
Fе – d элемент4s1
4p2
4s1
4p34d2
4d2
Слайд 21 Строение атома
Задание
Сравнивая атомные радиусы элементов, определите, какой из элементов наиболее ярко
проявляет металлические свойства и почему?Радиус атома, нм Fe Na Mg Al
0.126 0,186 0,160 0,140
Слайд 23 Нахождение в природе
Fe3O4
Fe2O3
2Fe2O3. 3H2O
FeCO3
FeS2
Магнетит
( магнитный
железняк)
Пирит
(железный
колчедан)Гематит
(красный железняк)
Лимонит
(бурый железняк)
Сидерит
( железный шпат)
Fe – один из самых распространенных на земле элементов: на его долю приходится около 4,2% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). Это очень много: оно весит, ученые подсчитали 755 миллиардов тонн, но доступно человеку лишь малое его количество.
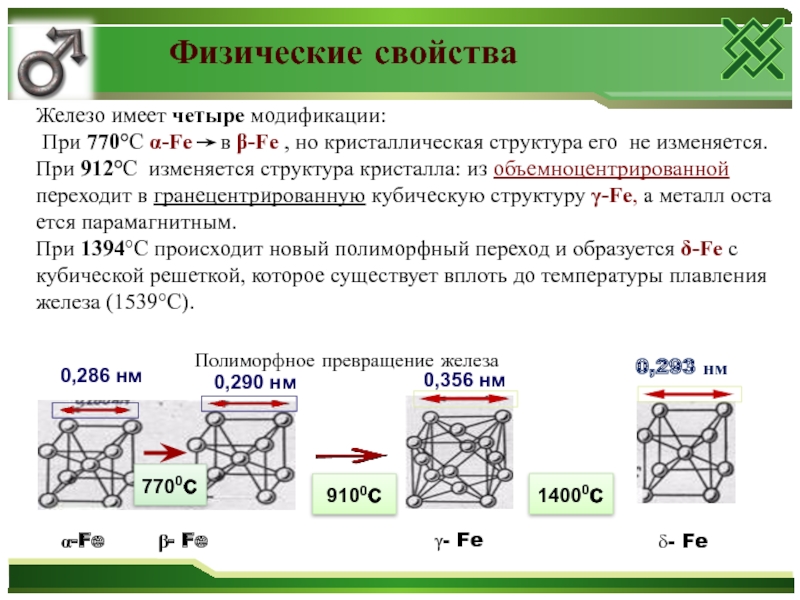
Слайд 25Физические свойства
Железо имеет четыре модификации:
При 770°С α-Fе
в β-Fе , но кристаллическая структура его не
изменяется. При 912°С изменяется структура кристалла: из объемноцентрированной переходит в гранецентрированную кубическую структуру γ-Fе, а металл остается парамагнитным.При 1394°С происходит новый полиморфный переход и образуется δ-Fе с кубической решеткой, которое существует вплоть до температуры плавления железа (1539°С).
Полиморфное превращение железа
γ- Fe
δ- Fe
0,286 нм
7700с
0,290 нм
9100с
0,356 нм
14000с
0,293 нм
Слайд 26 Химические свойства
Даны образцы соединений
железа: FeCl2, FeCL3 ,FeSO4, Fe3O4.
Гипотеза: если есть такие соединения железа,
то их можно получить химическим путём.
Предложите вещества, которые необходимо взять, для получения соединений железа. Для решения мысленного эксперимента воспользуйтесь опорной схемой:
Fe0 – 2e = Fe+2 + (кислоты: соляная, серная, соли, сера)
Fe0 – 3e = Fe+3 + (сильные окислители: хлор, азотная кислота конц.,
серная кислота конц.)
+?
? + ? ? + ?
+Cl2
+S
+CuSO4
+ HCl
Fe3O4
Слайд 27 Взаимодействие с простыми
веществами – с неметаллами
1. С
кислородом: в отсутствии влаги с сухим воздухом железо начинает заметно реагировать лишь при температуре выше 1500
3Fe + 2O2 Fe2O3
(FeO · Fe2O3)
железная окалина
Fe0 - 2℮ Fe+2
S0 - 2℮ S-2
2
восстановитель, окисление
Fe + S
FeS
окислитель, восстановление
2. С серой: железо реагирует при нагревании, образуя сульфид железа (ІІ)
1
1
Напишите уравнения происходящих реакций, в примере
укажите окислитель и восстановитель 2.расставьте коэффициенты методом электронного баланса
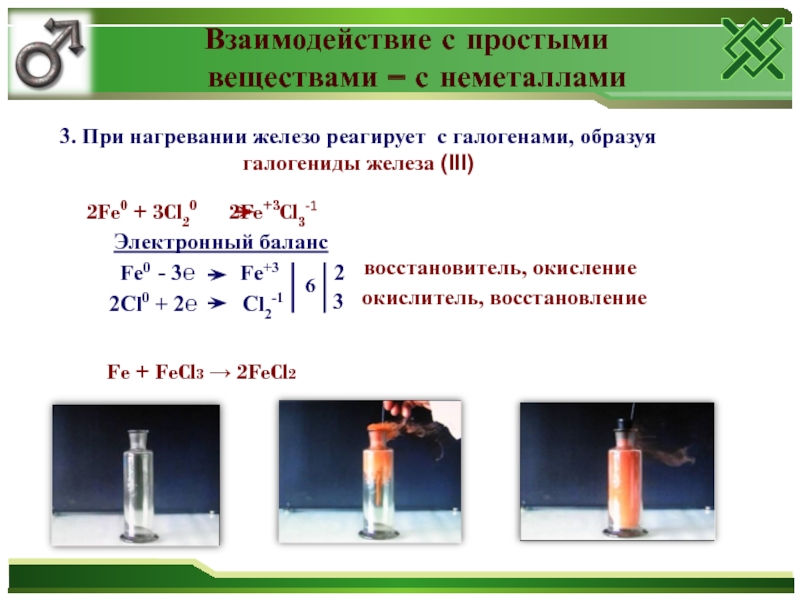
Слайд 28Взаимодействие с простыми
веществами – с неметаллами
3. При
нагревании железо реагирует с галогенами, образуя галогениды железа (ІІІ)
2Fe0 + 3Cl20 2Fe+3Cl3-1 Электронный баланс
Fe0 - 3℮ Fe+3
2Cl0 + 2℮ Cl2-1
6
2
3
восстановитель, окисление
окислитель, восстановление
Fe + FeCl3 → 2FeCl2
Слайд 29 Взаимодействие со сложными
веществами
1. С
холодной водой железо не взаимодействует, возможна лишь реакция раскаленного железа
с водяным паром. 3Fe + 4 H2O Fe3O4 + 4H2 (при t = 7000 - 9000)
2. При совместном действии кислорода и воды, достаточно интенсивно происходит процесс коррозии.
4Fe + 6H2O +3O2 4Fe(OH)3
Fe + H2O
9000C
FeO + H2
вакуум
Слайд 30 Химически чистое железо устойчиво к
коррозии и хорошо сопротивляется действию кислот. Однако ничтожные примеси лишают
его этих драгоценных свойств: на земном шаре ежегодно «болеет» ржавчиной такое количество железа, которое равняется его годовой добыче. На защиту от коррозии тратятся средства превышающие затраты на производство этого металла.Слайд 31
а) Железо растворяется в HCl и разбавленной H₂SO₄
кислота +
Fe → cоль Fe (II) + Н₂Задание 5:
1. Напишите молекулярное, полное и сокращенное ионное
уравнение реакций (а).
2. Расставьте коэффициенты методом электронного баланса (б)
а) Fe + HCl → …..
б) Fe + HNO₃ (разб.) → ….NO + Н₂O
в) В безводных азотной и серной кислотах железо не растворяется, так как на поверхности металла возникает пленка, препятствующая реакции металла с кислотой ( происходит пассивация металла)
б) При взаимодействии железа с разбавленной HNO₃ образуются
N2, NO, NH3, NH4NO3 в зависимости от концентрации кислоты.
Слайд 32 Проверьте себя:
1) Fe
+ 2 HCl → FeCl₂ + H2↑
Fe⁰
+ 2 H⁺ + 2 Cl¯ → Fe²⁺ + 2 Cl¯ + H⁰2↑Fe⁰ + 2 H⁺ → Fe²⁺ + H⁰2↑
Слайд 33 Взаимодействие со сложными
веществами
4. Находясь левее водорода в ряду напряжений, железо
вытесняет его из разбавленных кислот (кроме азотной): при этом образуются соли железа (ІІ)Fe + 2HCl FeCl2 + H2
H2SO4 + Fe = FeSO4 + H2
Fe0 + 4HNO3 Fe+3(NO3)3 +N+2O + 2H2O
Fe0 - 3℮ Fe+3
N+5 + 3℮ N+2
восстановитель, окисление
окислитель, восстановление
3
1
1
Слайд 34 Взаимодействие со сложными
веществами
С концентрированной азотной кислотой железо реагирует с образованием нитрата
железа (III), H2O, и NO2 (бурый газ)С концентрированной серной кислотой железо реагирует с образованием сульфата железа (III), H2O, и SO2 (сернистый газ)
Задание 6:
Составить уравнение реакции взаимодействия железа с конц. серной кислотой и расставьте коэффициенты методом электронного баланса
Слайд 35 Проверьте себя
Fe
+ H2SO4 (конц) Fe(SO4 )3 + SO2
+ H2OFe - 3℮ Fe восстановитель, окисление
S + 2℮ S окислитель, восстановление
0
+6
+3
+4
0
+3
+6
+4
6
2
3
Слайд 36 Взаимодействие со
сложными веществами
5. Железо вытесняет менее активные металлы
из водных растворових солей
Fe + CuSO4 FeSO4 + Cu
Вспомните общее правило взаимодействия
металлов с растворами солей.
Задание 6: напишите молекулярное, полное и сокращенное
ионное уравнение реакции
раствор CuSO4
Fe
Слайд 37 а) Fe + CuCl₂ → FeCl₂
+ Cu↓
Fe⁰ +
Cu²⁺ + 2 Cl⁻ → Fe²⁺ + 2 Cl⁻ + Cu⁰↓ Fe⁰ + Cu²⁺ → Fe²⁺ + Cu⁰↓
Проверьте себя:
Слайд 38
ПОЛУЧЕНИЕ
1) Основной промышленный способ переработки
железных руд- производство чугуна (сплав железа, содержащий 2,2–4% С, а также
Si, Mn, P, S). Процесс, протекающий в доменной печи, основан на
восстановлении оксидов железа при нагревании:
Fe2O3 + CO → Fe3O4 + CO2 , FeO + CO → Fe + CO2 Fe3O4 + CO → FeO + CO2 FeO + C → Fe + CO
Задание 7: расставьте коэффициенты в приведенных выше схемах реакций
2) Существует и прямой метод получения железа, основанный на
восстановлении окатышей магнитного железняка природным газом,
водородом или алюминием (алюмотермия)
Fe3 O4 + CH4 →3Fe + CO2 + 2H2O (t = 1 000°C)
Fe2O3 + 2Al = 2Fe + Al2O3
Fe3O4 + 4H2 = 3Fe + 4H2O
3) Очень чистое железо в виде порошка получают разложением карбонила Fe(CO)5. При температуре около 250° карбонил разлагается, образуя порошок железа: Fе(СО)5 = Fе + 5СО
Слайд 39 Проверьте себя:
1) 3 Fe2O3 + CO =
2 Fe3O4 + CO2 Fe3O4 + CO
= 3 FeO + CO2 FeO + CO = Fe + CO2 FeO + C = Fe + CO3) Fe2O3 + 3 СО = 2 Fe + 3 CO2
Fe2O3 + 3 H2 = 2 Fe + 3 H2O
Слайд 40Железо сегодня
Гидроэлектро-
станции и опоры
линий электропередач
Трубопроводы
для воды,
нефти и газа
Автомобили ,
Тракторы,
Подводные
лодки,
Бытовые приборы,
Другие предметы
Слайд 42
Fe
В организме здорового человека содержится приблизительно 4-5 граммов
железа.
Из них 57% приходится на гемоглобин крови, 7% -
на миоглобин мышц,16% связаны с тканевыми ферментами,
20% - это запас, отложенный в печени, селезенке, костном мозге и почках.
Биологическая роль железа
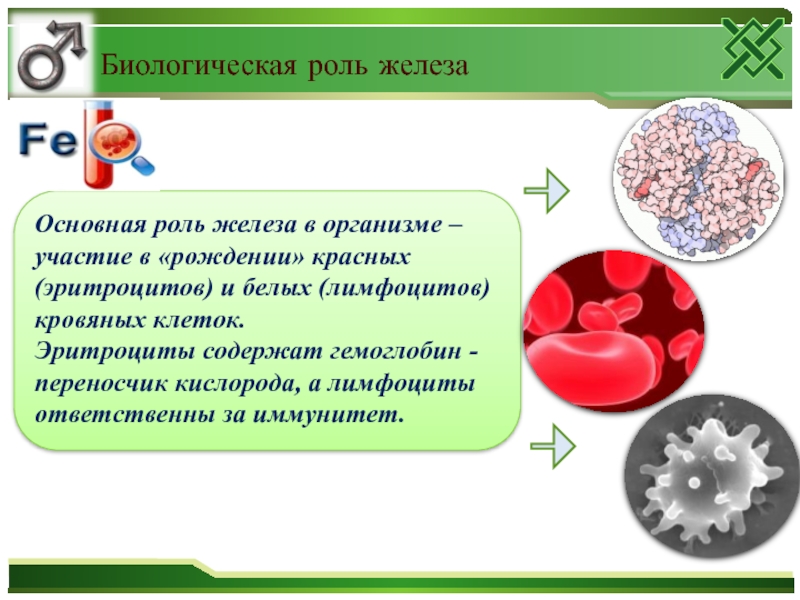
Слайд 43Основная роль железа в организме – участие в «рождении» красных
(эритроцитов) и белых (лимфоцитов) кровяных клеток.
Эритроциты содержат гемоглобин -
переносчик кислорода, а лимфоциты ответственны за иммунитет. Биологическая роль железа
Слайд 45Недостаток железа в организме
В случае недостаток железа в организме
наблюдаются следующие симптомы:
Слайд 47«Ржавое железо не блестит»
(никчемность и бездеятельность человека портит!!!)
Очень часто
употребляемая пословица:
«Куй железо, пока горячо» (делай все вовремя!!!, не
пропусти момент!!!)«Без разума сила все равно, что железо гнило»
(главное в человеке - разумные и осмысленные поступки!!!)
В народном фольклоре метких изречений о важности и значении железа в человеческом обиходе встречается много
Слайд 48Заключение
«Железные рудокопи доставляют человеку превосходнейшее и зловреднейшее
орудие. Ибо сим орудием прорезываем мы землю, обрабатываем плодовитые сады
и, обрезая дикие лозы с виноградом, понуждаем их каждый год юнеть. Сим орудием выстраиваем домы, разбиваем камни и употребляем железо на все подобные надобности. Но тем же железом производим брани, битвы и грабежи и употребляем оное не только вблизи, но мещем окрыленное вдаль то из бойниц, то из мощных рук, то в виде оперенных стрел. Ибо, чтобы смерть скорее постигла человека, сделали ее крылатою и железу придали перья. Того ради да будет вина приписана человеку, а не природе»(Плиний Старший)
Слайд 49отрывок из «Поэмы о периодическом
законе» В.Половняк
Железо - труженик, строитель,
Станки, заводы, корабли
Ведь от иголки
до машины
Все из железа состоит.
Железо в почве, в селезенке,
В любом растении, в крови...
В составе всех эритроцитов
Чудеснейший гемоглобин!
Таинственны земные недра,
Но физики убеждены:
Почти из чистого железа
Ядро земное состоит.
И верим мы, что век железа
Не станет веком роковым,
И дело мира неизбежно
Мрак на планете победитГромоподобные раскаты
И в небе раскаленный след:
На землю огненный камень падал
И ужасался человек.
Но редким был подарок с неба
Им лишь счастливец обладал:
Топор был выкован железный,
Сверкает лезвием кинжал.
Вот длинный ряд тысячелетий
Проходит в поисках, в борьбе,
И наступает век железный
Кровавый беспокойный век.
Он начинался резким звоном
Жестоко скрещенных мечей
Потоком многомиллионным
Обрушил бомбы на людей.