Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы 9 класс
Содержание
- 1. Щелочные металлы 9 класс
- 2. Щелочные металлы — элементы главной подгруппы I
- 3. Общая характеристика щелочных металловВ Периодической системе они
- 4. Слайд 4
- 5. Слайд 5
- 6. Химические свойства щелочных металлов1. Взаимодействие с водой.
- 7. 2. Взаимодействие с кислородом. Продукты горения щелочных
- 8. 3. Взаимодействие с другими веществами. Щелочные металлы
- 9. При нагревании щелочные металлы способны реагировать с
- 10. При растворении в жидком аммиаке щелочной металл
- 11. Скачать презентанцию
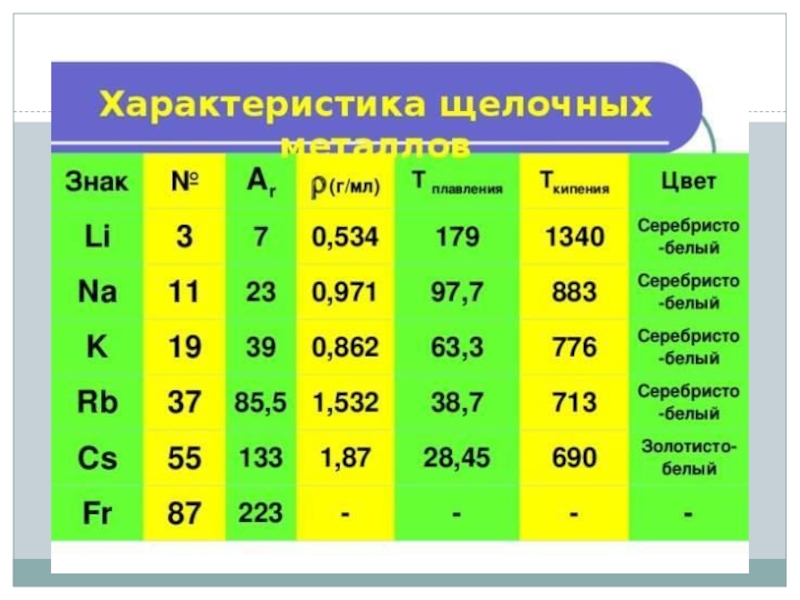
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили
Слайды и текст этой презентации
Слайд 3Общая характеристика щелочных металлов
В Периодической системе они следуют сразу за
инертными газами, поэтому особенность строения атомов щелочных металлов заключается в
том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).Слайд 6Химические свойства щелочных металлов
1. Взаимодействие с водой. Важное свойство щелочных
металлов — их высокая активность по отношению к воде. Наиболее
спокойно (без взрыва) реагирует с водой литийПри проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
Слайд 72. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе
имеют разный состав в зависимости от активности металла. Только литий
сгорает на воздухе с образованием оксида стехиометрического состава:При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды: