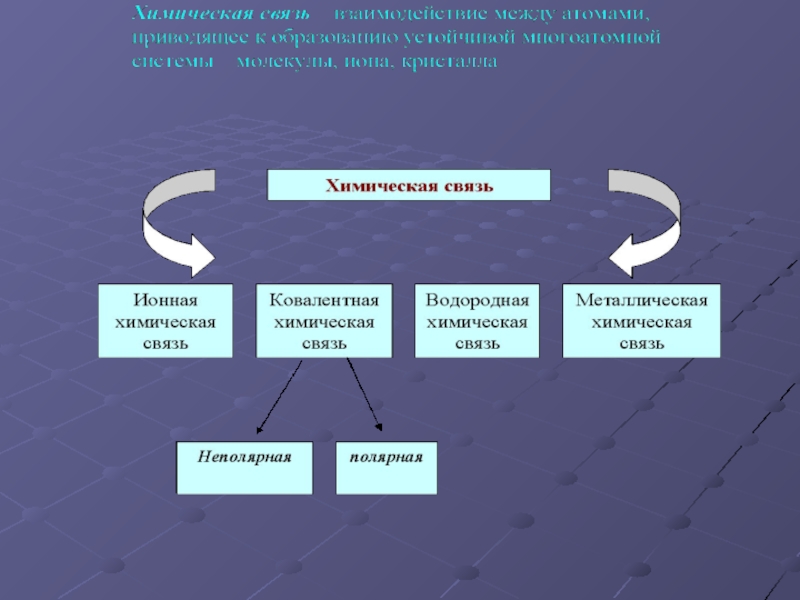
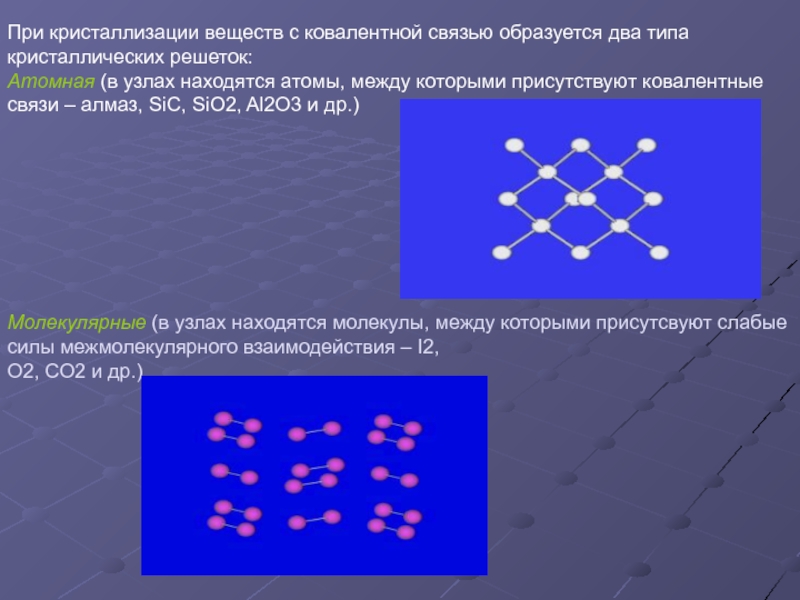
имеющими большую разность электроотрицательности (более 2);
Образуется между атомами наиболее активных
металлов и неметаллов;При образовании ионной связи атом металла отдает свои электроны атому неметалла, при этом каждый из атомов получает завершенный энергетический уровень. +
ПРИМЕР: Li _ 1 е Li катион
2 1 2
_
F + 1 е F анион
2 7 2 8
+3
+3
+3
+9
+9