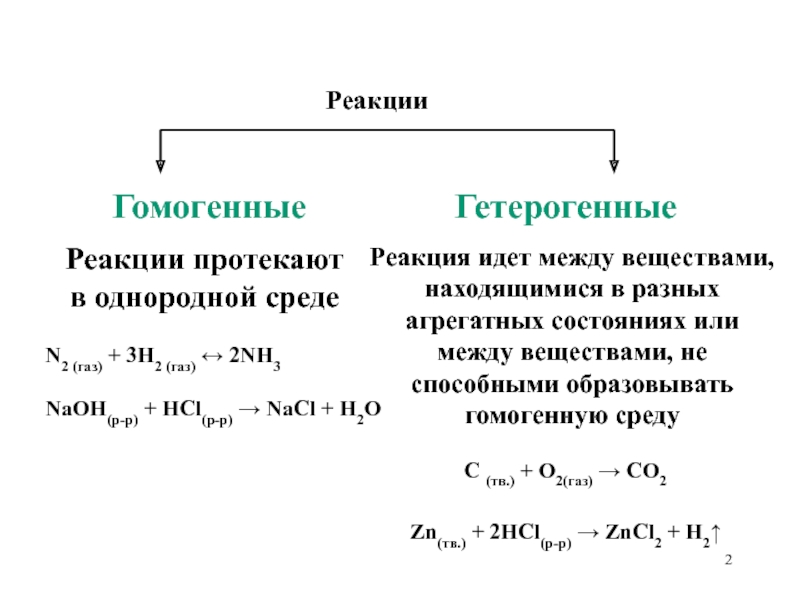
в однородной среде
N2 (газ) +
3H2 (газ) ↔ 2NH3NaOH(р-р) + HCl(р-р) → NaCl + H2O
Гетерогенные
Реакция идет между веществами,
находящимися в разных
агрегатных состояниях или
между веществами, не
способными образовывать
гомогенную среду
C (тв.) + O2(газ) → CO2
Zn(тв.) + 2HCl(р-р) → ZnCl2 + H2↑