Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы и окружающая среда
Содержание
- 1. Растворы и окружающая среда
- 2. Растворы — физико-химические системы, состоящие из растворителя,
- 3. Физическая теорияРастворы – однородные смеси, состоящие из
- 4. Химическая теорияВ 1887 году доказал, что растворение
- 5. РастворыКоэффициент растворимости показывает сколько граммов вещества может
- 6. Насыщенный раствор — раствор, в котором растворённое вещество
- 7. Ненасыщенный раствор — раствор, в котором при данных условиях можно растворить еще некоторое количество растворенного вещества.
- 8. Ненасыщенный раствор — раствор, в котором при данных условиях можно растворить еще некоторое количество растворенного вещества.
- 9. Пересыщенный раствор — раствор, содержащий при данных
- 10. Дисперсные системы — это такие системы, в
- 11. Важнейшей характеристикой дисперсных систем является степень дисперсности, т.е. средний размер частиц дисперсной фазы.
- 12. По степени дисперсности дисперсные системы делятся на:а) грубодисперсные
- 13. От степени дисперсности зависят свойства дисперсных систем,
- 14. Слайд 14
- 15. Коллоидные растворы — это высокодисперсные двухфазные системы,
- 16. Коллоидные раствору иначе называют золями.Золи обладают рядом
- 17. Например, золи золота могут быть синими, фиолетовыми, вишневыми, рубиново-красными.
- 18. В отличие от истинных растворов для золей
- 19. Слайд 19
- 20. Основываясь на различной величине частиц коллоидных и
- 21. Коллоидные частицы называются мицеллами.Строение мицеллы рассмотрим на
- 22. Нерастворимые молекулы йодида серебра образуют ядро коллоидной
- 23. Полученное ядро адсорбирует на своей поверхности те
- 24. В растворе находятся также и ионы, противоположные
- 25. Оставшаяся часть противоионов образует диффузный слой ионов.
- 26. При добавлении к золям электролитов происходит уменьшение
- 27. Обычно коагуляцию проводят прибавлением к золю: 1)
- 28. Чаще всего золи коагулируют прибавлением электролита. В
- 29. Истинные растворы.Истинные растворы, чаще называемые «растворами» в
- 30. Растворы — гомогенные (однородные) системы переменного состава,
- 31. Классификация растворов.1. По агрегатному состоянию растворы делятся на:
- 32. 4. По максимальному содержанию вещества в растворе,
- 33. Коэффициент растворимости, или растворимость, показывает, какая максимальная
- 34. Слайд 34
- 35. Благодарю за внимание!
- 36. Скачать презентанцию
Растворы — физико-химические системы, состоящие из растворителя, растворенного вещества и продуктов химического взаимодействия растворителя и растворенного вещества.
Слайды и текст этой презентации
Слайд 2
Растворы — физико-химические системы, состоящие из растворителя, растворенного вещества и
продуктов химического взаимодействия растворителя и растворенного вещества.
Слайд 3Физическая теория
Растворы – однородные смеси, состоящие из двух или более
веществ.
Растворение – это диффузия.
Якоб Хендрик Вант-Гофф
Сванте Аррениус
Вильгельм Оствальд
Слайд 4Химическая теория
В 1887 году доказал, что растворение является результатом химического
взаимодействия растворенного вещества с молекулами воды
В 1906 году предсказал, что
обе точки зрения приведут к общей теории растворовСлайд 5Растворы
Коэффициент растворимости показывает сколько граммов вещества может растворяться в 100
г растворителя. В соответствии с этим растворы могут быть:
насыщенными
ненасыщенными
пересыщенными
Слайд 6Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях
больше не растворяется. Осадок данного вещества находится в равновесном состоянии
с веществом в растворе.Слайд 7Ненасыщенный раствор — раствор, в котором при данных условиях можно
растворить еще некоторое количество растворенного вещества.
Слайд 8Ненасыщенный раствор — раствор, в котором при данных условиях можно
растворить еще некоторое количество растворенного вещества.
Слайд 9Пересыщенный раствор — раствор, содержащий при данных условиях больше растворённого
вещества, чем в насыщенном растворе, избыток вещества легко выпадает в
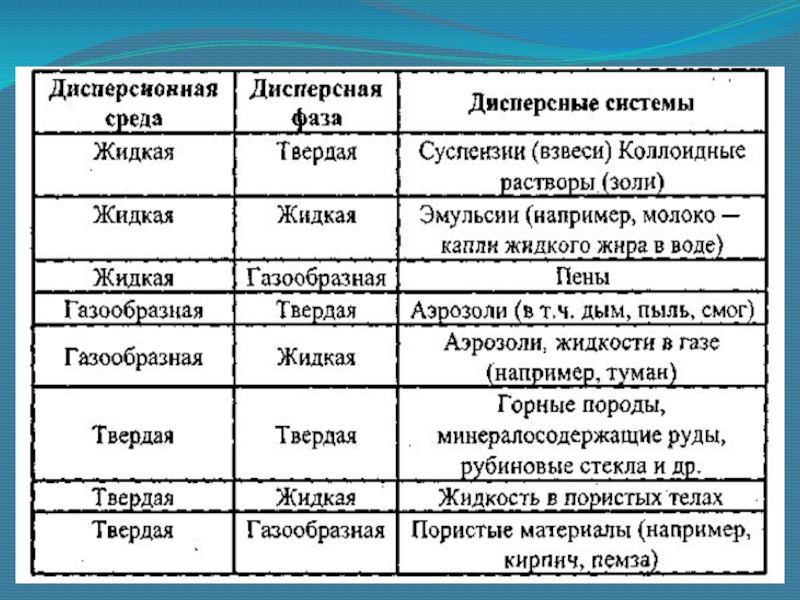
осадок. Обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре.Слайд 10Дисперсные системы — это такие системы, в которых одно вещество
равномерно распределено в виде частиц в другом веществе.
В таких
системах различают дисперсионную среду и дисперсную фазу (раздробленное в дисперсионной среде вещество).Слайд 11Важнейшей характеристикой дисперсных систем является степень дисперсности, т.е. средний размер
частиц дисперсной фазы.
Слайд 12По степени дисперсности дисперсные системы делятся на:
а) грубодисперсные (средний диаметр частиц
более 100 нм);
б) тонко (высоко) дисперсные, или коллоидные системы (диаметр частиц
от 1 до 100 нм);в) истинные растворы (диаметр частиц менее 1нм).
Слайд 13От степени дисперсности зависят свойства дисперсных систем, в частности, их
устойчивость.
Грубодисперсные системы являются неустойчивыми и со временем разделяются на
дисперсную фазу и дисперсионную среду. Коллоидные системы значительно более устойчивы.
В зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы выделяют следующие основные виды дисперсных систем:
Слайд 15Коллоидные растворы — это высокодисперсные двухфазные системы, состоящие из дисперсионной
среды и дисперсной фазы размер частиц последней от 1 до
100 нм.Коллоидные растворы по размерам частиц являются промежуточными между истинными растворами и суспензиями и эмульсиями. Коллоидные частицы обычно состоят из большого числа молекул или ионов.
Слайд 16Коллоидные раствору иначе называют золями.
Золи обладают рядом специфических свойств, которые
подробно изучает коллоидная химия.
Так, золи в зависимости от размеров
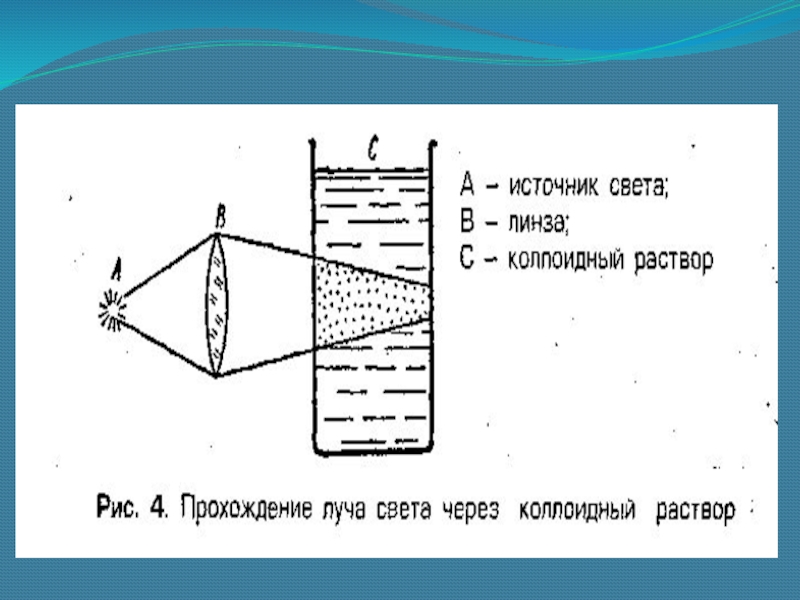
частиц могут иметь различную окраску, а у истинных растворов она одинаковая. Слайд 18В отличие от истинных растворов для золей характерен эффект Тиндаля,
т. е. рассеяние света мелкими частицами.
При пропускании через золь
пучка света появляется светлый конус, видимый в затемненном помещении. Так можно распознать является данный раствор коллоидным или истинным.
Слайд 20Основываясь на различной величине частиц коллоидных и истинных растворов, можно
разделить их смесь.
Для этого подбирают пористую перепонку (пергаментную бумагу,
животный пузырь и др.) с такими мелкими порами, через которые коллоидные частицы пройти не могут, а проходят только молекулы и ионы. Такой способ освобождения золя от частиц истинного раствора называется диализом, а прибор — диализатором.
Слайд 21Коллоидные частицы называются мицеллами.
Строение мицеллы рассмотрим на примере образования коллоидного
раствора йодида серебра, получаемого при взаимодействии очень разбавленных растворов нитрата
серебра и йодида калия:Слайд 22Нерастворимые молекулы йодида серебра образуют ядро коллоидной частицы. Вещество ядра,
имеющее кристаллическую или аморфную структуру, нерастворимо в дисперсионной среде и
состоит из нескольких тысяч нейтральных молекул или атомов. В рассматриваемом примере ядро — микрокристаллик йодида серебра, состоящий из большого числа m молекул Agl:Слайд 23Полученное ядро адсорбирует на своей поверхности те или иные ионы,
имеющиеся в растворе. Обычно адсорбируются те ионы, которые входят в
состав ядра,т. е. в данном случае ионы серебра или ионы йода.
Если коллоидный раствор получают при избытке йодида калия, то адсорбируются ионы йода.
Они достраивают кристаллическую решетку ядра, прочно входят в его структуру, образуя адсорбционной слой, и придают ядру отрицательный заряд:
m[AgI]nI-.
Ионы, адсорбирующиеся на поверхности ядра и придающие ему соответствующий заряд, называются потенциал определяющими ионами.
Слайд 24В растворе находятся также и ионы, противоположные по знаку потенциалопределяющим
ионам, их называют противоионами.
В нашем примере противоионами являются катионы
К+, которые электростатически притягиваются потенциалопределяющими ионами адсорбционного слоя. Часть противоионов К+ входит в адсорбционный слой. Ядро с адсорбционным слоем называется гранулой:
Слайд 25Оставшаяся часть противоионов образует диффузный слой ионов.
Ядро с адсорбционным
и диффузным слоями и представляет собой мицеллу:
Наличие одноименного заряда у
всех гранул данного коллоидного раствора (золя) является важным фактором его устойчивости. Заряд препятствует слипанию и укрупнению коллоидных частиц.Слайд 26При добавлении к золям электролитов происходит уменьшение зарядов гранул, что
приводит к слипанию частиц.
Соединение коллоидных частиц в более крупные
агрегаты называется коагуляцией.В результате коагуляции частицы могут или выпасть в осадок под влиянием силы тяжести (этот процесс называется седиментацией), или образовать полутвердую упругую массу (гель, или студень).
Слайд 27Обычно коагуляцию проводят прибавлением к золю:
1) электролита;
2) другого золя,
частицы которого имеют противоположный заряд;
3) нагреванием.
Слайд 28Чаще всего золи коагулируют прибавлением электролита. В этом случае заряды
коллоидных частиц нейтрализуются ионами электролита.
Причем золи, содержащие положительно заряженные
частицы, коагулируют под действием анионов, а золи, содержащие отрицательно заряженные частицы,— под действием катионов.Слайд 29Истинные растворы.
Истинные растворы, чаще называемые «растворами» в природе имеют огромное
значение.
Растения усваивают вещества в виде растворов. Усвоение пищи связано
с переводом питательных веществ в раствор.Все природные воды тоже растворы.
В растворах величина частиц раcтворенного вещества не превышает 1нм. Это соответствует размерам атомов, ионов, молекул. Поэтому растворы представляют собой однородные системы.
Слайд 30Растворы — гомогенные (однородные) системы переменного состава, содержащие два или
несколько компонентов.
Для приготовления любого раствора необходимы растворитель и растворяемое вещество,
которые называются компонентами раствора.Растворитель - это компонент, который преобладает в растворе и находится в том же агрегатном состоянии, что и раствор.
Растворенное вещество — это вещество, молекулы которого равномерно распределены между молекулами растворителя.
Слайд 31Классификация растворов.
1. По агрегатному состоянию растворы делятся на: жидкие (например, раствор
сахара в воде);
и газообразные (например, воздух); твердые (например, сплавы металлов).
2. По
типу растворителя жидкие растворы делятся на: вводные (растворитель-вода); неводные (растворитель — спирт, бензол, эфир, ацетон и т.д.).3. По количеству растворенного вещества растворы делятся на:
Концентрированные ( растворы содержат такое количество растворенного вещества, которое сравнимо с количеством растворителя).
Разбавленные (растворы содержат очень малое количество растворенного вещества по сравнению с количеством растворителя).
Слайд 324. По максимальному содержанию вещества в растворе, последние бывают:
насыщенные (растворы,
в которых не может более растворяться данное вещество при данной
температуре);ненасыщенные (растворы, в которых при данной температуре еще может раствориться данное вещество).
Количественной характеристикой растворимости является коэффициент растворимости.
Слайд 33Коэффициент растворимости, или растворимость, показывает, какая максимальная масса вещества может
раствориться в одном литре растворителя при данной температуре с образованием
насыщенного раствора. Растворимость выражают в граммах на литр (г/л).Концентрация — это величина, характеризующая относительное содержание данного компонента в смеси или растворе.