Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соединения железа 9 класс
Содержание
- 1. Соединения железа 9 класс
- 2. 1) Железо находится в: а) IV периоде,
- 3. Топор из метеоритаНе так давно в Моравском
- 4. ЗадачаМасса топора 6 килограммов.Топор изготовлен из природнолегированного
- 5. Решение: 1) m (Ni) = 0,028 *
- 6. По распространенности в земной коре железо занимает
- 7. ТЕМА: Соединения железа +2, +3 .
- 8. Соединения железа в природе.Минералы – магнитный железняк
- 9. Соединения железа ( II) и (III).Какую степень
- 10. Соли железа.Железный купоросFeSO4 *7H2 OХлорид железа (III)FeCl3Сульфат железа (III)Fe2 ( SO4) 3
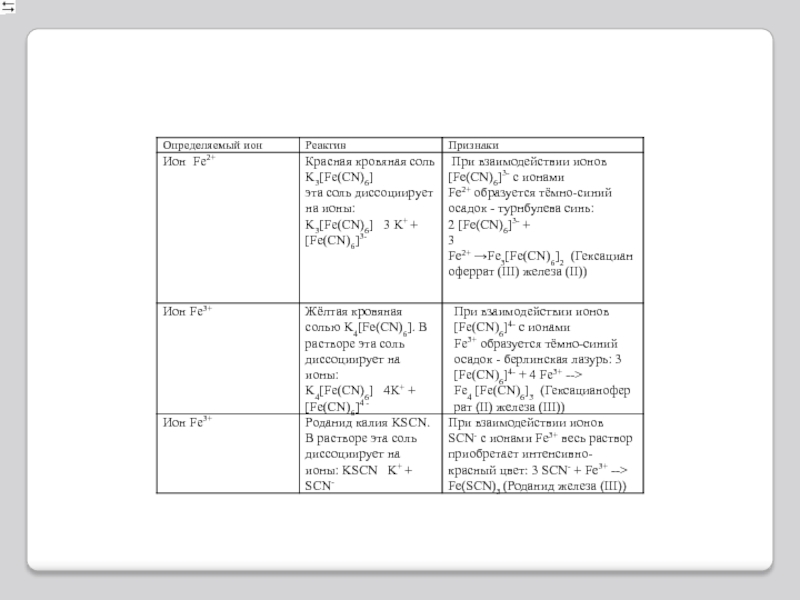
- 11. Качественные реакции.Для обнаружения ионов железа(III) удобно
- 12. Качественная реакция на ионы Fe2+ и Fe3+
- 13. Качественнная реакция на ион Fe3+
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Скачать презентанцию
1) Железо находится в: а) IV периоде, 8А группе; б) IIIпериоде, 7Б группе; в) IV периоде, 8Б группе. 2) Атом железа имеет строение ВЭУ: а) 4s24p6 б) 3d64s2 в) 3d44s24p2 3)
Слайды и текст этой презентации
Слайд 21) Железо находится в: а) IV периоде, 8А группе; б) IIIпериоде,
7Б группе; в) IV периоде, 8Б группе. 2) Атом железа имеет
строение ВЭУ: а) 4s24p6 б) 3d64s2 в) 3d44s24p2 3) Железо проявляет степени окисления: а) +2, +3 б) +2, +3, +8 в) +3, +4 4) Сгорая в кислороде, железо образует оксид со степенью окисления: а) +2 б) + 3 в) +2, +3 5) Железо реагирует с раствором соли: а) CuCl2 б) ZnCl2 в) AlCl3 6) Для получения хлоридов железа (+2) и (+3) нужно взять соответственно: а) Cl2 и р-р HCl б) р-р CuSO4 и р-р HCl в) р-р HCl и Cl2Слайд 3Топор из метеорита
Не так давно в Моравском музее города Брно
(Чехия) появился новый экспонат — небольшой топор, найденный археологами при
раскопках древнего поселения Мстенице, относящегося к раннему средневековью. Уже почти два десятилетия ученые ведут здесь работы, в результате которых обнаружено около 40 тысяч различных предметов старины, в том числе и немало топоров. Однако топор, пополнивший теперь коллекцию музея, оказался не простым, а… Нет, не золотым, как сказочное яичко, а железным, как и подобает настоящему топору, но все дело в том, что железо, из которого древний кузнец отковал свой топор, было… метеоритным.К этому выводу пришли специалисты после того, как находку подвергли металлографическому анализу. Оказалось, что в отличие от других железных изделий, найденных при раскопках, описываемый топор изготовлен из "природнолегированного" железа, содержащего 2,8 % никеля и 0,6 % кобальта. Такой состав свидетельствует о небесном происхождении материала, которым воспользовался средневековый мастер из Мстенице.
Слайд 4Задача
Масса топора 6 килограммов.
Топор изготовлен из природнолегированного железа, содержащего 2,8
% никеля, 0,6 % кобальта.
Сколько килограммов железа в этом
топоре?Слайд 5Решение: 1) m (Ni) = 0,028 * 6 = 0,168 кг 2)
m (Со) = 0,006 * 6 = 0,036 кг 3) m
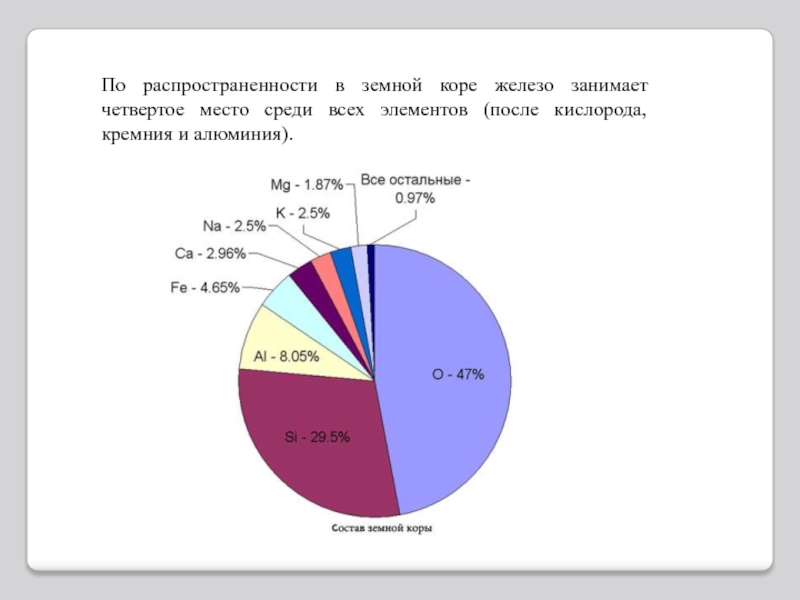
(Fe) = 6 - (0,168 + 0,036) = 6 - 0,204 = 5,796 кг. Ответ: Железа в топоре 5,796 кг.Слайд 6По распространенности в земной коре железо занимает четвертое место среди
всех элементов (после кислорода, кремния и алюминия).
Слайд 7 ТЕМА: Соединения железа +2, +3 . Тип урока: урок изучения и
первичного закрепления новых знаний, и способов деятельности. Форма урока: урок-исследование. Цели урока:
организовать деятельность учащихся по восприятию, осмыслению и первичному запоминанию новых знаний о свойствах переходных металлов на примере железа и его соединений. Задачи:воспитательные - формировать коммуникабельность, чувство взаимоуважения, умение рационально организовывать свой труд, вырабатывать правильную самооценку;
развивающие – продолжить формирование умения анализировать, сравнивать, обобщать, выстраивать логические цепочки; осуществлять межпредметные связи биология – химия; учебные – повторить строение атома, химические и физические свойства железа – простого вещества, рассмотреть руды железа, охарактеризовать соединения железа (+2, +3).
Слайд 8Соединения железа в природе.
Минералы – магнитный железняк (магнетит) Fe3O4,
красный железняк
(гематит) Fe2O3,
бурый железняк (лимонит) 2Fe2O3*3H2O.
Все они используются в черной
металлургии для производства чугуна и стали.Природное соединение – железный, или серный, колчедан (пирит) FeS2 применяется для производства серной кислоты.
Слайд 9Соединения железа ( II) и (III).
Какую степень окисления может проявлять
железо в соединениях?
Оксид железа ( II) FeO, и соответствующий ему
гидроксид железа ( II) Fe(OH)2 получают косвенно, по следующей цепочке превращений:Fe +HCL→ FeCL2 +KOH→ Fe(OH)2 t→ FeO
Оксид железа (III) Fe2O3 соответствующий ему гидроксид железа (III).
Fe(OH)3 получают косвенно, по следующей цепочке превращений:
Fe +CL2→ FeCL3 +KOH→ Fe(OH)3 t→ Fe2 O3
Слайд 10Соли железа.
Железный купорос
FeSO4 *7H2 O
Хлорид железа (III)
FeCl3
Сульфат железа (III)
Fe2 (
SO4) 3
Слайд 11
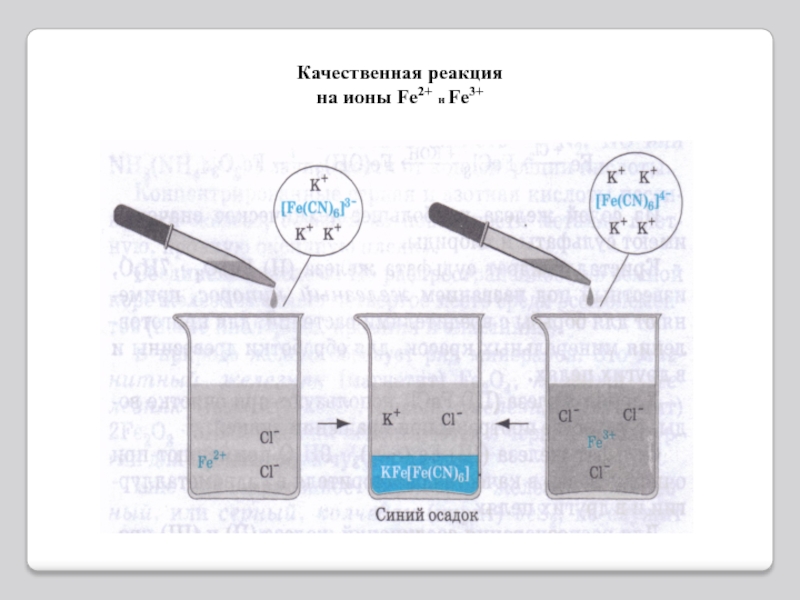
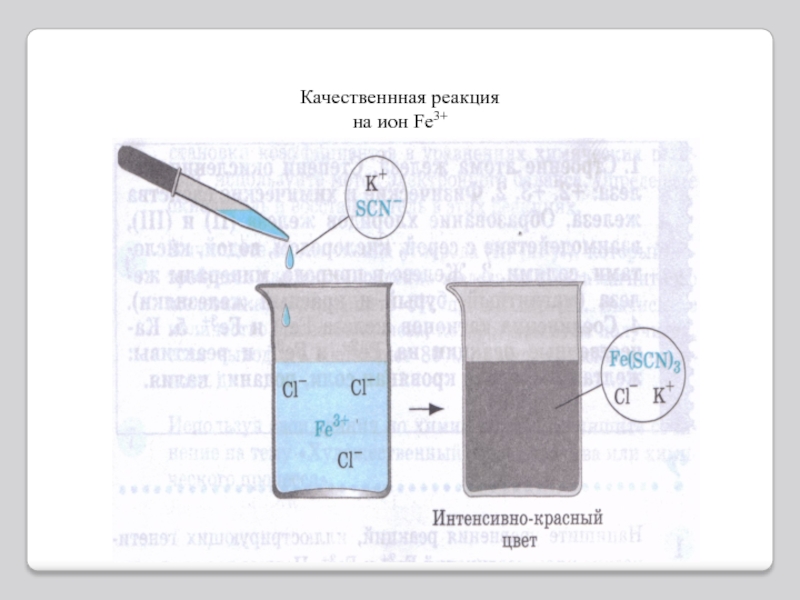
Качественные реакции.
Для обнаружения ионов железа(III) удобно применять комплексное соединение
железа, называемое желтой кровяной солью или гексацианоферратом(II) калия K4[Fe(CN)6]. При
взаимодействии ионов (Fe(CN)6)4– с ионами Fe3+ образуется темно-синий осадок – берлинская лазурь:Другое соединение железа – красная кровяная соль или гексацианоферрат(III) калия K3[Fe(CN)6] является реактивом на ионы Fe2+.
При взаимодействии ионов (Fe(CN)6)3– с ионами Fe2+ также образуется темно-синий осадок – турнбулева синь: