Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение атомов
Содержание
- 1. Строение атомов
- 2. План изученияВажность познания атома.Модели строения атома.Опыт Эрнеста Резерфорда.Ядерная модель строения атома.Протонно-нейтронная модель ядра.Обобщение.
- 3. Возникновение понятия «атом»Понятие «атом» впервые появилось в
- 4. Выдающийся физик современности, лауреат Нобелевской премии Роберт
- 5. Экспериментальные данные, свидетельствующие о делимости атомаОткрытие электрона 1891г.Открытие явления радиоактивности 1896г.Опыт Эрнеста Резерфорда 1911г.
- 6. Открытие электронаЗанимаясь изучением газового разряда Д.Д.Томсон, совместно
- 7. Радиоактивность В 1896 году французский ученый Анри Беккерель
- 8. Радиоактивность
- 9. Модель атома ТомсонаОдну из первых моделей атома
- 10. Опыт Э.РезерфордаЭ. Резерфорд с учениками проверил состоятельность модели атома Томсона. Эрнест РЕЗЕРФОРД (1871 - 1937)
- 11. Выводы Э. РезерфордаУченому понадобилось несколько лет, чтобы
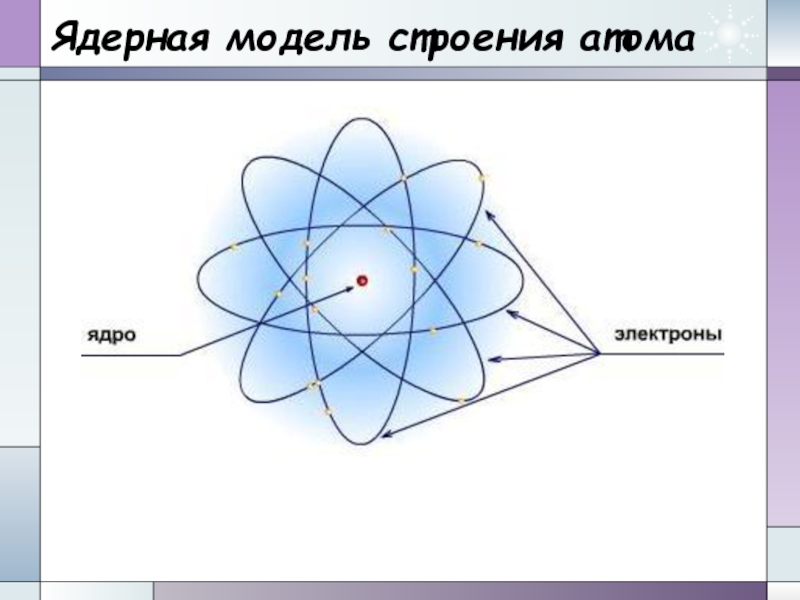
- 12. Ядерная модель строения атома
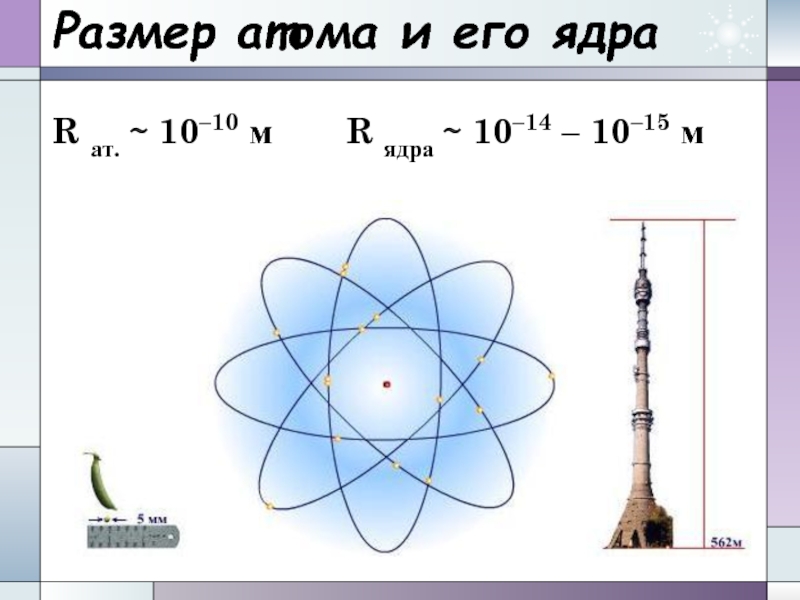
- 13. Размер атома и его ядраR ат. ∼
- 14. Открытие протона1913 г. Э.Резерфорд выдвинул гипотезу о
- 15. Открытие нейтрона1920 г. Э.Резерфорд предположил существование электрически
- 16. Протонно-нейтронная модель ядра1932 г. советские ученые Е.Н.
- 17. Слайд 17
- 18. Характеристика элементарных частиц
- 19. Строение атомовАтомЯдросостоит из нуклонов (протонов и нейтронов).состоит из электронов. Электронная оболочкаОпределяет массу атома.m(ядра) ≈ m(атома).R(ядра)
- 20. Состав атома Атомы химических элементов состоят из трех
- 21. Атом – наименьшая частица химического элемента, носитель его свойств.
- 22. Количественная характеристика атомовА – массовое число атомаZ
- 23. Опишите характеристики и состав атомовМасса атомов: 14
- 24. Домашнее задание:Учебник: § 1 (до квантовых постулатов Бора), упр. 1, 2.Записи в тетради.
- 25. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Строение атомов
Химия. 11 класс.
Сазонов В.В., учитель химии
МОУ средней общеобразовательной
школы д.Васькион
Слайд 2План изучения
Важность познания атома.
Модели строения атома.
Опыт Эрнеста Резерфорда.
Ядерная модель строения
атома.
Протонно-нейтронная модель ядра.
Обобщение.
Слайд 3Возникновение понятия «атом»
Понятие «атом» впервые появилось в работах древнегреческих философов
Демокрита и Левкипта. Под атомом они понимали мельчайшую частицу вещества
(atomos – неделемый). К атомной гипотезе они пришли только на основании размышлений, т.к. в то время люди не владели современными физическими методами исследования.Демокрит
(ок. 460–370 до н.э.)
Древнегреческий ученый
Слайд 4Выдающийся физик современности, лауреат Нобелевской премии Роберт Фейнман говорил:
«Если бы
в результате какой-то мировой катастрофы все накопленные знания вдруг оказались
уничтоженными, и к грядущим поколениям живых существ перешла только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза: все тела состоятиз атомов - маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому».
Слайд 5Экспериментальные данные, свидетельствующие о делимости атома
Открытие электрона 1891г.
Открытие явления радиоактивности
1896г.
Опыт Эрнеста Резерфорда 1911г.
Слайд 6Открытие электрона
Занимаясь изучением газового разряда Д.Д.Томсон, совместно с сотрудниками выполнил
серию классических работ, приведших к открытию электрона - впервые измерил
отношение заряда электрона к массе в 1897 г.Джозеф-Джон Томсон - английский физик, удостоенный в 1906 г. Нобелевской премии по физике за работы, которые привели к открытию электрона.
Джозеф-Джон
ТОМСОН
(18.12.1856 - 30.8.1940)
Слайд 7Радиоактивность
В 1896 году французский ученый Анри Беккерель открыл явление естественной
радиоактивности - самопроизвольного распада ядер атомов тяжелых элементов.
Анри
БЕККЕРЕЛЬ
(15.XII.1852
- 25.VIII.1908)Слайд 9Модель атома Томсона
Одну из первых моделей атома предложил английский физик
Дж. Томсон в 1903 г.
По Томсону атом – равномерно
заполненный положительным зарядом шар, внутри которого находятся электроны.Не объясняла явление радиоактивности и нуждалась в экспериментальной проверке.
Джозеф Джон Томсон
1856 – 1940
Слайд 10Опыт Э.Резерфорда
Э. Резерфорд с учениками проверил состоятельность модели атома Томсона.
Эрнест РЕЗЕРФОРД
(1871 - 1937)
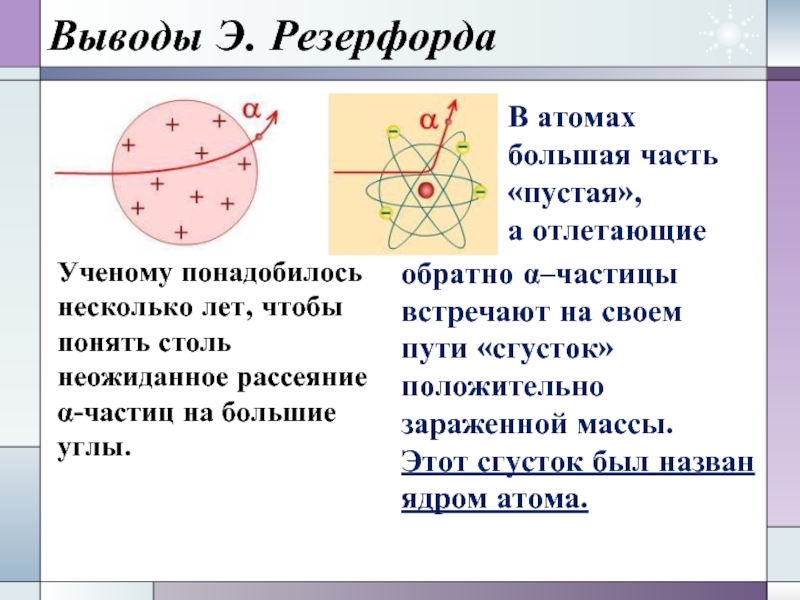
Слайд 11Выводы Э. Резерфорда
Ученому понадобилось несколько лет, чтобы понять столь неожиданное
рассеяние α-частиц на большие углы.
В атомах большая часть «пустая»,
а отлетающие
обратно
α–частицы встречают на своем пути «сгусток» положительно зараженной массы.
Этот сгусток был назван ядром атома.Слайд 14Открытие протона
1913 г. Э.Резерфорд выдвинул гипотезу о том, что одной
из частиц, входящих в состав атомных ядер всех химических элементов,
является ядро атома водорода.1919 г. Э.Резерфорд провел эксперимент по исследованию взаимодействия α-частиц
с ядрами атомов азота.
α
+
N
+
Протон (от греч. protos – первый)
Слайд 15Открытие нейтрона
1920 г. Э.Резерфорд предположил существование электрически нейтральной частицы с
массой, приблизительно равной массе протона.
1932 г. Английский ученый Джеймс Чедвик
выделил новую частицу в бериллиевом излучении.α
+
Ве
+
Нейтрон – нейтральный (нет заряда)
Слайд 16Протонно-нейтронная модель ядра
1932 г. советские ученые Е.Н. Гапон, Д.Д.Иваненко и
немецкий физик Гейзенберг
Все ядра атомов состоят из частиц двух
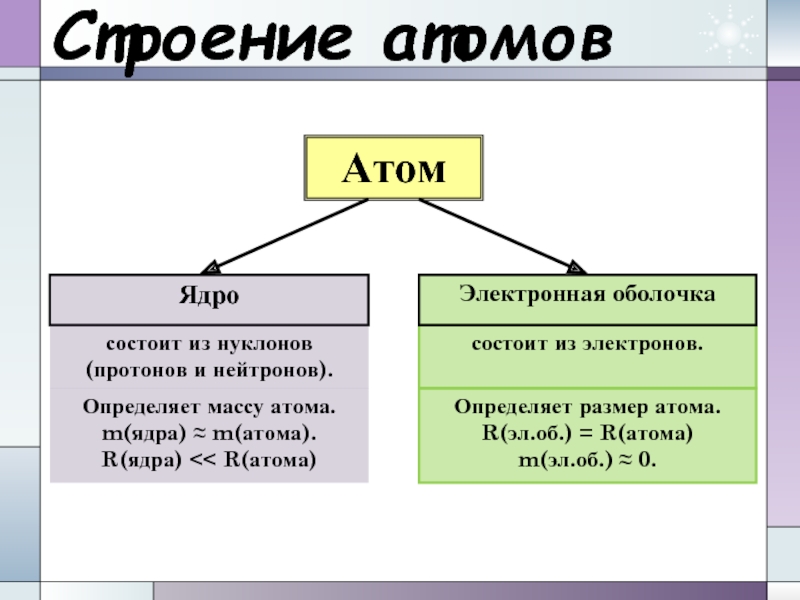
видов – протонов и нейтронов, имеющих общее название – нуклоны (от лат. nucleus – ядро).Слайд 19Строение атомов
Атом
Ядро
состоит из нуклонов (протонов и нейтронов).
состоит из электронов.
Электронная
оболочка
Определяет массу атома.
m(ядра) ≈ m(атома).
R(ядра)
R(атома)m(эл.об.) ≈ 0.
Слайд 20Состав атома
Атомы химических элементов состоят из трех частиц:
протоны
или р+
нейтроны
или n0
электроны
или е–
Слайд 22Количественная характеристика атомов
А – массовое число атома
Z – зарядовое число
атома
Масса атомов: 7 а.е.м.
Заряд ядра: + 3
Состав ядра:
число протонов: 3
число
нейтронов: 4Число электронов: 3