Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация по химии "Классификация химических реакций"
Содержание
- 1. Презентация по химии "Классификация химических реакций"
- 2. План занятияАктуализация знаний по предыдущей темеФормулирование темы и цели занятияИзучение нового материалаПрактические заданияЗакрепление пройденного материала
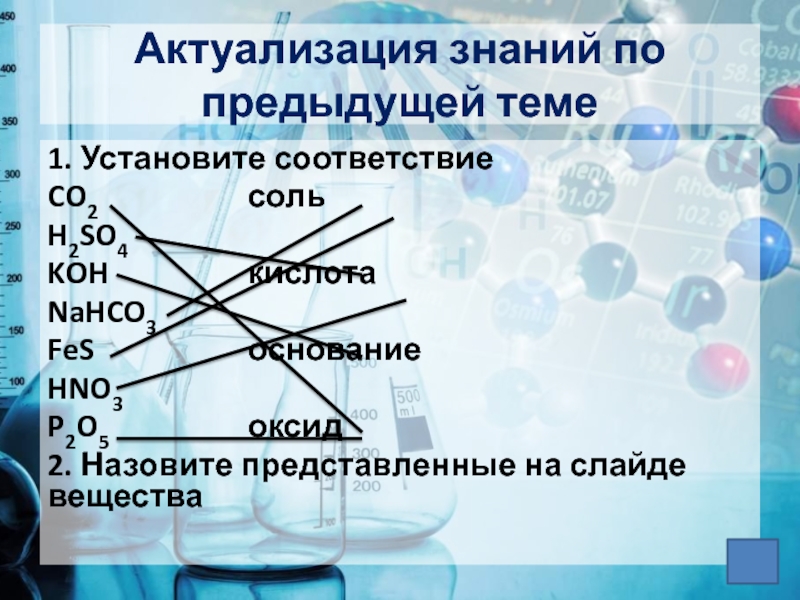
- 3. Актуализация знаний по предыдущей теме1. Установите соответствиеCO2 сольH2SO4KOH кислотаNaHCO3FeS основаниеHNO3P2O5 оксид2. Назовите представленные на слайде вещества
- 4. Формулирование темы и цели занятияЧтобы узнать тему
- 5. Формулирование темы и цели занятияЗакрепим полученный результат2
- 6. Изучение нового материалаРассмотренные типы химических реакций проходят
- 7. Классификация по наличию катализатора
- 8. Классификация по числу фаз, в которых находятся участники реакции
- 9. Классификация реакций по типу переносимых частиц
- 10. Классификация по возможности протекания реакции в прямом и обратном направлении
- 11. Классификация по знаку теплового эффекта реакции
- 12. Практические заданияНеобходимо определить, к какому типу относятся
- 13. Практические заданиянеобходимо проанализировать и определить, к каким
- 14. Закрепление пройденного материала1. К реакциям ионного обмена
- 15. Закрепление пройденного материала3. Взаимодействие оксида серы (IV)
- 16. Закрепление пройденного материала5. К реакциям, идущим без
- 17. Скачать презентанцию
План занятияАктуализация знаний по предыдущей темеФормулирование темы и цели занятияИзучение нового материалаПрактические заданияЗакрепление пройденного материала
Слайды и текст этой презентации
Слайд 2План занятия
Актуализация знаний по предыдущей теме
Формулирование темы и цели занятия
Изучение
нового материала
Практические задания
Закрепление пройденного материала
Слайд 3Актуализация знаний по предыдущей теме
1. Установите соответствие
CO2 соль
H2SO4
KOH кислота
NaHCO3
FeS основание
HNO3
P2O5 оксид
2. Назовите представленные на
слайде вещества
Слайд 4Формулирование темы и цели занятия
Чтобы узнать тему занятия, выполним несколько
заданий
1 задание – Загадки
''Она идет'', ''она прошла'', никто ни скажет,
что пришлаПусть математик удивится: один прибавить к одному, у химика – один
Скажите, что это такое: один нырнул, а всплыло – двое
Слайд 5Формулирование темы и цели занятия
Закрепим полученный результат
2 задание – Схемы
A
+ B = C –
C = A + B
– AB + CD = AC + BD –
AB + C = AC + B –
Итак, давайте сформулируем тему занятия
реакция соединения
реакция разложения
реакция обмена
реакция замещения
Тема:
Классификация химических
реакций
Слайд 6Изучение нового материала
Рассмотренные типы химических реакций проходят либо с образованием
простых веществ из сложного, либо наоборот.
То есть зависят от
числа и состава реагентов и продуктов реакцииДалее мы познакомимся с другими вариантами классификации химических реакций
Слайд 12Практические задания
Необходимо определить, к какому типу относятся приведенные реакции и
дописать продукты реакций. Не забывайте также про соблюдение закона сохранения
массы веществ.СаСО3 + СО2 + Н2О =
Fе + 3Сl2 =
Н2O2 =
C4H10 =
Аl + Fe2O3 =
СаСО3+ SiO2 =
ZnO + Н2SО4 =
СrСl3 + 3NаОН =
Слайд 13Практические задания
необходимо проанализировать и определить, к каким типам относится данная
реакция
Pb(NO3)2(тв) PbO(тв) + NO2(г) + O2(г) – Q
Решение:
реакция
разложения; окислительно-восстановительная;
гетерогенная (газотвёрдофазная);
эндотермическая;
необратимая
Слайд 14Закрепление пройденного материала
1. К реакциям ионного обмена относится реакция между:
а)
нитратом серебра и хлоридом натрия;
б) карбонатом кальция и кремниевой кислотой;
в)
нитратом натрия и хлоридом меди (II);г) гидроксидом меди (II) и оксидом серы(VI)
2. Реакция N2 + O2 ↔ 2NO - Q, является:
а) окислительно-восстановительной;
б) экзотермической;
в) необратимой;
г) обмена.
Слайд 15Закрепление пройденного материала
3. Взаимодействие оксида серы (IV) с кислородом относится
к реакциям
а) замещения, экзотермическим;
б) соединения, экзотермическим;
в) обмена, эндотермическим;
г) соединения, эндотермическим.
4.
Гомогенной является реакция:а) 2Fe +3H2O = Fe2O3 +3H2;
б) CO2 + 2NaOH = Na2CO3 + H2O;
в) CuO + H2 = Cu + H2O;
г) H2SO4 + 2KOH = K2SO4 + 2H2O
Слайд 16Закрепление пройденного материала
5. К реакциям, идущим без изменения степени окисления,
относится реакция между:
а) железом и серой;
б) барием и серной
кислотой;в) оксидом бария и оксидом серы(IV);
г) оксида серы (IV) и кислородом;
6. Необратимой является реакция:
а) разложения угольной кислоты;
б) получения аммиака из простых веществ;
в) разложения гидроксида меди(II);
г) взаимодействие азота с кислородом