Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение электронных оболочек атомов
Содержание
- 1. Строение электронных оболочек атомов
- 2. *I. Электронная оболочка – это совокупность электронов,
- 3. *Тема: Строение электронных оболочек атомов.II. Нарисуйте схемы
- 4. *III. Строение электронной оболочки.Тема: Строение электронных оболочек
- 5. *IV. Строение электронной оболочки.Тема: Строение электронных оболочек
- 6. *Тема: Строение электронных оболочек атомов.V. Составить строение электронной оболочки элемента: В, Cl. В+5110231s21s22s22s22p12p1
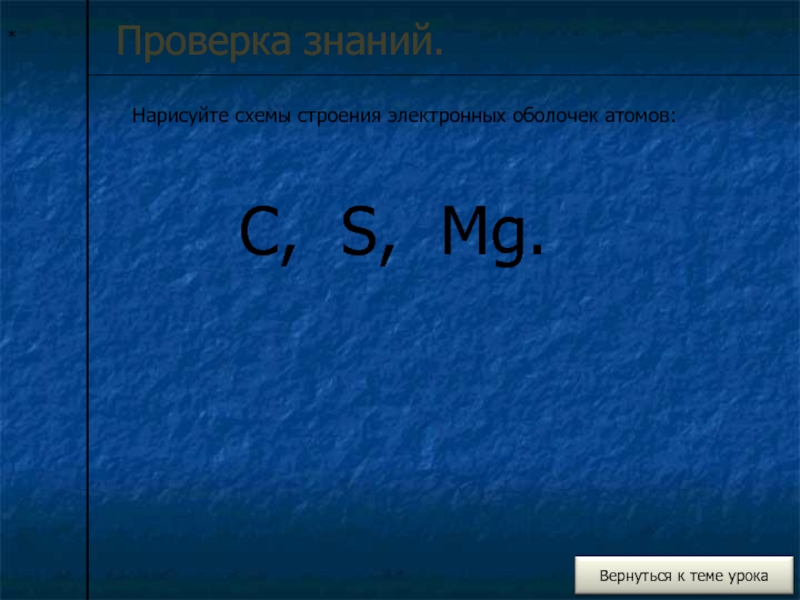
- 7. *Проверка знаний.Нарисуйте схемы строения электронных оболочек атомов:C, S, Mg.
- 8. *Тема: Строение электронных оболочек атомов.Домашнее задание. &
- 9. *Повторение.Определить число протонов , нейтронов и электронов.РФосфор1530,9748Р
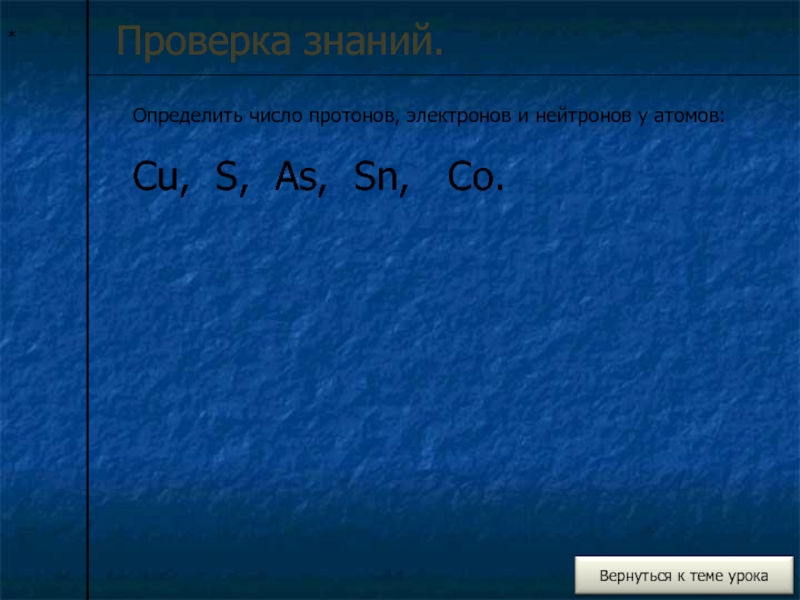
- 10. *Проверка знаний.Определить число протонов, электронов и нейтронов у атомов: Cu, S, As, Sn, Co.
- 11. Скачать презентанцию
Слайды и текст этой презентации
Слайд 12007
aleksei.bazhenov@mail.ru
Тема: Строение электронных оболочек атомов.
Разработал:
Учитель химии – биологии первой квалификационной
категории
Охтеурская ОСШСлайд 2*
I. Электронная оболочка – это совокупность электронов, двигающихся вокруг ядра
атома.
Тема: Строение электронных оболочек атомов.
Электроны в электронной оболочке располагаются на
энергетических уровнях.n – главное квантовое число – определяет число энергетических уровней .
Номер периода совпадает с числом энергетических уровней элемента.
Период
3
Группа
V
3
Число электронов (N) на уровне рассчитывается по формуле.
N = 2n2
n = 1, N = 2 . 12 = 2
2
n = 2, N = 2 . 22 = 8
8
Номер группы совпадает с числом электронов на последнем энергетическом уровне.
5
Общее число электронов
е =
15
Проверка
15
Слайд 3*
Тема: Строение электронных оболочек атомов.
II. Нарисуйте схемы строения электронных оболочек
атомов: кислорода, натрия, водорода, кремния, углерода, гелия.
O
Na
H
Si
C
2
1
Hе
2
6
2
8
1
2
8
4
2
4
+8
0
0
0
0
0
0
+11
+1
+14
+6
+2
16
23
1
28
12
4
Слайд 4*
III. Строение электронной оболочки.
Тема: Строение электронных оболочек атомов.
- Энергетический уровень
состоит из орбиталей.
2
8
5
Первый уровень
s – орбиталь
Второй уровень
s – орбиталь
p –
орбитальТретий уровень
s – орбиталь
p – орбиталь
d – орбиталь
- Орбиталь состоит из квантовых ячеек.
квантовая
ячейка
Слайд 5*
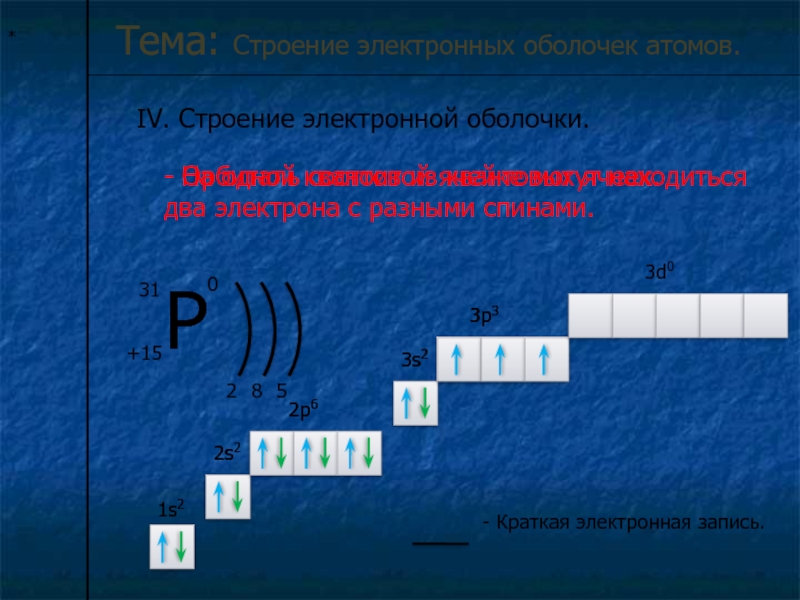
IV. Строение электронной оболочки.
Тема: Строение электронных оболочек атомов.
2
8
5
- Орбиталь состоит
из квантовых ячеек.
- На одной квантовой ячейке могут находиться два
электрона с разными спинами.1s2
1s2
2s2
2s2
2p6
2p6
3s2
3s2
3p3
3p3
3d0
- Краткая электронная запись.
Слайд 6*
Тема: Строение электронных оболочек атомов.
V. Составить строение электронной оболочки элемента:
В, Cl.
В
+5
11
0
2
3
1s2
1s2
2s2
2s2
2p1
2p1
Слайд 8*
Тема: Строение электронных оболочек атомов.
Домашнее задание.
& 8 Стр. 46
- 50
Нарисуйте схемы строения электронных оболочек атомов:
бора, магния, хлора, лития,
серы, алюминия.Слайд 9*
Повторение.
Определить число протонов , нейтронов и электронов.
Р
Фосфор
15
30,9748
Р =
е =
N
=
Правила:
1. Порядковый номер элемента определяет заряд ядра и равен
числу протонов. (+15)
15
2. Атом в целом электронейтрален. Число протонов равно числу электронов .
15
(-15)
= 0
31
- 15 = 16
3. Масса атома складывается из числа протонов и нейтронов.
Р
+15
0
31