Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Тест для подготовки к ГИА-9 по химии 9 класс
Содержание
- 1. Тест для подготовки к ГИА-9 по химии 9 класс
- 2. РекомендацииДанный тест предназначен для подготовки учащихся 9
- 3. Часть А Содержит 15 вопросов с одним выбором ответа
- 4. A1 На приведённом рисунке изображена модель атома
- 5. А2 В ряду химических элементов Te -
- 6. А3 Ионная связь характерна для каждого из
- 7. А4 Наименьшее значение степени окисления азот имеет
- 8. A5 Кислотному оксиду и кислоте соответствуют формулы1)
- 9. A6 Признаком протекания химической реакции между гидроксидом
- 10. А7 Вещество, при диссоциации которого образуется ортофосфат
- 11. A8 Необратимо протекает реакция ионного обмена между
- 12. А9 В реакцию с водой при комнатной
- 13. А10 С гидроксидом калия реагируют каждый из
- 14. А11 При взаимодействии раствора серной кислоты с
- 15. А12 Хлорид бария не реагирует с H2SO4NaCO3AgNO3KOH
- 16. А13 Верны ли следующие суждения о правилах
- 17. А14 В лаборатории аммиак получаютВзаимодействием азота с
- 18. А15 Массовая доля хлора в оксиде хлора(V)
- 19. Часть ВПри выполнении заданий B1, B2 из
- 20. В1 Значения высших степеней окисления элементов увеличивается
- 21. B2 Для ацетилена верны следующие суждения:Молекула состоит
- 22. B3 Установите соответствие между двумя веществами и
- 23. В4 Установите соответствие
- 24. Часть С Необходимо представить развернутый вариант решения каждого задания
- 25. С1Используя метод электронного баланса,расставьте коэффициенты в уравнении
- 26. С2 При добавлении к раствору
- 27. С3 Даны вещества : FeCl3, H2SO4(конц), Fe,
- 28. Источники информации:Химия . 9-й класс. Подготовка к
- 29. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
Тест для подготовки
к ГИА-9 по химии
Выполнила: Зыкова Ксения, ученица
9 а класса МБОУ « Куженерская средняя общеобразовательная школа №2»
учитель химии Пирогова.Т.В.Слайд 2Рекомендации
Данный тест предназначен для подготовки учащихся 9 классов к государственной
итоговой аттестации по химии.
Может использоваться для индивидуальной (самостоятельной) подготовки учащихся
к экзамену.Может использоваться учителем для подготовки класса (группы) к экзамену или для обобщения изученного материала.
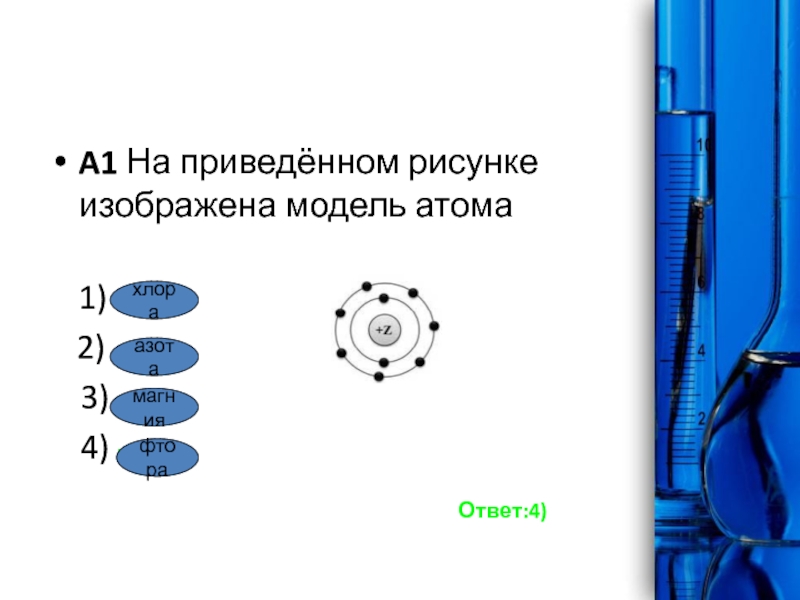
Слайд 4A1 На приведённом рисунке изображена модель атома
1) неверно
2) неверно
3) неверно
4) верно
Ответ:4)хлора
азота
магния
фтора
Слайд 5А2 В ряду химических элементов Te - Se - S
1) усиливаются металлические свойства
2) ослабевают восстановительные свойства3) уменьшается электроотрицательность
4) возрастает высшая степень окисления в оксидах
Ответ:2)
Слайд 6А3 Ионная связь характерна для каждого из двух веществ
1) карбид алюминия и угольная кислота
2) хлорид калия и гидрит
кальция3) угарный газ и этиловый спирт
4) сера и нитрат алюминия
Ответ:2)
Слайд 7А4 Наименьшее значение степени окисления азот имеет в соединении
1) NH4OH
2)
NaNO2
3) N2O3
4) HNO3
Ответ: 1)Слайд 8A5 Кислотному оксиду и кислоте соответствуют формулы
1) N2O и HNO3
2)
CO2 и CH4
3) BeO и Be(OH)2
4) SO2 и H2S
Ответ:4)Слайд 9A6 Признаком протекания химической реакции между гидроксидом меди (II) и
соляной кислотой является
1) выпадение осадка
2) появление запаха
3) выделение газа
4) растворение
осадкаОтвет: 4)
Слайд 10А7 Вещество, при диссоциации которого образуется ортофосфат ион, имеет формулу
Na3PO4
H3PO3
KPO3
Na4P2O7
Ответ:1)
Слайд 11A8 Необратимо протекает реакция ионного обмена между растворами
1) нитрата калия
и серой кислоты
2) нитрата серебра и хлорида меди(II)
3) соляной кислоты
и сульфата аммония4) сульфита калия и гидроксида натрия
Ответ:2)
Слайд 12А9 В реакцию с водой при комнатной температуре вступают оба
вещества пары
кислорода и углерода
железо и сера
медь и хлор
калий и кальций
Ответ:4)Слайд 13А10 С гидроксидом калия реагируют каждый из двух оксидов
CuO и
N2O5
Al2O3 и SO3
K2O и NO2
CaO и SO2
Ответ:2)Слайд 14А11 При взаимодействии раствора серной кислоты с оксидом железа(III) образуются
Сульфит
железа(III) и водород
Гидроксид железа(III) и сероводород
Сульфат железа(III) и вода
Сульфид железа(III)
и водаОтвет:3)
Слайд 16А13 Верны ли следующие суждения о правилах безопасной работы в
химической лаборатории?
А. Получать хлор необходимо в вытяжном
шкафуБ. При работе с растворами едких веществ необходимо надевать защитные перчатки и очки.
Верно только А
Верно только Б
Верны оба суждения
Оба суждения неверны
Ответ:3)
Слайд 17А14 В лаборатории аммиак получают
Взаимодействием азота с водородом
Взаимодействием хлорида аммония
с гидроксидом кальция
Взаимодействием оксида азота(V) и воды
Разложением азотной кислоты
Ответ:2)Слайд 19Часть В
При выполнении заданий B1, B2 из предложенного перечня ответов
выберите два правильных
При выполнении заданий B3, B4 к
каждому элементу первого столбца подберите соответствующий элемент из второго столбца. Слайд 20В1 Значения высших степеней окисления элементов увеличивается в рядах:
1) As-S-N
4) Ge-As-Se2) Se-S-O 5) Be-С-N
3) Al-P-Cl
Ответ:3) 5)
Слайд 21B2 Для ацетилена верны следующие суждения:
Молекула состоит из двух атомов
углерода и четырех атомов водорода
Является предельным углеводородом
Атомы углерода в молекуле
соединены тройной связьюВступает в реакцию с хлором
При разложении образуются углекислый газ и водород
Ответ:
Слайд 22B3 Установите соответствие между двумя веществами и реактивом, с помощью
которого можно различить эти вещества. К каждому элементу первого столбца
подберите соответствующий элемент из второго столбца.
ВЕЩЕСТВА
А) Na2CO3 и Na2SiO3
Б) K2CO3 и Li2CO3
В) Na2SO4 и NaOH
Ответ:
РЕАКТИВ
1) СгСl2
2) HCl
3) MgO
4) K3PO4
Слайд 23 В4 Установите соответствие между формулой вещества и реагентами, с каждым
из которых оно может реагировать.
ФОРМУЛА ВЕЩЕСТВА
А) HNO3(разб.)
Б) H2SO4(разб.)В) H2S
РЕАГЕНТЫ
HNO3,HI
SO2, Ca(OH)2
HNO3(конц.), CaCl2
Ba(NO3)2, Zn
Ответ:
Слайд 25С1Используя метод электронного баланса,расставьте коэффициенты в уравнении реакции,схема которой
KMnO4 + HCI = KCI + MnCI2 + CI2 + H2O
Определите окислитель и восстановитель.
1) Расставим степени окисления всех элементов в веществах, участвующих в реакции:
K+Mn+7O-24 + H+CI- = K+CI- + Mn+2CI-2 + CI02 + H+2O-2
Степени окисления поменяли марганец и хлор.
3)Составляем схему, отражающую процесс перехода электронов:
Mn+7+5е- = Mn+2 окислитель, процесс восстановление
2 CI- -2е- = CI02 восстановитель, процесс окисление
4) Уравняем число отданных и принятых электронов. Для этого находим наименьшее общее кратное для чисел 5 и 2. Это 10. В результате деления наименьшего общего кратного на число отданных и принятых электронов, находим коэффициенты перед окислителем и восстановителем.
Mn+7+5е- = Mn+2 * 2
2 CI- -2е- = CI02 * 5
5) Переносим коэффициенты в исходную схему и преобразуем уравнение реакции.
2KMnO4 + 16 HCI = 2KCI + 2MnCI2 + 5CI2 + 8H2O
Слайд 26 С2 При добавлении к раствору серной кислоты с массовой
долей 7% избытка раствора хлорида бария образовался осадок массой 11,
65 г. Определите массу исходного раствора серной кислоты.Дано: Решение:
ω(H2SO4)=7% H2SO4+BaCl2(изб.)=BaSO4 +2HCl
m(BaSO4)=11,65 г. 1)М(H2SO4)=2+32=64=98 г/моль
М(BaSO4)=137+32+64=233 г/моль
m(р-р H2SO4)=? 2)m(H2SO4)= 11,65г*98г/моль/233г/моль=4,9 г.
ω=m(в-ва)/m(р-ра) * 100%=>
m(р-ра)=m(в-ва)/ω*100%
m(р-ра H2SO4)=4,9г/7%*100%=70г.
Ответ:70 г.
Слайд 27С3 Даны вещества : FeCl3, H2SO4(конц), Fe, Cu, NaOH, CuSO4
Используя воду и необходимые вещества только
из этого списка, получите в две стадии гидроксид железа (II). Опишите признаки проводимых реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.Составлены два уравнения реакции:
Fe+CuSO4=FeSO4+Cu
FeSO4+2NaOH=Fe(OH)2=Na2SO4
Описаны признаки протекания реакции:
3)Для первой реакции : выделение красного осадка металлической меди
4)Для второй реакции : выпадение серо-зелёного осадка.
Составлено сокращенное ионное уравнение второй реакции:
5) Fe 2+ + 2OH-= Fe(OH)2
Слайд 28Источники информации:
Химия . 9-й класс. Подготовка к ГИА-2012: учебно-методическое пособие
/ Под редакцией В.Н Доронькина.- Ростов н/Д: Легион,2011.
Химия. 9-й класс.
Подготовка к ГИА-2014: учебно-методическое/Под ред. В.Н.Доронькина. – Ростов н/Д: Легион, 2013.www.fipi.ru