Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок химии электролиз солей
Содержание
- 1. Урок химии электролиз солей
- 2. Цель урока:Изучить сущность процесса электролиза и выяснить области его применения.
- 3. «В 1886 году два молодых изобретателя одновременно
- 4. Электролиз - окислительно – восстановительный процесс, протекающий
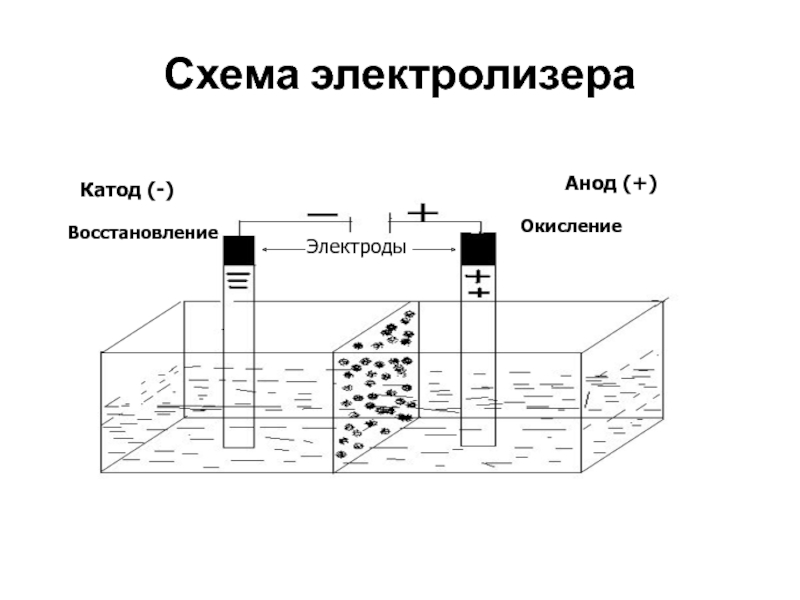
- 5. Схема электролизераВосстановлениеОкислениеКатод (-)Анод (+)Электроды
- 6. Правила катодного процесса :в расплавахЧто есть, то
- 7. Правила анодного процесса:1. Бескислородные анионы (кроме F-)
- 8. Слайд 8
- 9. Слайд 9
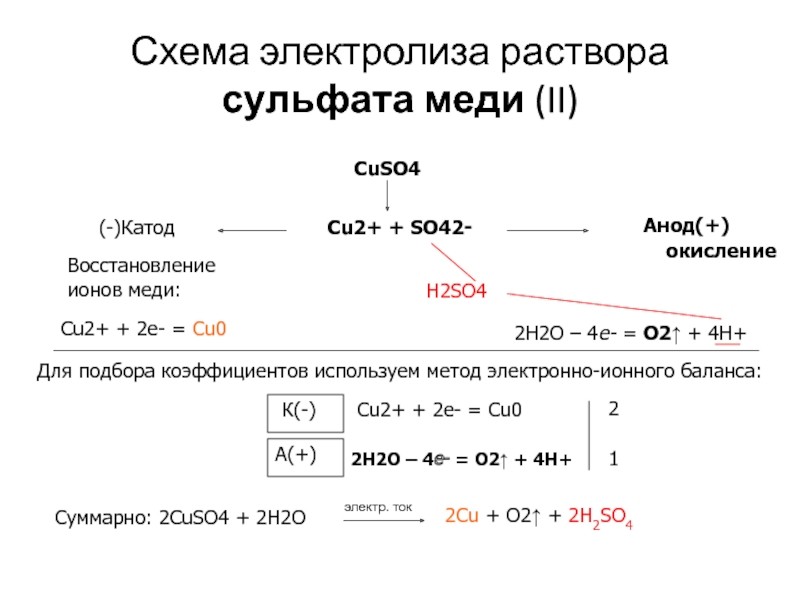
- 10. Схема электролиза раствора сульфата меди (II)электр. токCuSO4(-)КатодCu2+
- 11. Применение электролизаЭлектрометаллургия: а) получение активных металлов (K,
- 12. Электролиз раствора поваренной соли
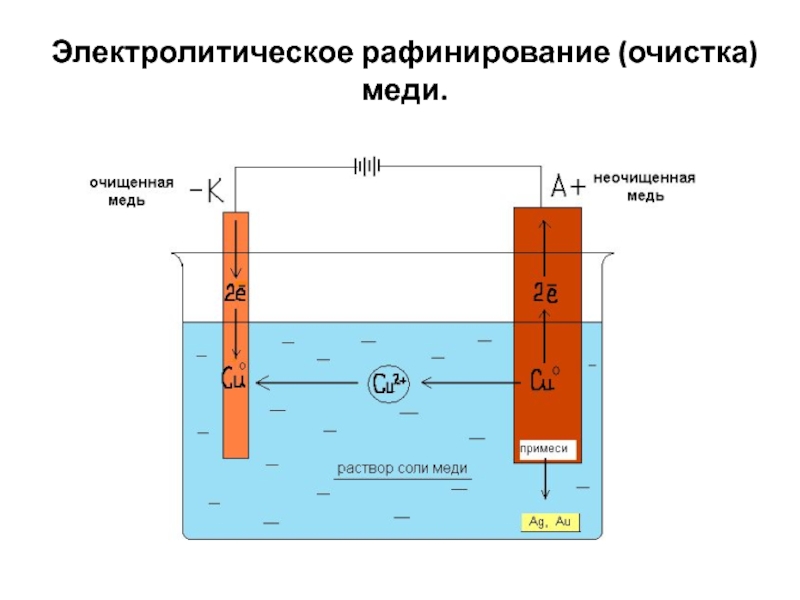
- 13. Электролитическое рафинирование (очистка) меди.
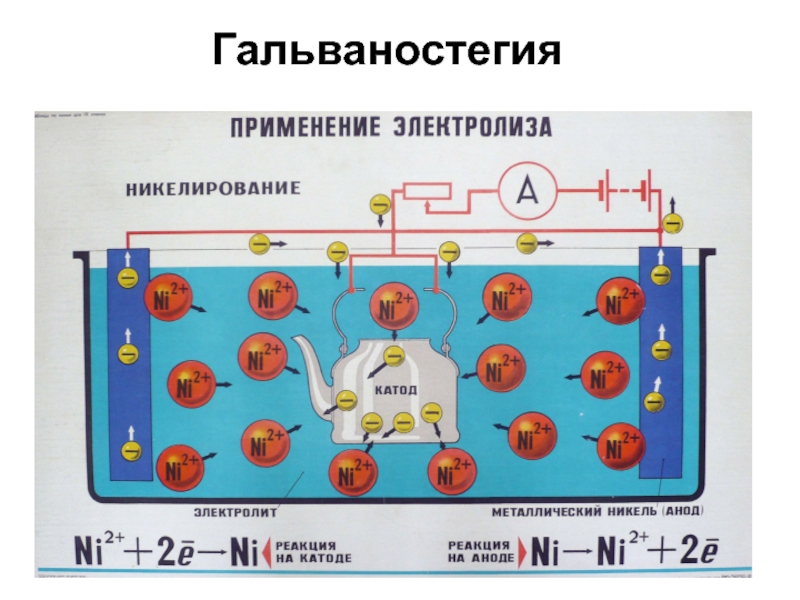
- 14. Гальваностегия
- 15. Покрытие предметов слоем благородного металла
- 16. Занимательная проблемаИнститут прикладной физики Китайской академии
- 17. Слайд 17
- 18. Слайд 18
- 19. это получение электролитическим способом более
- 20. Изготовление медалей, монет.
- 21. Произведения искусства:Барельефы для: Исаакиевского собора
- 22. Петропавловского собора
- 23. Эрмитажа
- 24. Зимнего дворца
- 25. Большого театра
- 26. Медные клише для типографии
- 27. Пресс-формы из пластмассы, резины, металла
- 28. Пресс-формы из пластмассы, резины, металла
- 29. Выводы- Электролиз - окислительно-восстановительный процесс.- Протекает в
- 30. Графический диктант (ДА-НЕТ)Электролиз можно считать окислительно-восстановительной реакцией,
- 31. Итоговое тестирование1. Расплав какого вещества подвержен электролизу?
- 32. Диктант 9-10 баллов – «5» 7-8 баллов
- 33. Домашнее задание§ 18, № 1,2 с. 104Задачник:
- 34. Скачать презентанцию
Цель урока:Изучить сущность процесса электролиза и выяснить области его применения.
Слайды и текст этой презентации
Слайд 3«В 1886 году два молодых изобретателя одновременно и независимо друг
от друга подали свои патенты на производство алюминия. Один из
них был француз, а другой - американец. Их изобретение, известное как процесс «Hall-Héroult», дало жизнь электролизу алюминия. На этом процессе, до сих пор, спустя уже более 125 лет, базируется современная алюминиевая промышленность. Естественно, он был значительно улучшен для удовлетворения новых экономических, энергетических и экологических задач. За это время потребление алюминия выросло с нескольких тысяч тонн в 1900 году до 50 миллионов тонн в настоящее время. Этот способ используется и на металлургических предприятиях в нашем крае.»Какую информацию вы хотели бы узнать дополнительно после прочтения этого текста?
Слайд 4Электролиз
- окислительно – восстановительный процесс, протекающий на
электродах
при прохождении
электрического тока через расплав или
водный раствор электролита.Слайд 6Правила катодного процесса :
в расплавах
Что есть, то и выделяется.
в растворах
(мешает вода)
1. От Li до Al восстанавливается H2 из воды (2H2O+2e=H2+2OH-)
2.
От AI до H2 восстанавливается Ме + H2 из воды (2Н₂О + 2е⁻ → Н₂↑ + 2ОН‾)
3. От Cu и далее восстанавливается Me:
Ме⁺ + ne⁻ → Me ⁰
Слайд 7Правила анодного процесса:
1. Бескислородные анионы (кроме F-) окисляются до простых
веществ (галогенов)
2. Кислородсодержащий анион (и F‾)
В кислой или нейтральной среде:
2H2O
- 4е⁻ = О2 + 4Н+В щелочной среде:
4ОН‾ – 4е⁻ → О₂ + 2Н₂О
Слайд 10Схема электролиза раствора сульфата меди (II)
электр. ток
CuSO4
(-)Катод
Cu2+ + SO42-
Анод(+)
Восстановление
ионов меди:
окисление
H2SO4
2H2O
– 4e- = O2↑ + 4H+
Для подбора коэффициентов используем метод
электронно-ионного баланса:К(-)
А(+)
Cu2+ + 2е- = Сu0
2H2O – 4e- = O2↑ + 4H+
2
1
Суммарно: 2CuSO4 + 2H2O
2Cu + O2↑ + 2H2SO4
Cu2+ + 2е- = Сu0
Слайд 11Применение электролиза
Электрометаллургия:
а) получение активных металлов (K, Na, Ca, Mg,
Al и др.) электролизом расплавов природных соединений;
б) получение металлов средней активности (Zn, Cd, Co) электролизом растворов их солей.
химической промышленности
В– получение газов: F2, Cl2, H2, O2; щелочей: NaOH, KOH; пероксида водородаH2O2, тяжелой воды D2O и др.
Электролитическое рафинирование – очистка металлов (Cu, Pb, Sn и др.) от примесей электролизом с применением активных (растворимых) анодов.
Гальваностегия – нанесение металлических покрытий на поверхность металлического изделия для защиты от коррозии или придания декоративного вида. Например, оцинковка, хромирование, никелирование и пр.
Гальванопластика – получение металлических копий с различных матриц, а также покрытие неметаллических предметов слоем металлов. Последний процесс (золочение деревянных статуй и ваз) был известен еще в Древнем Египте, но научные основы гальванопластики были заложены русским ученым Б. Якоби в 1838 г.
Слайд 16 Занимательная проблема
Институт прикладной физики Китайской академии наук сообщил о
результатах исследования гробницы полководца Джоу-Чжу, похороненного в 237 г н.
Спектральный анализ орнамента украшающего саркофаг показал, что он состоит из сплава содержащего 85% Al, 10% меди, 5% Mg.Как могли древние китайские мастера получить сплав?
Слайд 19 это получение электролитическим способом более толстых отложений (до
нескольких миллиметров).
ГАЛЬВАНОПЛАСТИКА
Копия барельефа, полученная методом гальванопластики
Слайд 29Выводы
- Электролиз - окислительно-восстановительный процесс.
- Протекает в растворах и расплавах
электролитов.
- Под действием электрического тока.
Продукты электролиза определяются характером металлов и
кислотных остатков солей (ряд напряжение металлов и окислительный ряд ионов)
- Электролиз растворов энергетически выгоднее, чем расплавов, т.к электролиты солей, щелочей, оксидов плавятся при очень высоких температурах.
Слайд 30Графический диктант (ДА-НЕТ)
Электролиз можно считать окислительно-восстановительной реакцией, происходящей под воздействием
электрического тока.
Катод – отрицательно заряженный электрод.
На катоде происходит процесс электрохимического
окисления.Анион SO4 будет окисляться на аноде в водном растворе.
Анион CL будет окисляться на аноде в водном растворе.
Катион Na будет восстанавливаться на катоде в водном растворе.
Катион Cu будет восстанавливаться на катоде в водном растворе.
Алюминий получают электролизом расплава AL2O3 в криолите.
При электролизе раствора NaCl можно получить щелочь NaOH и газы H2 и Cl2.
На инертном аноде при электролизе фторидов выделяется кислород.
Слайд 31Итоговое тестирование
1. Расплав какого вещества подвержен электролизу?
а
– оксид кальция б – парафин
в – глюкоза г – азот2. Что следует подвергнуть электролизу для получения хлора?
а – хлорную воду б – раствор хлората калия
в – расплав хлорида калия г – хлор электролизом не получают
3. Цвет лакмуса в околокатодном пространстве при электролизе раствора бромида натрия
а – малиновый б – фиолетовый в – красный г – синий
4. Какое вещество нельзя получить при электролизе раствора поваренной соли?
а – Na б – H2 в – Cl2 г – NaOH
5. При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется
а – Zn б – O2 в – H2 г – SO2
6. При электролизе раствора нитрата меди(II) с медными электродами на аноде будет происходить
а – выделение NO2 б – выделение меди
в – выделение O2 г – растворение анода
Слайд 32Диктант 9-10 баллов – «5» 7-8 баллов – «4» 5-6 баллов – «3» 1.
да
2. да
3. нет
4. нет
5. да
6. нет
7. да
8. да
9. да
10. да
Тест
6
баллов – «5»
5 баллов – «4»
4 балла – «3»1. А
2. В
3. Б
4. А
5. Б
6. Г