Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Вода – основа жизни на Земле
Содержание
- 1. Вода – основа жизни на Земле
- 2. «Вода… Ты не имеешь ни вкуса,ни цвета,
- 3. Слайд 3
- 4. Слайд 4
- 5. 1. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ.МОЛЕКУЛА ВОДЫ СОСТОИТ ИЗ
- 6. Пользуясь таблицей растворимости, распределите вещества по группам: растворимые,
- 7. 2.ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ. ЧИСТАЯ (ДИСТИЛЛИРОВАННАЯ) ВОДА –
- 8. -В XVIII ВЕКЕ ВОДА ПОСЛУЖИЛА ЭТАЛОНОМ
- 9. Слайд 9
- 10. 3. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ.1. С МЕТАЛЛАМИ.а) очень
- 11. б) средние по активности металлы при взаимодействии
- 12. 2. С ОКСИДАМИ.а) оксиды металлов при взаимодействии
- 13. Термин "кислотный дождь" существует уже
- 14. Причины образования кислотных дождейвулканыЕстественные причиныгроза
- 15. Причины образования кислотных дождейИскусственные источникиминеральные удобрениясжигание топливатопливо самолетовнефтепереработкаавтотранспорт
- 16. Причины образования кислотных дождейЕжегодно в атмосферу Земли
- 17. Серасодержится в таких полезных ископаемых как уголь,
- 18. СераВ большинстве антропогенных выбросов преобладают оксид серы
- 19. СераПри извержениях вулканов преобладает оксид серы (IV),
- 20. Азотсодержится в топливе многих видов ископаемых, например,
- 21. Природные источники оксидов азота - это грозовые
- 22. Последствия кислотных дождей в природеВ результате выпадения
- 23. Последствия кислотных дождей в техникеВ результате коррозии разрушаются металлические конструкции.
- 24. Последствия кислотных дождей в архитектуреКислотные осадки разрушают
- 25. Последствия кислотных дождей в архитектуреТакая же судьба
- 26. Последствия кислотных дождейархитектура
- 27. Последствия кислотных дождей… в Санкт-Петербурге – Казанскому собору, Александро-Невской Лавре и др.
- 28. Последствия кислотных дождей в архитектуреНа соборе
- 29. ЗаданиеЗакончите уравнения реакций, назовите их тип.N 2O5
- 30. В природе путешествует Н2О. Она не исчезает
- 31. Слайд 31
- 32. 1.Одним словом (именем существительным) выразитетему сегодняшнего урока2.Подберите
- 33. «Вода… Ты не имеешь ни вкуса, ни
- 34. Скачать презентанцию
«Вода… Ты не имеешь ни вкуса,ни цвета, ни запаха, тебя невозможно описать – тобой наслаждаешься, не ведая, что ты такое.Ты не просто необходима для жизни, ты и есть сама жизнь. Ты
Слайды и текст этой презентации
Слайд 2
«Вода… Ты не имеешь ни вкуса,
ни цвета, ни запаха,
тебя
невозможно
описать – тобой наслаждаешься,
не ведая, что ты такое.
Ты
не просто необходима для жизни, ты и есть сама жизнь.
Ты божество, ты совершенство,
ты самое большое богатство на свете »
Антуан де Сент – Экзюпери.
Слайд 5
1. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ.
МОЛЕКУЛА ВОДЫ СОСТОИТ
ИЗ 2 АТОМОВ ВОДОРОДА
И 1 АТОМА КИСЛОРОДА,
КОТОРЫЕ НАХОДЯТСЯ
ДРУГ ОТНОСИТЕЛЬНО ДРУГА ПОД
УГЛОМ 105°Слайд 6
Пользуясь таблицей растворимости,
распределите вещества
по группам:
растворимые,
нерастворимые и малорастворимые.
Назовите данные вещества.
Ba(OH)2, KCl, BaSO4, CaSO4,
NaNO3, CuSO4, HNO3, AgCl, FeS, Ca(OH)2.
Слайд 7
2.ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ.
ЧИСТАЯ (ДИСТИЛЛИРОВАННАЯ) ВОДА – БЕСЦВЕТНАЯ ЖИДКОСТЬ, БЕЗ
ЗАПАХА И ВКУСА
ЕДИНСТВЕННОЕ ВЕЩЕСТВО, КОТОРОЕ НА ЗЕМЛЕ СУЩЕСТВУЕТ В ТРЕХ
АГРЕГАТНЫХ СОСТОЯНИЯХТЕМПЕРАТУРА КИПЕНИЯ 100°С
ТЕМПЕРАТУРА КРИСТАЛЛИЗАЦИИ (ПЛАВЛЕНИЯ) 0°С
Слайд 8
-В XVIII ВЕКЕ ВОДА ПОСЛУЖИЛА ЭТАЛОНОМ ДЛЯ ВЫБОРА ЕДИНИЦЫ
МАССЫ: МАССЕ 1 куб. см. БЫЛО ПРИПИСАНО ЗНАЧЕНИЕ 1г
- МАКСИМАЛЬНАЯ
ПЛОТНОСТЬ ПРИ 4°С ПРИНЯТА ЗА 1г/мл, ВСЕ ОСТАЛЬНЫЕ ВЕЩЕСТВА СРАВНИВАЮТСЯ ПО ПЛОТНОСТИ И МАССЕ С ВОДОЙ-ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ, ЧЕМ У ЖИДКОЙ ВОДЫ, ЧТО ЯВЛЯЕТСЯ АНОМАЛЬНЫМ СВОЙСТВОМ ВОДЫ
-ВОДА ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЕМКОСТЬЮ
-ОНА НЕ ПРОВОДИТ
ЭЛЕКТРИЧЕСКИЙ ТОК
Слайд 10
3. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ.
1. С МЕТАЛЛАМИ.
а) очень активные металлы при
взаимодействии с водой образуют гидроксид и водород
2Na + 2H2O =
2NaOH + H2 гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
Слайд 11
б) средние по активности металлы при взаимодействии с водой при
нагревании образуют оксид металла и водород
Zn + H2O = ZnO
+ H2 оксид цинка
в) малоактивные металлы с водой
не реагируют
Слайд 12
2. С ОКСИДАМИ.
а) оксиды металлов при взаимодействии с водой образуют
гидроксиды
CaO + H2O = Ca(OH)2
гидроксид кальцияб) оксиды неметаллов при взаимодействии с водой образуют кислоты
SO3 + H2O = H2SO4
серная кислота
Слайд 13 Термин "кислотный дождь" существует уже более 100 лет; впервые
его использовал британский исследователь Роберт Ангус Смит в 1882 году,
когда опубликовал книгу "Воздух и дождь: начало химической климатологии ".Кислотные дожди (или более правильно, кислотные осадки, так как выпадение вредных веществ может происходить как в виде дождя, так и в виде снега, града) наносят значительный экологический, экономический и эстетический ущерб.
Слайд 15Причины образования кислотных дождей
Искусственные источники
минеральные удобрения
сжигание топлива
топливо самолетов
нефтепереработка
автотранспорт
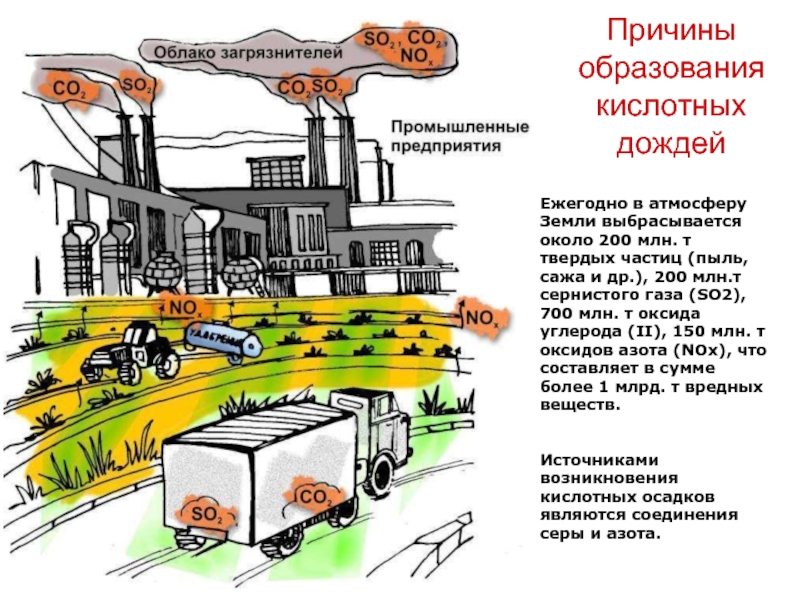
Слайд 16Причины образования кислотных дождей
Ежегодно в атмосферу Земли выбрасывается около 200
млн. т твердых частиц (пыль, сажа и др.), 200 млн.т
сернистого газа (SO2), 700 млн. т оксида углерода (II), 150 млн. т оксидов азота (NOx), что составляет в сумме более 1 млрд. т вредных веществ.Источниками возникновения кислотных осадков являются соединения серы и азота.
Слайд 17Сера
содержится в таких полезных ископаемых как уголь, нефть, железные, медные
и др. руды; одни из них используют как топливо, другие
направляют на предприятия химической и металлургической промышленности.При переработке (в частности, при обжиге руд) сера переходит в химические соединения, например, в сернистый газ (оксид серы (IV)). Образовавшиеся соединения частично улавливаются очистными сооружениями, остальное их количество выбрасывается в атмосферу. Соединяясь с парами воды, предварительно окисленный оксид серы (IV) образует серную кислоту.
Слайд 18Сера
В большинстве антропогенных выбросов преобладают оксид серы (IV) и сульфаты.
Сульфаты выделяются при сжигании топлива и в ходе таких промышленных
процессов, как нефтепереработка, производство цемента и гипса, серной кислоты. Из природных источников серосодержащих соединений важную роль играют биогенные выбросы из почвы и продукты жизнедеятельности растений. В настоящее время в науке недостаточно данных о механизме процессов, в результате которых выделяются соединения серы.Слайд 19Сера
При извержениях вулканов преобладает оксид серы (IV), в меньшем количестве
в атмосферу поступает сероводород, а также сульфаты в виде аэрозолей
и твердых частиц. Ежегодно во всем мире в результате вулканической деятельности выделяется 4-16 млн. т соединений серы (в пересчете на SO2) .Слайд 20Азот
содержится в топливе многих видов ископаемых, например, в угле и
нефти. Из антропогенных источников выделяется около 93 % оксидов азота
(II), который в результате химических реакций в атмосфере превращается в оксид азота (IV), который и образует с водой азотную кислоту.Слайд 21
Природные источники оксидов азота - это грозовые разряды и молнии,
а также биогенные вещества. Летучие органические соединения, в отличие от
оксидов серы и азота, поступают в атмосферу главным образом из природных источников (65% от общего количества). Основной источник этих веществ - растения, в результате жизнедеятельности которых образуются сложные органические вещества.Слайд 22Последствия кислотных
дождей в природе
В результате выпадения кислотных осадков нарушается равновесие
в экосистемах, ухудшается продуктивность сельскохозяйственных растений и питательные свойства почв.
Слайд 23Последствия кислотных дождей
в технике
В результате коррозии разрушаются металлические конструкции.
Слайд 24Последствия кислотных
дождей в архитектуре
Кислотные осадки разрушают сооружения из мрамора и
известняка.
Исторические памятники Греции и Рима, простояв тысячелетия, за последние
годы разрушаются прямо на глазах. Слайд 25Последствия
кислотных дождей
в архитектуре
Такая же судьба грозит
и Тадж-Махалу –
шедевру
индийской архитектуры периода Великих моголов, в Лондоне - Тауэру и
Вестминстерскому аббатству…Слайд 27Последствия
кислотных дождей
… в Санкт-Петербурге –
Казанскому собору,
Александро-Невской Лавре и
др.
Слайд 28Последствия кислотных дождей
в архитектуре
На соборе Св. Павла слой портлендского
известняка изъеден на 2.5 см.
В Голландии статуи на соборе
Св. Иоанна "тают, как леденцы".Черными отложениями, этим "раком камня", изъеден королевский дворец на площади Дам в Амстердаме.
Слайд 29
Задание
Закончите уравнения реакций,
назовите их тип.
N 2O5 + H2O =
Mg + H2O =
Li+ H2O =
СaO + H2O =
Слайд 30
В природе путешествует Н2О.
Она не исчезает никогда.
То в снег превратится,
то в лед, Растает и снова в поход. По горным вершинам, широким
долинам, Вдруг в небо взорвется, дождями вернется, Вокруг оглянись, в природу вглядись - Вас окружает везде и всегда, Это волшебное чудо – вода!Слайд 32
1.Одним словом
(именем существительным) выразите
тему сегодняшнего урока
2.Подберите к этому
слову
2 прилагательных
3. Подберите к этому слову 3 глагола
4. Составьте фразу, в которой
будет отражена значимость этого слова
5. Подберите синоним к этому слову.
Слайд 33
«Вода… Ты не имеешь ни вкуса,
ни цвета, ни запаха,
тебя невозможно описать – тобой наслаждаешься,
не ведая, что ты
такое.Ты не просто необходима для жизни, ты и есть сама жизнь.
Ты божество, ты совершенство,
ты самое большое богатство на свете »
Антуан де Сент – Экзюпери.
Теги