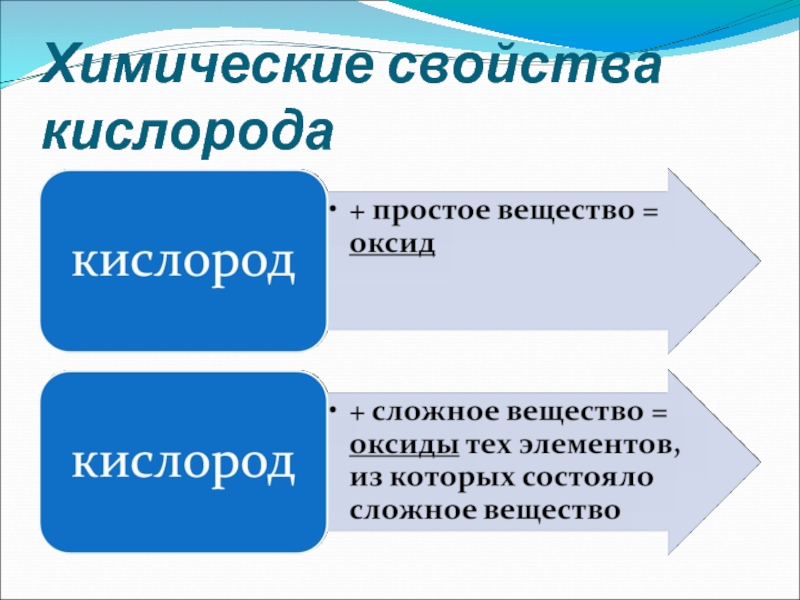
лабораторными и промышленными способами получения кислорода
Познакомиться с понятием о катализаторе
Познакомиться
с важнейшими химическими свойствами кислородаНаучиться давать названия оксидам