Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соль
Содержание
- 1. Соль
- 2. Содержание: 1.Открытие соли. 2.Типы солей. 3.Нахождение в
- 3. Открытие соли.Открытие соли и начало ее употребления
- 4. Средние (нормальные) соли — все атомы водорода в
- 5. Нахождение в природе.Многие минералы — соли, образующие залежи
- 6. Слайд 6
- 7. Методы получения.Существуют различные методы получения солей:Взаимодействие кислот
- 8. Слайд 8
- 9. Химические свойства определяются свойствами катионов и анионов,
- 10. Слайд 10
- 11. Физические свойства.Физические свойстваТипичные соли - кристаллические вещества
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Интересные факты.Обычная пищевая соль в больших количествах
- 17. Известно, что, уходя из таежного приюта, для
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Литература.Семёнов И. Н., Перфилова И. Л. — «Химия», 2000 г.
- 31. Слайд 31
- 32. Подготовила ученица 11 класса Сосинова Кристина.
- 33. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Содержание:
1.Открытие соли.
2.Типы солей.
3.Нахождение в природе.
4.Методы получения.
5.Химические свойства.
6.Физические свойства.
7.Применение солей.
8.Интересные факты.
9.Литература.
Слайд 4Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены
на атомы металла.
Кислые соли — атомы водорода в кислоте замещены
атомами металла частично. Они получаются при нейтрализации основания избытком кислоты. Осно?вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками.
Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми анионами.
Смешанные соли — в их составе присутствует два различных аниона.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды.
Комплексные соли — в их состав входит комплексный катион или комплексный анион.
Типы солей.
Слайд 5Нахождение в природе.
Многие минералы — соли, образующие залежи (например, галит ,
сильвин , флюорит ).
Названия солей образуются из двух слов: название
аниона в именительном падеже и название катиона в родительном падеже: — сульфат натрия. Для металлов с переменной степенью окисления её указывают в скобках и без пробела: — сульфат железа(II), — сульфат железа(III).Названия кислых солей начинаются с приставки «гидро-» (если замещён один атом водорода) или «дигидро-» (если замещены два атома водорода - это не верно!). Например, — гидрокарбонат натрия, — дигидрофосфат натрия.
Названия основных солей начинаются с приставки «гидроксо-» или «дигидроксо-». Например, — гидроксохлорид магния, — дигидроксохлорид алюминия.
В гидратных солях на наличие кристаллической воды указывает приставка «гидрат-». Степень гидратации отражают численной приставкой. Например, — дигидрат хлорида кальция.
На низшую степень окисления кислотообразующего элемента (если их больше двух) указывает приставка «гипо-». Приставка «пер-» указывает на высшую степень окисления (для солей кислот с окончаниями «-овая», «-евая», «-ная»). Например: — гипохлорит натрия, — хлорит натрия, — хлорат натрия, — перхлорат натрия.
Слайд 7Методы получения.
Существуют различные методы получения солей:
Взаимодействие кислот с металлами, основными
и амфотерными оксидами / гидроксидами:
Взаимодействие кислотных оксидов c щелочами, основными
и амфотерными оксидами / гидроксидами:Взаимодействие солей c кислотами, другими солями (если образуется выходящий из сферы реакции продукт):
Взаимодействие простых веществ:
Взаимодействие оснований с неметаллами, например с галогенами:
Слайд 9Химические свойства определяются свойствами катионов и анионов, входящих в их
состав.
Соли взаимодействуют с кислотами и основаниями, если в результате реакции
получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода)Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов
Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции (образуется газ, осадок или вода); в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов
Некоторые соли разлагаются при нагревании
Химические свойства.
Слайд 11Физические свойства.
Физические свойства
Типичные соли - кристаллические вещества с ионной структурой,
например CsF Существуют также ковалентные соли, например АlСl3. В действительности
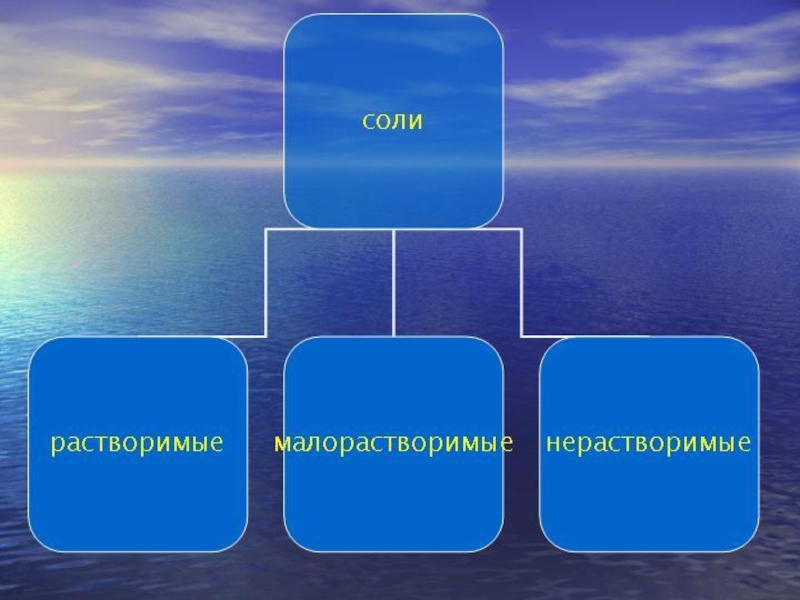
характер химической связи ,v многих солей смешанный.По растворимости в воде различают растворимые, мало растворимые и практически нерастворимые соли. К растворимым относятся почти все соли натрия, калия и аммония, многие нитраты, ацетаты и хлориды, за исключением солей поливалентных металлов, гидролизующихся в воде, многие кислые соли.
Слайд 14
Применение солей.
Соли повсеместно используются как в производстве, так и в повседневной жизни.
Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия.
Хлорид натрия (поваренную соль) выделяют из озерной и морской воды, а также добывают в соляных шахтах. Поваренную соль используют в пищу. В промышленности хлорид натрия служит сырьём для получения хлора, гидроксида натрия и соды.
Хлорид калия используют в сельском хозяйстве как калийное удобрение.
Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при обжиге горной породы (дигидрат сульфата кальция). Будучи смешан с водой, он быстро застывает, образуя дигидрат сульфата кальция, то есть гипс.
Декагидрат сульфата натрия используют в качестве сырья для получения соды.
Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Обычно эти соли называют селитрами.
Из ортофосфатов важнейшим является ортофосфат кальция. Эта соль служит основной составной частью минералов — фосфоритов и апатитов. Фосфориты и апатиты используются в качестве сырья в производстве фосфорных удобрений, например, суперфосфата и преципитата.
Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести.
Карбонат натрия (соду) применяют в производстве стекла и при варке мыла.
Карбонат кальция в природе встречается и в виде известняка, мела и мрамора.
Слайд 16Интересные факты.
Обычная пищевая соль в больших количествах является ядом — летальная
доза в 100 раз превышает суточную норму потребления и составляет
3 грамма на 1 килограмм массы тела, то есть для человека весом 80 кг смертельной дозой является четверть килограммовой пачки.Продаваемая в магазинах соль состоит из NaCl примерно на 97 %, остальная доля приходится на различные примеси. Чаще всего добавляют йодиды и карбонаты, в последние годы всё чаще добавляют фториды. Добавка фторидов используется для профилактики зубных заболеваний. С 1950-х годов добавлять фторид в соль стали в Швейцарии, и благодаря положительным результатам в борьбе с кариесом в 1980-х годах фторид стали добавлять в соль во Франции и в Германии. До 60 % продаваемой соли в Германии и до 80 % в Швейцарии содержит фториды.[источник не указан 265 дней]
Иногда в поваренную соль добавляют другие вспомогательные вещества, например ферроцианид калия (E536 в европейской системе кодирования пищевых добавок; неядовитая комплексная соль) в качестве антислёживающего агента.
Слайд 17Известно, что, уходя из таежного приюта, для случайных путников охотники
непременно оставляют спички и соль.[1]
На Руси издавна было принято в
Страстной четверг готовить так называемую «четверговую соль» — крупную соль смешивали с квасной гущей или мякишем ржаного хлеба и перекаливали на сковороде, после чего толкли в ступе. Четверговую соль употребляли с пасхальными яйцами и некоторыми другими блюдами.[8]Гадания посредством соли известны с древнейших времён[источник не указан 23 дня] и именуются аломантия.
В геральдике соль изображена в гласных гербах русских городов Бахмута, Солигалича, Соликамска, Сольвычегодска.
Герб Бахмута — химический знак соли
Герб Бахмута В.Кене — три кристалла соли
Герб Соликамска - соляной колодец
Герб Солигалича — три ступки соли















![Соль Известно, что, уходя из таежного приюта, для случайных путников охотники непременно Известно, что, уходя из таежного приюта, для случайных путников охотники непременно оставляют спички и соль.[1]На Руси издавна](/img/thumbs/807c3f7ec39fb1cc317052857fe827ff-800x.jpg)