Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
"Окислительно-восстановительные реакции"
Содержание
- 1. "Окислительно-восстановительные реакции"
- 2. Слайд 2
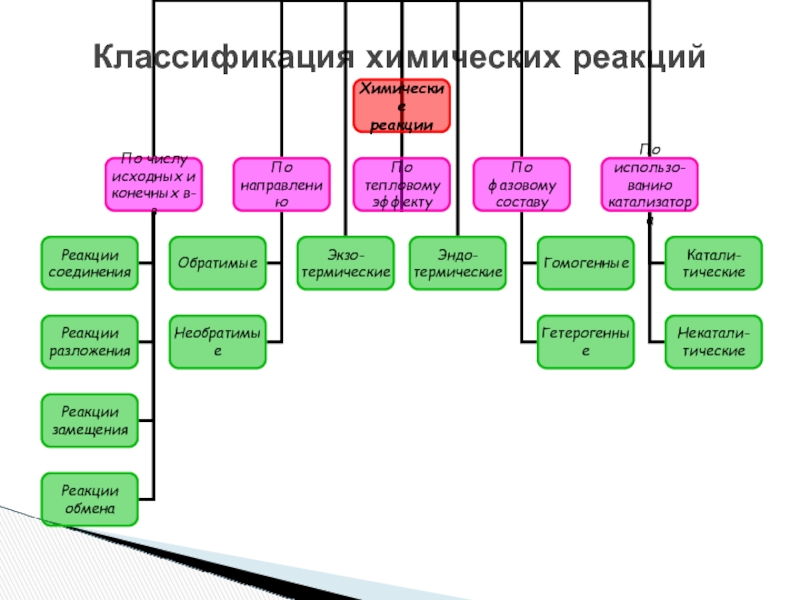
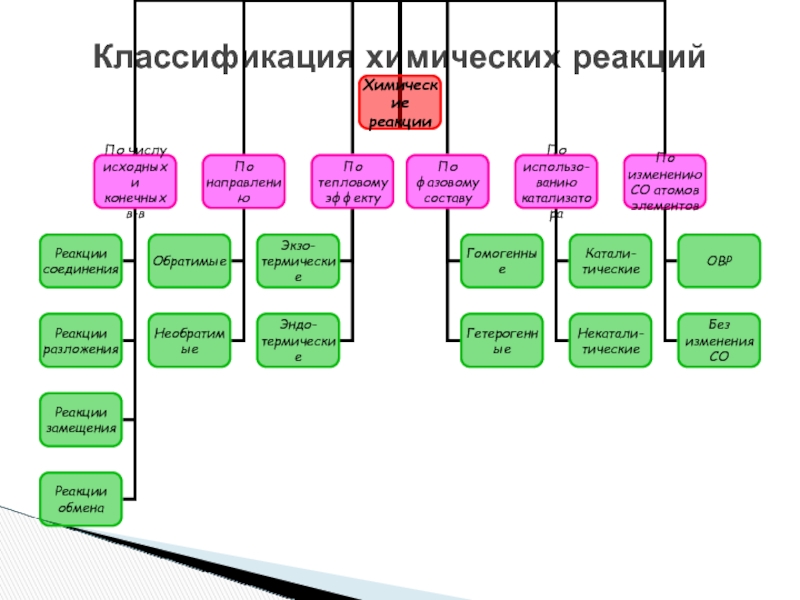
- 3. Классификация химических реакций
- 4. Дать характеристику реакциям по всем известным признакам
- 5. Определить СО элементов в веществах:
- 6. Цель проекта «Семь
- 7. «Семь чудес России»
- 8. «Семь чудес России»
- 9. «Семь чудес России»
- 10. +18 Ar )
- 11. Классификация химических реакций
- 12. ОВР – это такие реакции, при которых
- 13. Какие из приведенных схем
- 14. Вывод: Окислительно-восстановительные процессы
- 15. Спасибо за внимание!
- 16. Скачать презентанцию
Чтобы что-то узнать, Нужно уже, что-то знать.
Слайды и текст этой презентации
Слайд 4Дать характеристику реакциям по всем известным признакам классификации
t,MnO2
2КClO3(т) →2KCl(т) + 3O2(г)↑- Q
NO(г) +
O2(г) ⇄ NO2(г) + QC(т) + CO2(г) ⇄ 2CO(г) - Q
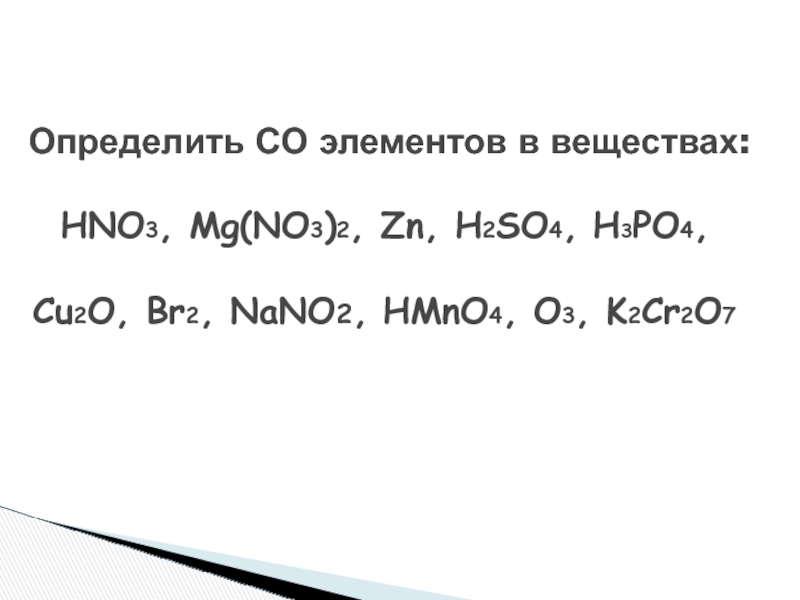
Слайд 5 Определить СО элементов в веществах:
HNO3, Mg(NO3)2, Zn, H2SO4,
H3PO4, Cu2O, Br2, NaNO2, HMnO4, O3, K2Cr2O7Слайд 6
Цель проекта «Семь чудес России» –
возрождение чувства патриотизма и любви к своему Отечеству, а
также привлечение внимания к восстановлению и сохранению исторических, культурных и природных объектов на территории нашей Родины. Федеральный общероссийский проект
Слайд 10 +18 Ar ) ) )
Ar0
2 8 8+20 Ca0 ) ) ) ) Ca2+ ) ) ) Ca0 - 2 ē → Ca 2+
2 8 8 2 2 8 8
атом ион
+16 S0 ) ) ) S2- ) ) ) S0 + 2ē → S2-
2 8 6 2 8 8
атом ион
Ca0 + S0 → Ca+2S-2
Окислительно-восстановительные реакции
Слайд 12ОВР – это такие реакции, при которых происходит изменение СО.
Окисление
– это процесс отдачи электронов, степень окисления при этом повышается.
Восстановление
– это процесс присоединения электронов, степень окисления при этом понижается.Атомы, молекулы или ионы, отдающие электроны, являются восстановителями.
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями.
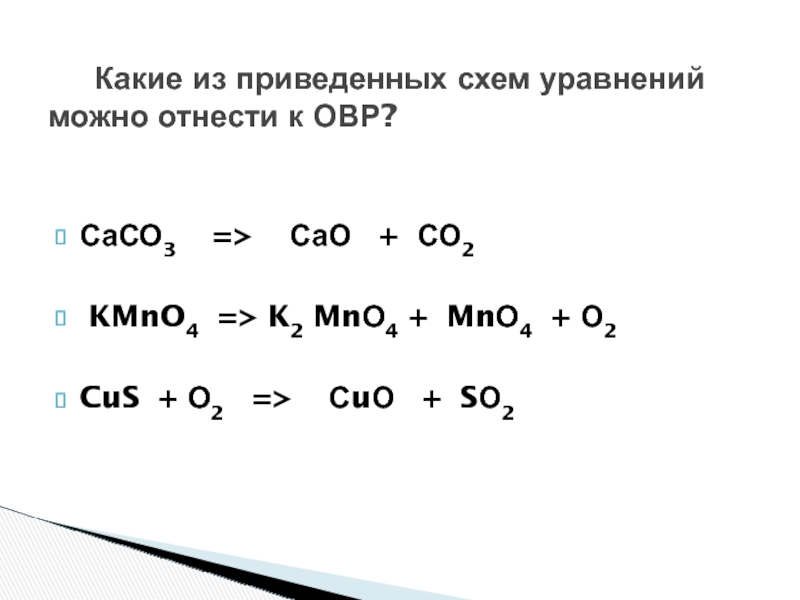
Слайд 13 Какие из приведенных схем уравнений можно отнести
к ОВР?
СаСО3 => СаО + СО2
KMnO4
=> K2 MnО4 + MnО4 + О2CuS + О2 => СuО + SО2