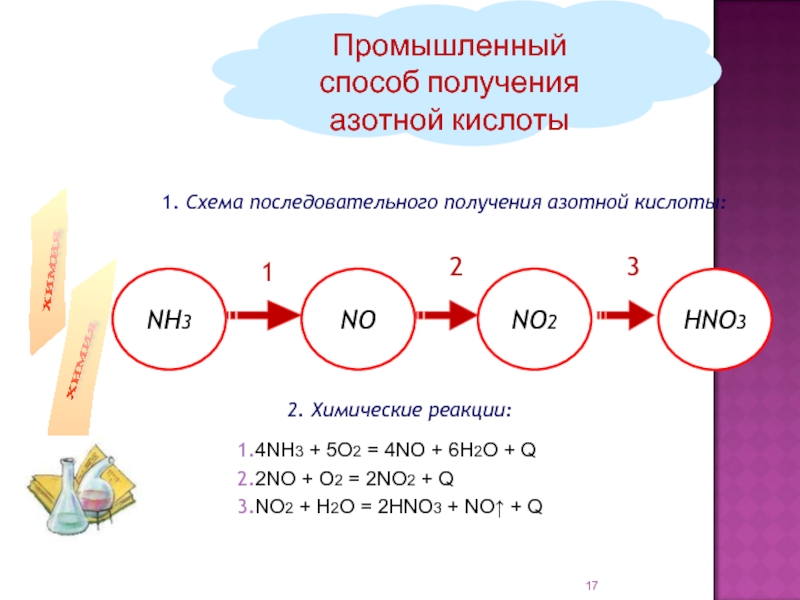
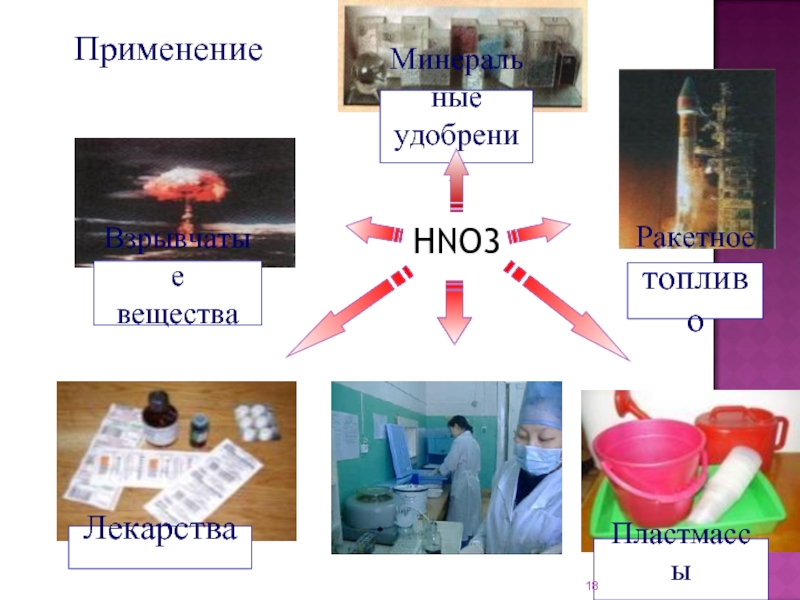
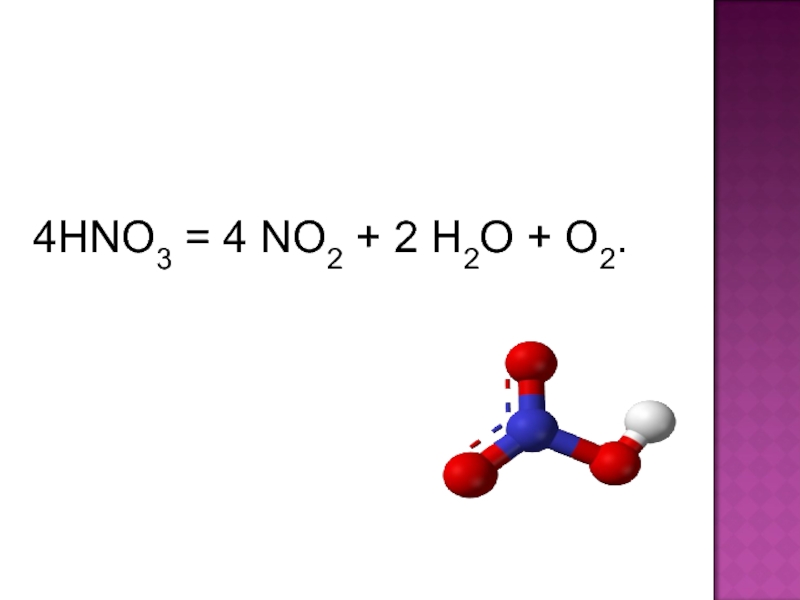соединение элемента с порядковым номером 7.
Это «дымящая» с резким раздражающим
запахом жидкость.Это вещество – враг металлов.
Это «царица» всех …
Угадай – те, тему урока!
?
№7