Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
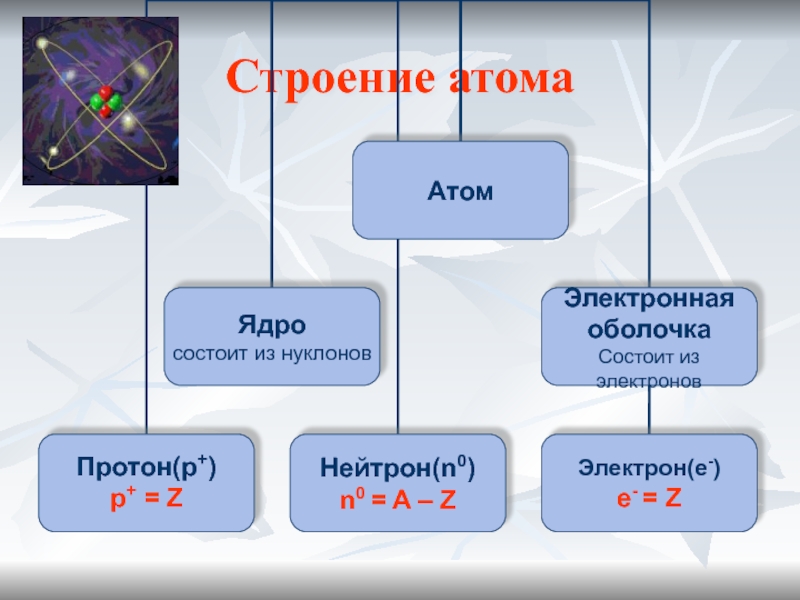
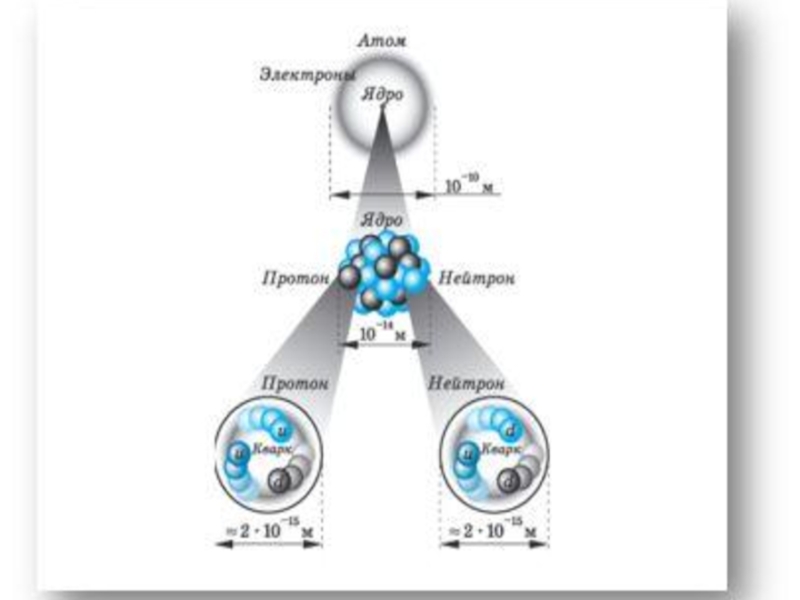
Строение атома
Содержание
- 1. Строение атома
- 2. Основные положения атомно-молекулярного учения Вещества состоят
- 3. Атомы-это химические частицы, являющиеся пределом химического разложения любого вещества. Рис. 2Рис.1
- 4. Слайд 4
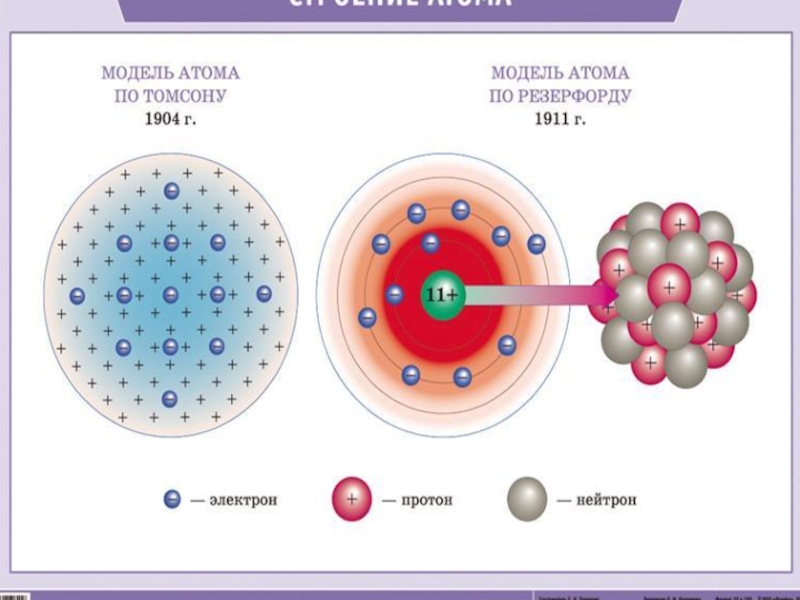
- 5. Строение атома
- 6. Слайд 6
- 7. Планетарная модель атомаАтом –это микрочастица, которая имеет
- 8. Изотопысостав изотопов хлора:35Сl и37Сl1735Сl(17p++18n0) 17е- А=351737Сl(17p++20n0) 17е-
- 9. Слайд 9
- 10. Слайд 10
- 11. Для описания положения электронов в атоме используют
- 12. Строение электронной оболочки атомаАтомная орбиталь - состояние
- 13. Порядок заполнения электронами орбиталей атома определяется тремя
- 14. Распределение подуровней по энергиям выражается рядом (в
- 15. 1.ВЕЩЕСТВО СОСТОИТ ИЗ ОГРОМНОГО КОЛИЧЕСТВА ЧАСТИЦ(АТОМОВ И
- 16. 1.ВЕЩЕСТВА СОСТОЯТ ИЗ АТОМОВ, ИОНОВ, МОЛЕКУЛ И
- 17. Список литературы1) О. С. Габриелян и др.
- 18. Скачать презентанцию
Основные положения атомно-молекулярного учения Вещества состоят из молекул, а молекулы из атомов.Молекула –мельчайшая частица вещества, сохраняющая состав и свойства данного вещества, физически неделимая.Атом - мельчайшая частица вещества, химически неделимая.При физических
Слайды и текст этой презентации
Слайд 1Строение атома
Подготовила
Масленникова Е.В., преподаватель химии и биологии, Белгородский строительный
колледж
Слайд 2Основные положения атомно-молекулярного учения
Вещества состоят из молекул, а молекулы
из атомов.
Молекула –мельчайшая частица вещества, сохраняющая состав и свойства данного
вещества, физически неделимая.Атом - мельчайшая частица вещества, химически неделимая.
При физических явлениях состав веществ не изменяется, при химических явлениях- изменяется, из одних веществ получаются другие.
Молекулы и атомы находятся в постоянном, хаотическом движении.
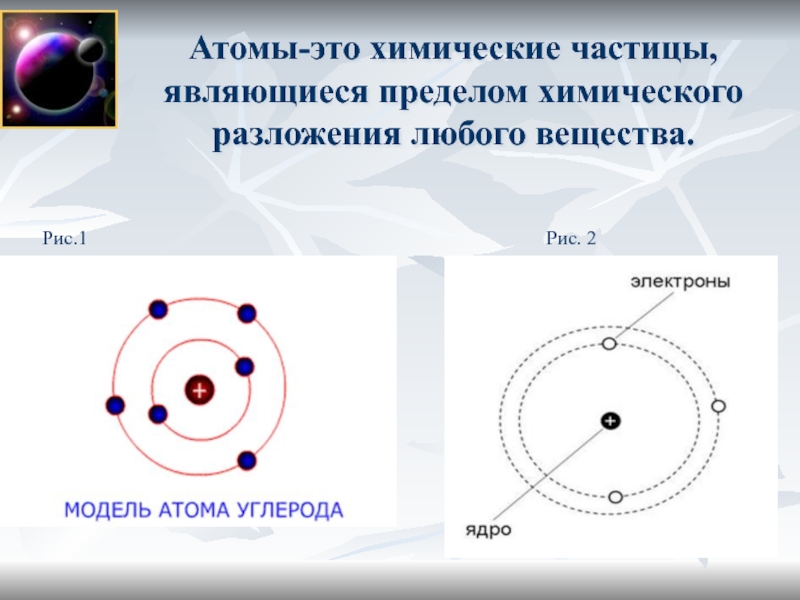
Слайд 3Атомы-это химические частицы, являющиеся пределом химического разложения любого вещества.
Рис.
2
Рис.1
Слайд 7Планетарная модель атома
Атом –это микрочастица, которая имеет форму шара.
Атом –сложная
система, состоящая из ядра и электронов.
Ядро находится в центре атома
и имеет очень маленький размер, но почти вся масса атома сосредоточена в ядре.Ядро имеет положительный заряд, величина которого определяется числом протонов в нем.
Электроны движутся вокруг ядра, имеют ничтожно малую массу и размеры, обладают отрицательным зарядом.
Атом –нейтральная частица, поэтому число протонов и электронов в атоме одинаково.
Порядковый номер элемента показывает: положение элемента в периодической системе, количество протонов и электронов.
Слайд 8Изотопы
состав изотопов хлора:35Сl и37Сl
1735Сl(17p++18n0) 17е- А=35
1737Сl(17p++20n0) 17е- А=37
Атомы изотопов
одного элемента имеют одинаковое число протонов и электронов, но разное
число нейтронов.Химический элемент- это совокупность атомов с одинаковым зарядом ядра.
Слайд 11Для описания положения электронов в атоме используют 4 квантовых числа:
Главное
квантовое число n определяет уровень энергии, которому отвечает данная орбита,
и ее удаленность от ядра.2) Орбитальное, побочное или азимутальное квантовое число l характеризует момент количества движения электрона относительно центра орбиты.
3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве.
4) Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения: 1/2 и -1/2.
Слайд 12Строение электронной оболочки атома
Атомная орбиталь - состояние электрона в атоме.
Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном)
состоянии бывают четырех типов: s, p, d и f.Электронное облако - часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Слайд 13Порядок заполнения электронами орбиталей атома определяется тремя законами природы:
1. Принцип
наименьшей энергии - электроны заполняют орбитали в порядке возрастания энергии
орбиталей.2. Принцип Паули - на одной орбитали не может быть больше двух электронов.
3. Правило Хунда - в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Слайд 14Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s,
2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p,
6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p ...Наглядно эта последовательность выражается энергетической диаграммой:
Слайд 151.ВЕЩЕСТВО СОСТОИТ ИЗ ОГРОМНОГО КОЛИЧЕСТВА ЧАСТИЦ(АТОМОВ И МОЛЕКУЛ), МЕЖДУ КОТОРЫМИ
ЕСТЬ ПРОМЕЖУТКИ; 2.МОЛЕКУЛА ВЕЩЕСТВА СОСТОИТ ИЗ АТОМОВ ОДНОГО ИЛИ НЕСКОЛЬКИХ
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ; 3.АТОМЫ ОДНОГО ХИМИЧЕСКОГО ЭЛЕМЕНТА ОДИНАКОВЫ, МОЛЕКУЛЫ ОДНОГО ВЕЩЕСТВА ОДИНАКОВЫ; 4.ПРИ УВЕЛИЧЕНИИ ТЕМПЕРАТУРЫ ТЕЛА ПРОМЕЖУТКИ МЕЖДУ ЧАСТИЦАМИ УВЕЛИЧИВАЮТСЯ; 5.МОЛЕКУЛЫ И АТОМЫ ИМЕЮТ ОЧЕНЬ МАЛЕНЬКИЕ РАЗМЕРЫ, ИХ МОЖНО СФОТОГРАФИРОВАТЬ С ПОМОЩЬЮ ЭЛЕКТРОННОГО МИКРОСКОПА;Запомни:
Слайд 161.ВЕЩЕСТВА СОСТОЯТ ИЗ АТОМОВ, ИОНОВ, МОЛЕКУЛ И КРИСТАЛЛОВ; 2.АТОМЫ ИМЕЮТ СЛОЖНОЕ
СТРОЕНИЕ, ОПРЕДЕЛЕННЫЙ ВИД АТОМОВ НАЗЫВАЮТ ХИМИЧЕСКИМ ЭЛЕМЕНТАМ; 3.ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ ОТЛИЧАЮТСЯ ПО
ФИЗИЧЕСКИМ И ХИМИЧЕСКИ М СВОЙСТВАМ; 4. АТОМЫ, ВЗАИМОДЕЙСТВУЯ ДРУГ С ДРУГОМ, ОБРАЗУЮТ СОЕДИНЕНИЯ- ПРОСТЫЕ И СЛОЖНЫЕ ВЕЩЕСТВА; 5. ЧАСТИЦЫ ВЕЩЕСТВА НАХОДЯТСЯ А НЕПРЕРЫВНОМ ХАОТИЧЕСКОМ ДВИЖЕНИИ И, В ЗАВИСИМОСТИ ОТ ЭНЕРГИИ, МОГУТ ПРИДАВАТЬ ВЕЩЕСТВУ ТО ИЛИ ИНОЕ АГРЕГАТНОЕ СОСТОЯНИЕ; 6. ВЕЩЕСТВА ОТЛИЧАЮТСЯ ДРУГ ОТ ДРУГА ПО ФИЗИЧЕСКИМ И ХИМИЧЕСКИМ СВОЙСТВАМ.Выводы:
Слайд 17Список литературы
1) О. С. Габриелян и др. Химия 11 кл.
М., Дрофа, 2002;
2) Г. Е. Рудзитис, Ф. Г. Фельдман. Химия
11 кл. М., Просвещение, 2001;3) Рыбальченко В. С. Химия (начальный курс). Часть 1: Учебное пособие. - 4-е изд. - М.: РГУ нефти и газа им И.М. Губкина, 2003;
4) Большая Советская Энциклопедия;
5) Иванова Р. Г., Каверина А. А., Корощенко А. С. Уроки химии. 10-11 классы. -М.: Просвещение, 2000;
6) Чежина Н. В. Общая и неорганическая химия. Конспект курса лекций. -СПб.: Питер, 2001.