Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Мониторинг неблагоприятных проявлений после иммунизации в соответствии с современными нормативными требованиями
Содержание
- 1. Мониторинг неблагоприятных проявлений после иммунизации в соответствии с современными нормативными требованиями
- 2. Нормативная база осуществления мониторинга за НППИ в
- 3. Осуществление мониторинга за НППИ возложено МЗ на
- 4. Принцип осуществления мониторинга за НППИДепартамент медицинских иммунобиологических
- 5. Для чего необходимо проводить мониторинг за НППИ
- 6. Основные методы получения информации о безопасности вакцин
- 7. Изменения в репортировании про НППИ, согласно современным
- 8. Специализированная экспертная оценка отчетов по безопасности МИБПВ
- 9. Для чего необходимо проводить экспертную оценку отчетов
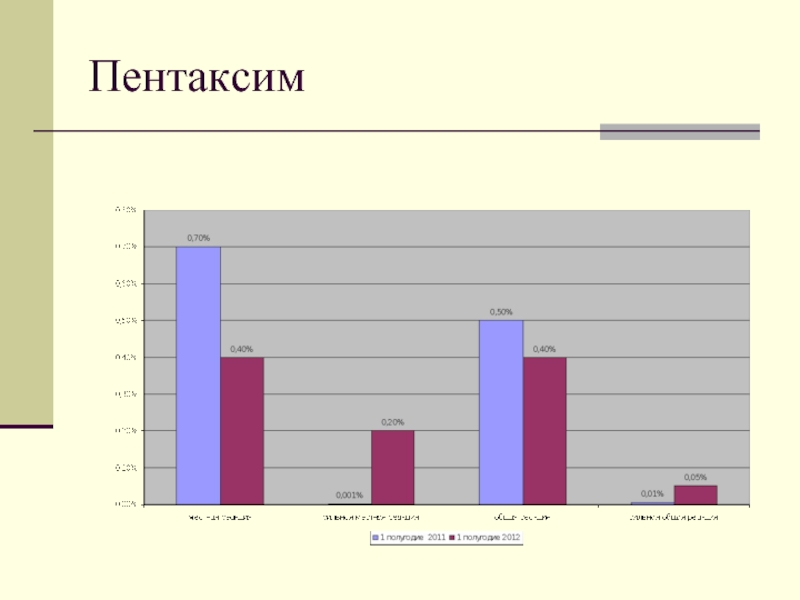
- 10. Пентаксим
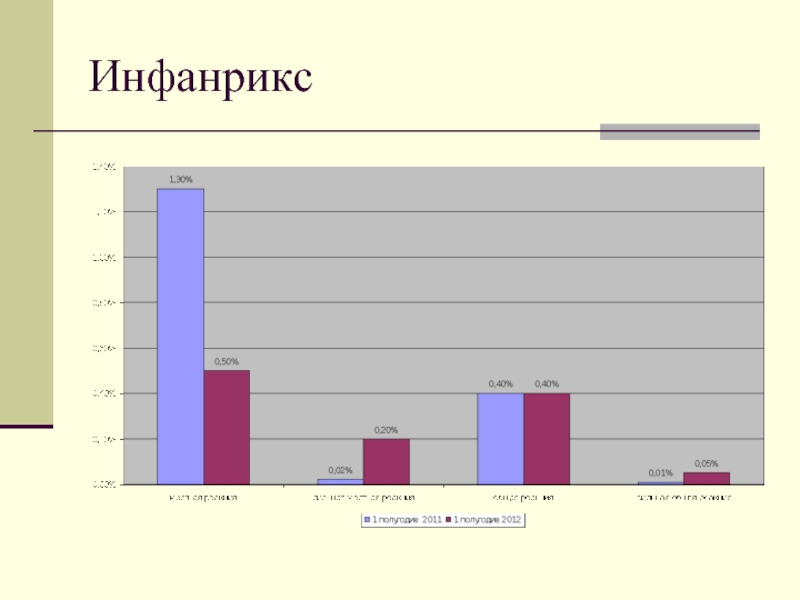
- 11. Инфанрикс
- 12. КПК
- 13. Гепатит В
- 14. Что необходимо для улучшения пострегистрационного надзора за
- 15. Благодарю за внимание!
- 16. Скачать презентанцию
Нормативная база осуществления мониторинга за НППИ в УкраинеЗакон Украины «О лекарственных средствах» 1996 г. (с изменениями и дополнениями)Закон Украины «Про защиту населения от инфекционных болезней» 2000 г. (с изменениями и
Слайды и текст этой презентации
Слайд 1Мониторинг неблагоприятных проявлений после иммунизации в соответствии с современными нормативными
требованиями
Слайд 2Нормативная база осуществления мониторинга за НППИ в Украине
Закон Украины «О
лекарственных средствах» 1996 г. (с изменениями и дополнениями)
Закон Украины «Про
защиту населения от инфекционных болезней» 2000 г. (с изменениями и дополнениями) Закон Украины «Про обеспечение санитарного и эпидемиологического благополучия населения» 1994 г. (с изменениями и дополнениями)
Приказы МЗ Украины:
- 16.09.2011 №595 «Про порядок проведения профилактических прививок в Украине и контроль качества оборота медицинских иммунобиологических препаратов »;
- 27.12.2006 №898 «Об утверждении порядка осуществления надзора за побочными реакциями ЛС, разрешенных к медицинскому применению в Украине» с изменениями, внесенными приказом МЗ от 29.12.2011 г. №1005
Слайд 3Осуществление мониторинга за НППИ возложено МЗ на Департамент медицинских иммунобиологических
препаратов и иммунопрофилактики в структуре ГП «Государственный экспертный центр МЗ
Украины»Кем осуществляется мониторинг за НППИ
Слайд 4Принцип осуществления мониторинга за НППИ
Департамент медицинских иммунобиологических препаратов и иммунопрофилактики
при ГП «Государственный экспертный центр МЗ Украины» получает информацию про
случаи побочных реакций:- от территориальных СЭС (все случаи подозрения на осложнение или групповую реакцию без госпитализации);
- руководителя ЛПУ(все случаи подозрения на осложнение или поствакцинальную реакцию с госпитализацией или летальным исходом)
Приказ МЗ Украины №595 от 16.09.2011 г.
от заявителей,
специалистов с медицинским и/или фармацевтическим образованием всех учреждений здравоохранения, не зависимо от форм собственности;
планируется от пациентов (интерактивная форма в стадии разработки для МИБП)
Приказ МЗ Украины №898 от 16.09.2006 г. с изменениями внесенными приказом от 29.12.2011 г №1005
Слайд 5Для чего необходимо проводить мониторинг за НППИ при применении вакцин?
Выявить
редко встречающиеся реакции в том числе серьезные
Следить за увеличением частоты
известных реакцийОпределить факторы риска развития ПР и разработать мероприятия, направленные на их предупреждение
Выявить серии, которые увеличивают частоту развития реакций
Выявить «сигналы» - регистрацию неблагоприятных проявлений с частотой, выше ожидаемой
Слайд 6Основные методы получения информации о безопасности вакцин в пострегистрационный период
Оперативно
-
от специалистов с медицинским образованием всех учреждений здравоохранения, независимо
от форм собственности (приказ МЗ №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005);- от руководителей ЛПУ стационаров (приказ МЗ Украины №595 от 16.09.2011 г. )
от территориальных СЭС (приказ МЗ Украины №595 от 16.09.2011 г. )
Ретроспективно
от территориальных СЭС 2 раза в год (приказ МЗ Украины №595 от 16.09.2011 г. )
от заявителей (приказ МЗ №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005)
Слайд 7Изменения в репортировании про НППИ, согласно современным требованиям
Заявитель информирует в
виде очередных отчетов по безопасности (PSUR) о всех случаях, выявленных
ПР (в том числе серьезных) в других странах, где использовался препарат (приказ МЗ Украины №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005);Заполняется более детальная форма отчетности о зарегистрированных НППИ (реакции и осложнения) за полгода и год, где учитывается количество клинических проявлений ПР (Приказ МЗ Украины №595 от 16.09.2011 г.);
Электронный адрес сайта, на котором размещается официальная информация о зарегистрированных реакциях/осложнениях за отчетный период при использовании вакцин, анатоксинов и аллергена туберкулезного dec.gov.ua (в рубрике «регистрация и контроль иммунобиологических препаратов»)
Слайд 8Специализированная экспертная оценка отчетов по безопасности МИБП
В 2012 году получено
27 очередных отчетов по безопасности (PSUR) от 8 заявителей, из
них на вакцины – 24 отчета;При перерегистрации проанализировано 29 обобщенных отчетов по безопасности (PSUR) МИБП, из них на вакцины – 9 отчетов;
Слайд 9Для чего необходимо проводить экспертную оценку отчетов по безопасности (PSUR)
на МИБП?
Обобщить все новые данные по безопасности вакцин, полученные из
различных источников;Обобщить опыт применения вакцин в разных странах;
В случае необходимости является основанием для внесения изменений и дополнений в инструкцию по применению препарата
Слайд 14Что необходимо для улучшения пострегистрационного надзора за НППИ?
1. Урегулирование вопроса
по установлению запрета на использование серии или серий вакцин, а
так же сроков снятия их с карантина, что требует немедленного внесения изменений в нормативную базу.2. Стандартизация всех случаев ПР в соответствии с международной терминологией и их утверждение соответствующим приказом МЗ Украины;
3. Налаживание системы репортирования про все случаи НППИ:
- от всех заявителей/представителей (ф.137/о, утвержденная приказом МЗ Украины №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005);
- от специалистов с медицинским образованием всех учреждений здравоохранения, не зависимо от форм собственности (ф.137/о, утвержденная приказом МЗ Украины №898 от 16.09.2011 г. с изменениями, внесенными приказом от 29.12.2011 г. №1005);
- пациентов (интерактивная карта-сообщения);
4. Требования к правильности заполнения граф оперативного сообщения про НППИ в случае госпитализации привитого в поствакцинальном периоде (приказ МЗ Украины №595 от 16.09.2011 г. );
5. Усовершенствование электронной базы данных НППИ, случаи госпитализации, карт- сообщений на все серьезные ПР, несерьезные ожидаемые ПР по Украине, серьезные неожидаемые по странам, где используется вакцина;
Теги