Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 1 КУРС! Внимание! Материалы для подготовки к лекциям и занятиям находятся на
Содержание
- 1. 1 1 КУРС! Внимание! Материалы для подготовки к лекциям и занятиям находятся на
- 2. ОБЯЗАТЕЛЬНО!!!Закон, который нельзя нарушать:«Конспекты готовим накануне лекции,
- 3. «Термодинамика химических процессов."Кафедра общей и медицинской химии
- 4. Граф структуры
- 5. Термодинамика изучает: соотношение между тепловой и другими
- 6. Системы в термодинамике:Открытые – обмен веществом и
- 7. 3. Гомогенные – нет раздела границы фаз4. Гетерогенные– граница раздела фаз присутствует
- 8. 5. Равновесные – не происходит видимых изменений6.
- 9. I закон термодинамики:Если к закрытой системе подводить
- 10. 3. При постоянной температуре и давлении самопроизвольно
- 11. 2. Абсолютный нуль недостижим ( так называемая
- 12. Слайд 12
- 13. Теплота – количественная мера хаотического движения молекул в данной системе.Мерой интенсивности движения молекул является температура.
- 14. Работа – количественная мера направленного движения молекул в одностороннем направлении.
- 15. Связь теплоты и внутренней энергии.Энтальпия.ЭНТАЛЬПИЯH = U + pV+ Q = - ΔH
- 16. При изобарно-изотермическом процессе ∆Н характеризует полное изменение
- 17. При изохорном процессе все подводимое тепло расходуется на увеличение внутренней энергии системы.
- 18. I закон термодинамики:Если к закрытой системе подводить
- 19. Открыл (1840) основной закон
- 20. Закон Гесса Тепловой эффект реакции зависит
- 21. Следствия из закона Гесса:1. Тепловой эффект реакции
- 22. Схема цикла, иллюстрирующего применение закона Гесса для вычисления энтальпии образования этана С2Н6.
- 23. 2. Тепловой эффект реакции при стандартных условиях
- 24. Помним, что стандартная теплота
- 25. Первый закон термодинамики позволяет рассчитать энергетический баланс химического процесса.
- 26. Пример 2Рассчитайте тепловой эффект реакции C6H6 + 7.5O2=6CO2(г)+3H2O(ж), по стандартным теплотам сгоранияРешение:
- 27. Теплота нейтрализацииИзменение энергии в экзотермической реакции нейтрализации
- 28. Механизм растворения кристаллов.Гидратация: молекулы воды окружают частицы
- 29. Растворение кристалла NaCl в воде:ΔНкрист. -
- 30. Для прогнозирования возможности и направления процессов необходимо
- 31. Немецкий физик. Главные работы Клаузиуса посвящены основам
- 32. Энтропия - S 1.Физический смысл
- 33. Число вероятных состояний w В прямоугольной коробке
- 34. Чем большим числом микрочастиц представлена
- 35. Без постороннего вмешательства невозможен ни один процесс, результатом которого является повышение порядка, то есть уменьшение энтропии!
- 36. Окончил Венский университет в
- 37. Понятие об энтропии как
- 38. Примером может служить медленное
- 39. Энтропия газообразного вещества больше,
- 40. При абсолютном нуле (- 273.130С) S=0, что
- 41. ЗадачаОпределить энтропию образования этанола из элементов (пользуясь
- 42. Критерии самопроизвольного протекания процесса Энтальпийный фактор
- 43. T∆S – характеризует ту часть энергии, которую
- 44. Функцией, учитывающей оба фактора и противоположность в
- 45. Факторы, определяющие ходизобарно- изотермического процесса( Р и Т – постоянны)(помним, что +Q = - ∆H)
- 46. Свободная энергия Гиббса (разность между энтальпийным и
- 47. 3. При постоянной температуре и давлении самопроизвольно
- 48. Так как энергия Гиббса
- 49. Слайд 49
- 50. Для процессов, протекающих в изохорно –изотермических условиях,
- 51. 1 – самопроизвольный процесс;2 – несамопроизвольный процесс;3
- 52. Немецкий физик, математик, физиолог и психолог.
- 53. КПД при переходе тепла в работу всегда
- 54. Поскольку при абсолютном нуле поступательное, вращательное
- 55. 3. Абсолютный нуль недостижим ( так называемая
- 56. Температуравокруг нас
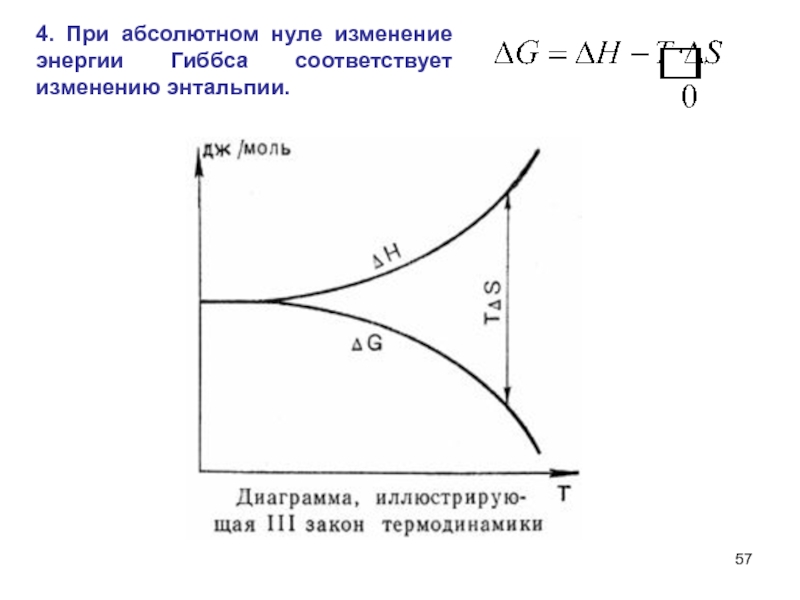
- 57. 4. При абсолютном нуле изменение энергии Гиббса соответствует изменению энтальпии.
- 58. Гилберт Льюис – 23.10.1875
- 59. 1. Большинство биохимических реакций в организме
- 60. 3. Живые организмы поддерживают присущую им упорядоченность
- 61. Принцип ПригожинаВ открытой системе в стационарном состоянии
- 62. 4. Реализация принципа энергетического сопряжения: Эндэргонические реакции (∆G>0 –процесс самопроизвольно не идет!!!) сопряжены с экзэргоническими (∆G
- 63. Термодинамические особенности открытых систем для живого организма
- 64. В основе гомеостаза организма находятся следующие химические и физико-химические балансы: Кислотно-основной Окислительно-восстановительный Металло-лигандный Гидрофильно-липофильный Водно-электролитный
- 65. Человеческий организм, является открытой,
- 66. Главными компонентами пищи являются: углеводы, жиры, белки
- 67. Углеводы – CnH2nOn(сахар, хлеб, крупы, макаронные изделия)
- 68. Белки - основной строительный материал клеток (рыба,
- 69. Жиры - сложные эфиры глицерина и жирных
- 70. Запас жира позволяет представителям животного мира некоторое
- 71. Слайд 71
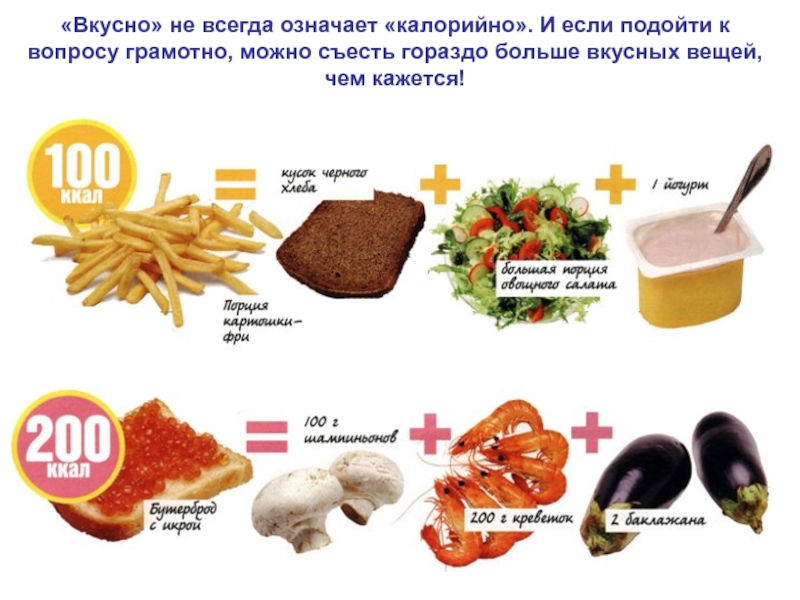
- 72. «Вкусно» не всегда означает «калорийно». И если
- 73. Слайд 73
- 74. Аналогичный подход относится к витаминам
- 75. В основе научной диетологии лежит согласование режима
- 76. Суточная потребность человека в энергии
- 77. 2) при умеренной и напряженной мышечной работе:
- 78. 3) при тяжелом физическом труде: литейщики,
- 79. 4) при особо тяжелом труде - ручная
- 80. Спасибо за внимание!
- 81. Скачать презентанцию
Слайды и текст этой презентации
Слайд 11 КУРС!
Внимание!
Материалы для подготовки
к лекциям и занятиям находятся
на
сайте кафедры :
gpma→структура→кафедры→
Слайд 2ОБЯЗАТЕЛЬНО!!!
Закон, который нельзя нарушать:
«Конспекты готовим накануне лекции, дома!!!
На лекциях идет
обсуждение материала и делаются пометки в готовые конспекты!!»
Слайд 5Термодинамика изучает:
соотношение между тепловой и другими формами энергии
в химических реакциях;
возможность самопроизвольного протекания реакций в данных
условиях; условия, при которых химические реакции находятся в состоянии равновесия.
Термодинамика-
наука о превращении одних веществ в другие
Слайд 6Системы в термодинамике:
Открытые – обмен веществом и энергией
2. Закрытые (замкнутые)
– обмен только энергией
3. Изолированные – нет обмена ни веществом,
ни энергиейСлайд 8
5. Равновесные – не происходит
видимых изменений
6. Стационарные – видимых
изменений нет, но есть обмен веществом и энергией
Слайд 9I закон термодинамики:
Если к закрытой системе подводить тепло, энергия будет
расходоваться на увеличение внутренней энергии и совершение работы (невозможно полностью
подводимое тепло перевести в работу):2. Тепло, которым обмениваются система и окружающая среда, равно сумме изменения внутренней энергии системы и совершенной работы
3. В изолированной системе ∆U = 0;
4. Энергия не исчезает и не возникает из ничего, а только превращается из одной формы в другую в строго эквивалентных количествах
( вечный двигатель создать невозможно!!! )
Слайд 103. При постоянной температуре и давлении самопроизвольно протекают только те
процессы, для которых ΔG < 0;
II закон термодинамики
4. Критерием равновесия
самопроизвольного процесса является ΔG = 0
Изменение энергии Гиббса химической системы при протекании в ней химической реакции
2. Теплота не может сама собою перейти от более холодного тела к более теплому.
1. В изолированных системах самопроизвольно протекают только процессы, не сопровождающиеся уменьшением энтропии
Слайд 112. Абсолютный нуль недостижим
( так называемая «смерть Вселенной»)
1. Энтропия
идеального кристалла при абсолютном нуле равна нулю.
III закон термодинамики:
Слайд 12
Внутренняя энергия
– это такая энергия тела, за счет которой может совершаться механическая работа, не вызывая при этом убыли механической энергии этого тела.
Она объединяет все виды энергии тела, за исключением энергии его движения как целого
Наиболее легко на нужды человека может быть использована внутренняя энергия лишь, образно говоря, "горячих" и "горючих" веществ и тел. Это нефть, уголь, вулканические воды. В XX веке человек научился использовать и внутреннюю энергию так называемых радиоактивных элементов.
Слайд 13
Теплота – количественная мера
хаотического движения молекул в данной системе.
Мерой
интенсивности движения молекул является температура.
Слайд 16При изобарно-изотермическом процессе ∆Н характеризует полное изменение энергии системы и
отражает стремление системы к минимуму
При изобарном процессе подводимое тепло расходуется
на увеличение внутренней энергии системы и на совершение работыСлайд 17При изохорном процессе все подводимое тепло расходуется на увеличение внутренней
энергии системы.
Слайд 18I закон термодинамики:
Если к закрытой системе подводить тепло, энергия будет
расходоваться на увеличение внутренней энергии и совершение работы:
В изолированной системе
∆U = 0;Энергия не исчезает и не возникает из ничего, а только превращается из одной формы в другую в строго эквивалентных количествах
( вечный двигатель создать невозможно!!! )
Следствием I закона термодинамики является закон Гесса
Слайд 19 Открыл (1840) основной закон термохимии. Установил катализирующее
и адсорбционное свойства мелкораздробленной платины. Одним из первых изучил состав
кавказской нефти.ГЕСС Герман Иванович
(7.8.1802-12.12 1850)
Закон Гесса
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ, а не от числа стадий процесса.
Слайд 20Закон Гесса
Тепловой эффект реакции зависит только от ……….
Термодинамическая
функция состояния
— функция, зависящая от нескольких независимых параметров, которые определяют
состояние термодинамической системы. Значение термодинамической функции состояния зависит только от состояния термодинамической системы и не зависит от того, как система пришла в это состояние. К термодинамическим функциям состояния относятся:
1. Внутренняя энергия - U
2. Энтальпия - H
3. Энтропия - S
4. Свободная энергия Гиббса - G
Слайд 21Следствия из закона Гесса:
1. Тепловой эффект реакции при стандартных условиях
равен разности между суммой теплот образования продуктов реакции и суммой
теплот образования исходных веществ, умноженных на соответствующие коэффициенты в реакцииТеплота образования химического соединения – это тепловой эффект реакции образования 1 моль химического соединения из чистых простых веществ, находящихся в равновесном состоянии при стандартных условиях.
Стандартные условия – это давление 101.325 кПа (1 атм) и
фиксированная температура (обычно – 2980 К)
Слайд 22Схема цикла, иллюстрирующего применение закона Гесса для вычисления энтальпии образования
этана С2Н6.
Слайд 232. Тепловой эффект реакции при стандартных условиях равен разности между
суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов
реакции, умноженных на соответствующие стехиометрические коэффициенты: Подавляющее большинство органических соединений нельзя синтезировать непосредственно из простых веществ и одновременно определить теплоту образования этих соединений.
Поэтому за основу для расчета берут экспериментально легко определяемые теплоты (энтальпии) сгорания.
Слайд 24 Помним, что стандартная теплота образования простых веществ
равна нулю!
Стандартная теплота сгорания оксидов также равна нулю!
Слайд 26Пример 2
Рассчитайте тепловой эффект реакции
C6H6 + 7.5O2=6CO2(г)+3H2O(ж),
по стандартным теплотам сгорания
Решение:
Слайд 28Механизм растворения кристаллов.
Гидратация:
молекулы воды окружают частицы растворенного вещества, образуя
гидраты. Процесс экзотермический.
ΔН гидр.<0.Молекул воды разрушают кристаллическую решетку хлорида натрия.
Процесс-эндотермический,
ΔН крист.>0.
Слайд 29Растворение кристалла NaCl в воде:
ΔНкрист. - изменение энтальпии при
разрушении кристаллической решетки;
ΔНсольв. – изменение энтальпии за счет гидратации
ионов Сl- и Na+;Слайд 30Для прогнозирования возможности и направления процессов необходимо ввести еще одну
функцию, которая должна отвечать двум требованиям:
быть функцией состояния
(не зависеть от пути реализации) для всех самопроизвольных процессов изменение этой функции должно иметь один и тот же знак.
Возможность самопроизвольного протекания реакций
Бертло и Томсон, сформулировали принцип, согласно которому
самопроизвольно протекает экзотермическая реакция (∆Н < 0).
Однако, процесс растворения поваренной соли в воде происходит самопроизвольно и с поглощением тепла.
Слайд 31Немецкий физик. Главные работы Клаузиуса посвящены основам термодинамики и кинетической
теории газов.
1850 году получил соотношение между теплотой и
работой (первое начало термодинамики).В том же году (одновременно с У.Томсоном) дал первую формулировку второго начала термодинамики: «Теплота не может сама собою перейти от более холодного тела к более теплому».
В 1865 ввел понятие энтропии, показав, что изменение энтропии определяет направление, в котором протекает данный процесс.
Высказал идею «тепловой смерти» Вселенной, распространив на нее принцип возрастания энтропии. Ошибочность этой идеи доказал впоследствии Л.Больцман
Ввел понятие средней длины свободного пробега молекул, вычислил ее величину, что в дальнейшем позволило оценить размер молекул.
Энтропия – S
Энтропи́я (от древнегреческого ἐντροπία — поворот, превращение) —мера беспорядка системы, состоящей из многих элементов.
Понятие энтропии впервые было введено Клаузиусом
в термодинамике в 1865 году
КЛАУЗИУС, РУДОЛЬФ
ЮЛИУС ЭМАНУЭЛЬ
(1822–1888).
Слайд 32Энтропия - S
1.Физический смысл
Рассмотрим
термос с двумя слоями жидкости «сироп - газированная вода». Через
некоторое время в термосе получится однородный по цвету и составу коктейль.Поскольку система изолированная, ΔН=0 и ΔU=0.
Вместе с тем, очевидно, что ее состояние изменилось – произошло перераспределение компонентов внутри системы.
Это изменение как раз и характеризуется увеличением энтропии: ΔS>0.
Слайд 33Число вероятных состояний w
В прямоугольной коробке с восемью
углублениями имеется четыре шарика, которые при встряхивании могут переходить из
одних углублений в другие. Всего имеется 70 различных расположений шариков. Шанс всем четырем шарикам собраться в начальном положении составляет 1/70 или 0,014.
В молекулярных системах число возможных расположений молекул огромно и быстро возрастает с увеличением количества вещества и размеров системы.
2. Молекулярно-кинетический смысл
Слайд 34 Чем большим числом микрочастиц представлена рассматриваемая макросистема, тем
больше вариантов распределения этих частиц, тем выше значение энтропии.
Энтропия (S)
естьмера вероятности пребывания системы
в данном состоянии или мера неупорядоченности системы!
Слайд 35Без постороннего вмешательства невозможен ни один процесс, результатом которого является
повышение порядка, то есть уменьшение энтропии!
Слайд 36 Окончил Венский университет в 1867 г.
Занимал профессорские должности в университетах Вены, Граца, Мюнхена и
Лейпцига. В 1870 году вывел знаменитое выражение для энтропии (меры беспорядка) термодинамической системы через логарифм числа возможных состоянийR – универсальная газовая постоянная (8,314 Дж/(моль·К)
Na – постоянная Авогадро (6,02·1023)
ω - число вероятных состояний системы
Уравнение Больцмана
( связь энтропии с числом вероятных состояний )
Слайд 37 Понятие об энтропии как термодинамической функции состояния
для обратимых процессов было выведено Р.Клаузиусом:
В обратимых изотермических
процессах изменение энтропии равняется тепловому эффекту процесса, деленному на абсолютную температуру. ( Дж / град ∙ К )
3. Термодинамический смысл
Слайд 38 Примером может служить медленное таяние льда в
термосе с водой при 273о К (0оС), для чего к
18 г льда (1моль) необходимо подвести 6000 Дж теплоты.Энтропия в системе лед - вода возрастет на 6000:273 = 22 Дж/К.
Аналогично для образования 1 моль льда придется отвести 6000 Дж теплоты, при этом ΔS = - 22 Дж/К.
Изменение энтропии в обратимом изотермическом процессе
зависит только от начального и конечного состояний и не зависит
от пути перехода, следовательно, энтропия также относится к
функциям состояния!
Слайд 39 Энтропия газообразного вещества больше, чем жидкого, последняя
– больше, чем твердого вещества.
Рост температуры и
снижение давления увеличивает неупорядоченность движения частиц, что приводит к росту энтропии.В случае идеально упорядоченного кристалла при температуре 0 К его энтропия S=0.
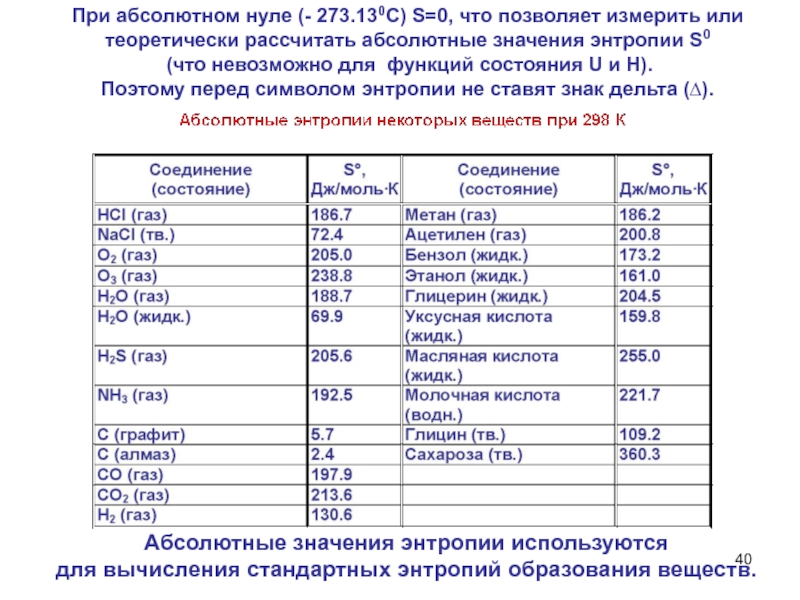
Слайд 40При абсолютном нуле (- 273.130С) S=0, что позволяет измерить или
теоретически рассчитать абсолютные значения энтропии S0
(что невозможно для функций
состояния U и Н). Поэтому перед символом энтропии не ставят знак дельта (∆).
Абсолютные значения энтропии используются
для вычисления стандартных энтропий образования веществ.
Слайд 41Задача
Определить энтропию образования этанола из элементов
(пользуясь табличными данными).
2С +
3Н2 + 0.5О2 С2Н5ОН.
Подстановка значений Sо
из таблицы дает:ΔS°образ.. = 161.0‑ ( 2·5.7 + 3·130.6 + 0.5·205.0 ) = – 344.7 Дж/моль·К.
Энтропия образования вещества (ΔS°образ) - разность между
суммами абсолютных энтропий продуктов реакции (S°np.) и абсолютных энтропий реагирующих веществ (S°pear).
Слайд 42Критерии самопроизвольного протекания процесса
Энтальпийный фактор (ΔН) - характеризует
стремление системы к упорядочению, поскольку процесс сопровождается уменьшением внутренней энергии.
Энтропийный фактор (∆S) - отражает тенденцию к разупорядочению, поскольку такое состояние наиболее вероятно.
Для того , чтобы действие этих двух факторов было сопоставимым, необходима одинаковая размерность величин !!!, для чего ∆S, измеряемое в Дж/(моль·К), необходимо умножить на абсолютную температуру.
Слайд 43T∆S
– характеризует ту часть энергии, которую нельзя превратить в
работу (связанная энергия), и отражает стремление системы к максимуму беспорядка
Выражение
T∆S имеет глубокий смысл, поскольку увеличение и энтропии, и температуры приводит к усилению в системе беспорядка.Слайд 44Функцией, учитывающей оба фактора и противоположность в тенденции их изменения
является энергия Гиббса G
(изобарно-изотермический потенциал):
G = H -
TS ∆G = ∆ H - T∆S
ГИББС Джозайя Уиллард
(11.02.1839-28.04.1903)
Один из основоположников термодинамики.
Разработал (1875–1878) теорию термодинамических потенциалов. Предложил (1878) графическое изображение состояния трехкомпонентной системы (треугольник Гиббса). Заложил основы термодинамики поверхностных явлений и электрохимических процессов, ввел понятие адсорбции.
Слайд 45Факторы, определяющие ход
изобарно- изотермического процесса
( Р и Т – постоянны)
(помним,
что +Q = - ∆H)
Слайд 46Свободная энергия Гиббса
(разность между энтальпийным и энтропийным факторами)
∆G=∆H–T∆S
∆G
– характеризует часть энергии системы, которую можно превратить в работу
(свободная энергия) ипозволяет судить о возможности самопроизвольного протекания химического процесса в данном направлении.
Связь ∆G и К равновесия
При стандартных условиях (2980К, [ ] =1моль/л)
Слайд 473. При постоянной температуре и давлении самопроизвольно протекают только те
процессы, для которых ΔG < 0;
II закон термодинамики
4. Критерием равновесия
самопроизвольного процесса является ΔG = 0
Изменение энергии Гиббса химической системы при протекании в ней химической реакции
2. Теплота не может сама собою перейти от более холодного тела к более теплому.
1. В изолированных системах самопроизвольно протекают только процессы, не сопровождающиеся уменьшением энтропии
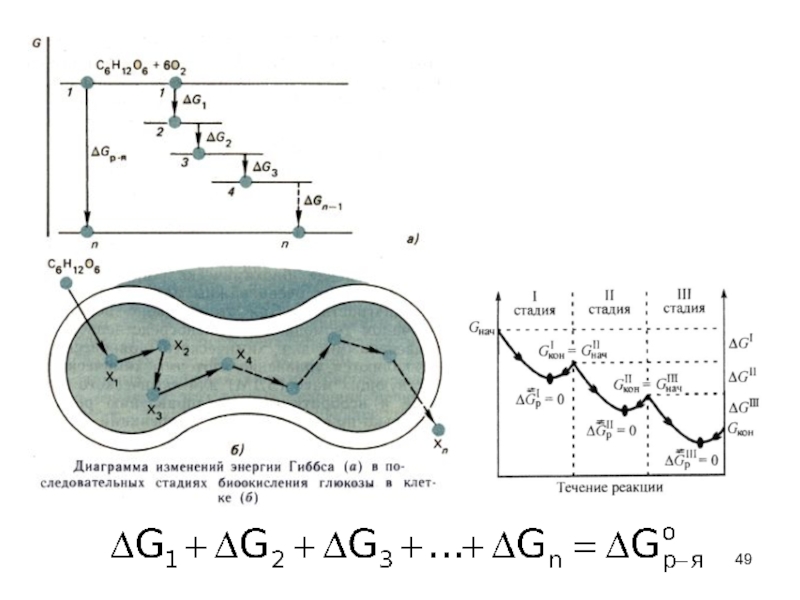
Слайд 48 Так как энергия Гиббса есть функция состояния,
к ней также применим закон Гесса:
Важный пример
применения закона Гесса – расчет энергии Гиббса реакции окисления глюкозы кислородом.
В клетках организма эта реакция осуществляется через
целый ряд последовательных стадий:
Слайд 50Для процессов, протекающих в изохорно –изотермических условиях, ( V и
Т – постоянны), используется
энергия Гельмгольца
Величина F - критерий направленности
самопроизвольногопроцесса в закрытой системе при V,T = const.
Убыль энергии Гельмгольца в равновесном процессе, протекающем при V,T = const, равна максимальной полезной работе, которую может совершить термодинамическая система над внешними телами.
∆F = ∆U - T∆ S
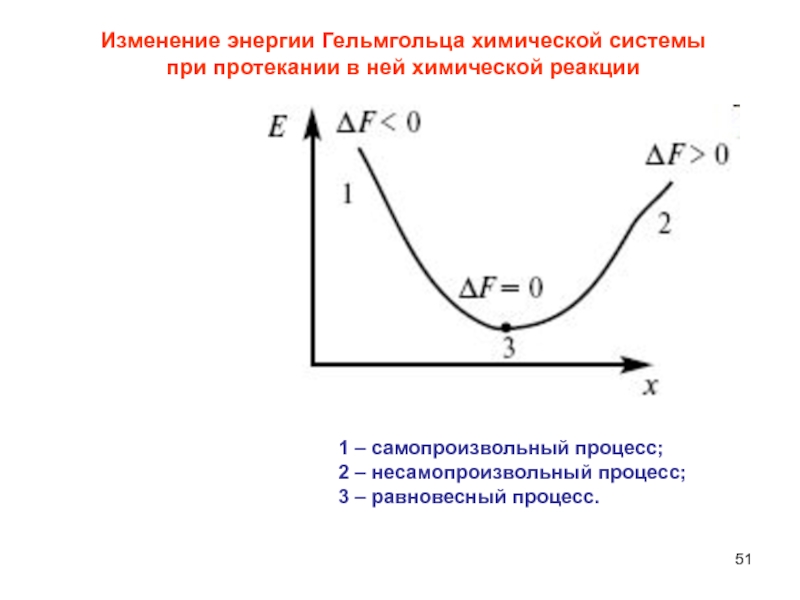
Слайд 511 – самопроизвольный процесс;
2 – несамопроизвольный процесс;
3 – равновесный процесс.
Изменение
энергии Гельмгольца химической системы при протекании в ней химической реакции
Слайд 52 Немецкий физик, математик, физиолог и психолог.
Родился в Потсдаме в семье
учителя гимназии.
Несмотря на интерес к физике, Гельмгольц не смог из-за недостатка средств
поступить в университет.Подписав обязательство прослужить восемь лет военным хирургом, он был принят в Военно-медицинский институт Фридриха Вильгельма в Берлине. Здесь он заинтересовался физиологией, которую преподавал известный физиолог И. Мюллер, близко сошелся с молодыми исследователями Э. Дюбуа-Реймоном и Э. Брюкке, увлеченными идеей преобразования физиологии как науки путем введения в нее методов физики и химии.
Он впервые:
измеряет скорость распространения нервного импульса, изучает процесс мышечного сокращения
увидел сетчатку глаза живого человека, используя для этого специальное глазное зеркало — офтальмоскоп
построил модель уха, позволившую изучить характер воздействия звуковых волн на орган слуха
Гельмгольц
Герман Людвиг
Фердинанд
31.08 1821
— 8.09.1894
Слайд 53
КПД при переходе тепла в работу всегда меньше 1
η
= (Т1–Т2)/Т1 (часть тепла всегда расходуется на увеличение внутренней энергии);
Формулировки
II закона термодинамики:В изолированных системах самопроизвольно могут совершаться только такие процессы, в которых энтропия системы возрастает ∆S >0
Тепло не может переходить от более холодного тела к горячему
В любой изолированной системе полная энергия остается постоянной ∆U=0, а полная энтропия только повышается ∆S >0
Слайд 54 Поскольку при абсолютном нуле поступательное, вращательное и колебательное движение
молекул прекращается, число вероятных состояний W=1,
Вальтер Нернст – 26.06.1864 - 18.11.1941Родился в в Польше. С девятнадцати до двадцати трех лет талантливый юноша сменил четыре университета.
В Гёттингене Нернст развивал свои исследования по электрохимии и начал заниматься общими вопросами термодинамики.
В 1912 году совершил знаменитое научное открытие - сформулировал третий закон термодинамики, который связан с понятием об абсолютном нуле температур.
III закон термодинамики:
Слайд 553. Абсолютный нуль недостижим
( так называемая «смерть Вселенной»)
2. Энтропия
идеального кристалла при абсолютном нуле равна нулю.
III закон термодинамики:
1. При
стремлении температуры к нулю, энтропия для равновесных состояний также стремится к нулю.Слайд 58 Гилберт Льюис – 23.10.1875 – 23.03.1946
Предложил новую
теорию кислот как акцепторов пары электронов и оснований как доноров
пары электронов.Предложил новую формулировку III начала термодинамики, что дало возможность точно определить абсолютную энтропию.
Именно поэтому реакции лучше протекают при высоких температурах
5. С повышением Т направление реакции зависит от величины изменения энтропии и, чем выше Т, тем энтропийный фактор значительнее!
Слайд 59 1. Большинство биохимических реакций в организме – обратимы и
протекают многостадийно.
2. Биологическое развитие организма возможно только в системе,
находящейся в стационарном (постоянство термодинамических величин, скоростей поступления и удаления веществ и энергии), но … далеком от равновесия состоянии!!!Особенности термодинамики биохимических поцессов.
Слайд 603. Живые организмы поддерживают присущую им упорядоченность за счет увеличения
энтропии внешней среды (поступающие с низким значением энтропии белки, углеводы,
полисахариды превращаются в Н2О,СО2,NН3 и выводятся из организма).Изменение энтропии (человек +окружающая среда) в стационарном состоянии равно сумме изменения энтропии организма и среды:
∆S общ = ∆Sчел.+ ∆Sсреды
Жизнь - постоянная борьба против тенденции к возрастанию энтропии.
Живые организмы выбрали «наименьшее зло» - стационарное состояние, котором возрастание энтропии минимально.
Слайд 61Принцип Пригожина
В открытой системе в стационарном состоянии прирост энтропии в
единицу времени ∆S / ∆t принимает минимальное положительное значение
Пригожин Илья Романович Бельгийский химик, родился в Москве 25 января 1917 года.
В 1921году семья эмигрировала из России.
Нобелевская премия (1977год) «за работы по термодинамике необратимых процессов». Эта работа открыла для термодинамики «новые связи и создала теории, устраняющие разрывы между химическим, биологическим и социальным полями научных исследований». Исследования Пригожина отличает элегантность и прозрачность, поэтому ученого заслуженно называют «поэтом термодинамики»
Слайд 624. Реализация принципа энергетического сопряжения:
Эндэргонические реакции (∆G>0 –процесс самопроизвольно
не идет!!!) сопряжены с экзэргоническими (∆G
процессы)Глюкоза + Фруктоза → Сахароза + Н2О
∆G= + 20.9 кДж/моль
Глюкоза + Фруктоза + АТФ → Сахароза + АДФ + Фосфаты
∆G= - 29.2 кДж/моль
Слайд 63Термодинамические особенности открытых систем для живого организма ( постоянство кислотно-основного,
гетерогенного, лигандообменного баланса) объясняют его устойчивость,
позволяющую ему в течение
многих лет сохранять работоспособность, о также относительное постоянство внутренней среды – гомеостаза!Слайд 64В основе гомеостаза организма находятся следующие химические и физико-химические балансы:
Кислотно-основной
Окислительно-восстановительный
Металло-лигандный
Гидрофильно-липофильный
Водно-электролитный
Слайд 65 Человеческий организм, является открытой, стационарной термодинамической системой.
Основным источником энергии для него является химическая энергия, заключенная в
пищевых продуктах, которая расходуется на:совершение работы внутри организма, связанной с дыханием, кровообращением, перемещением метаболитов, секрецией соков ;
нагревание вдыхаемого воздуха, потребляемой воды и пищи;
покрытие потерь теплоты в окружающую среду при непосредственной радиации и испарении влаги с поверхности тела и с выдыхаемым воздухом и с продуктами жизнедеятельности;
совершение внешней работы, связанной со всеми перемещениями человека и его трудовой деятельностью.
Биоэнергетика
Слайд 67Углеводы – CnH2nOn
(сахар, хлеб, крупы, макаронные изделия)
В процессе
усвоения углеводы расщепляются до моносахаридов, которые далее окисляются до СО2
и Н2О.Калорийность углеводов составляет в среднем
16,5-17,2 кДж/г (4,0-4,1 ккал/г).
Покрытие энергетических затрат
55–60%
Норма суточного потребления -
360-500 г
При правильном питании суточное потребление углеводов должно
по массе в 4-5 раз превышать количество белков или жиров
Слайд 68Белки - основной строительный материал клеток
(рыба, творог, сыр, говядина,
крупы)
Вещества, молекулы которых состоят из остатков -аминокислот, связанных в длинные
цепи пептидными связями.Конечными продуктами окисления являются СО2 и Н2О, а также мочевина, аммонийные соли, мочевая кислота, аспарагин и некоторые другие, выводимые из организма с мочой и потом.
калорийность 16,5-17,2 кДж/г
(4 – 4.2 ккал/г)
покрытие энергетических
затрат -15–20 %.
Норма суточного потребления 80–100 г,
(при тяжелом физическом труде 130 -140 г)
Слайд 69Жиры - сложные эфиры глицерина и жирных кислот.
где R, R'
и R" — радикалы жирных кислот. наибольшее значение из которых
имеют стеариновая С17Н35СООН, пальмитиновая С15Н31СООН и олеиновая С17Н33СООН.Калорийность жиров более чем в два раза превосходит таковую углеводов: 37,7-39,8 кДж/г (9,0-9,5 ккал/г).
Покрытие энергетических затрат - 20–25 %
Норма суточного потребления – 90-100 г
(масло растительное и животное, яйцо, говядина)
Слайд 70Запас жира позволяет представителям животного мира некоторое время обходиться без
потребления воды, поскольку при окислении 100 г жира образуется около
100-150 г воды.Жир, запасаемый верблюдом в горбу, позволяет ему в течение многих дней сохранять трудоспособность, не утоляя жажды.
Слайд 72«Вкусно» не всегда означает «калорийно». И если подойти к вопросу
грамотно, можно съесть гораздо больше вкусных вещей, чем кажется!
Слайд 74Аналогичный подход относится к витаминам
Без витамина Е
мы страдали бы от простуд, нам бы угрожали рак и
преждевременная старость. Мы даже не смогли бы прочесть эту информацию – помешала бы катаракта. Да и само наше появление на свет было бы под большим вопросом – витамин Е называют фактором размножения.Как получить суточную дозу чудо-витамина? – Выбирайте!
Именно витамин Е отвечает за прозрачность хрусталика