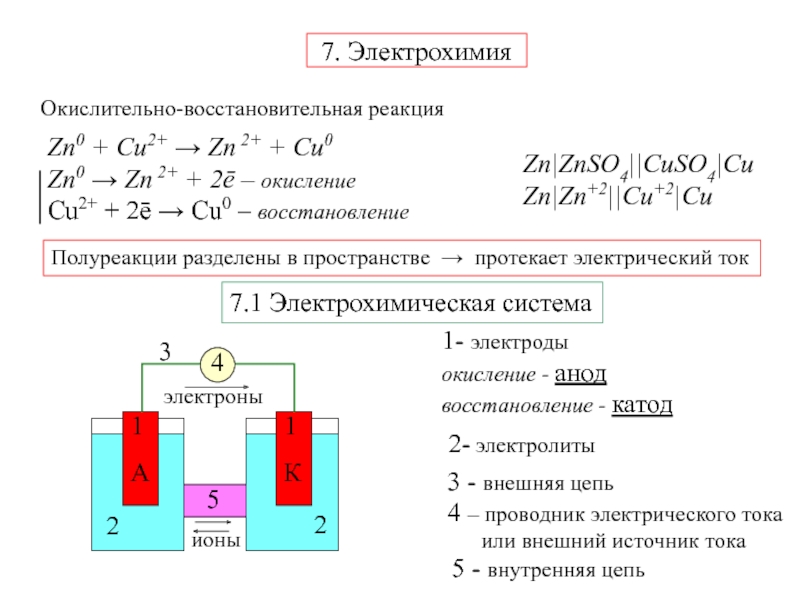
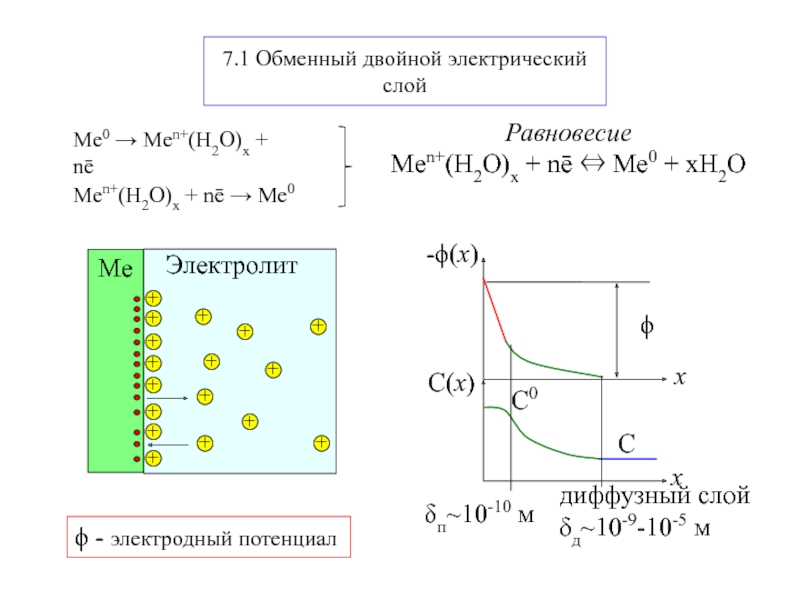
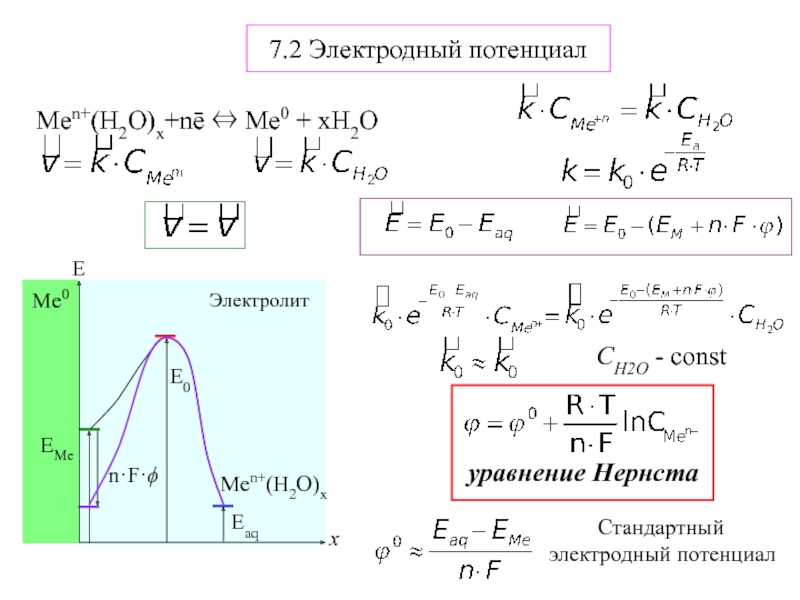
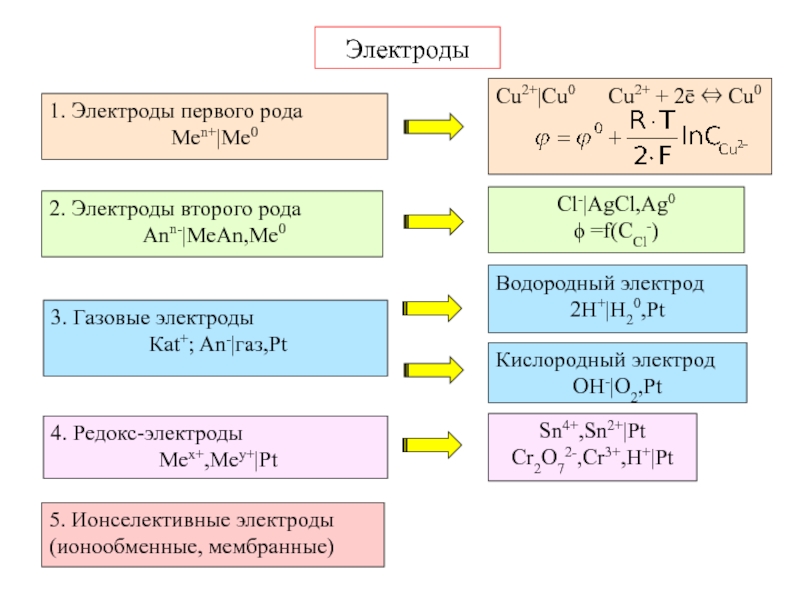
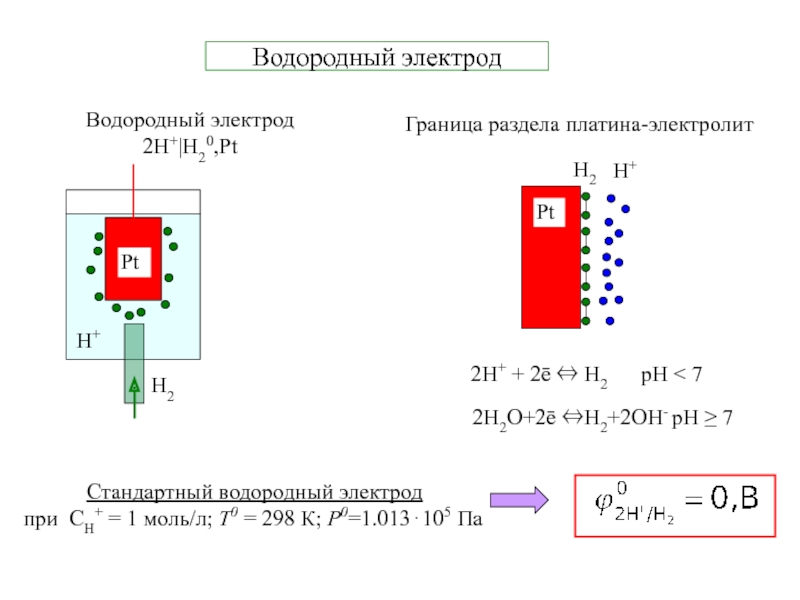
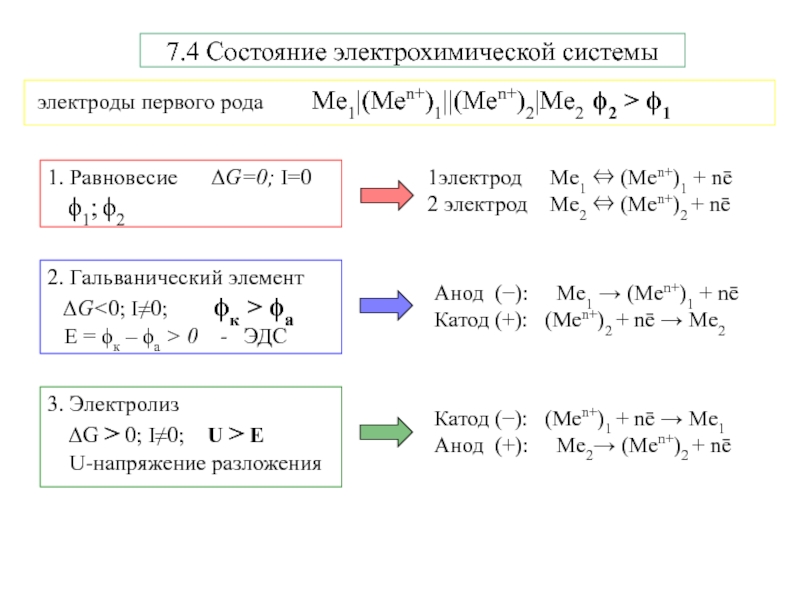
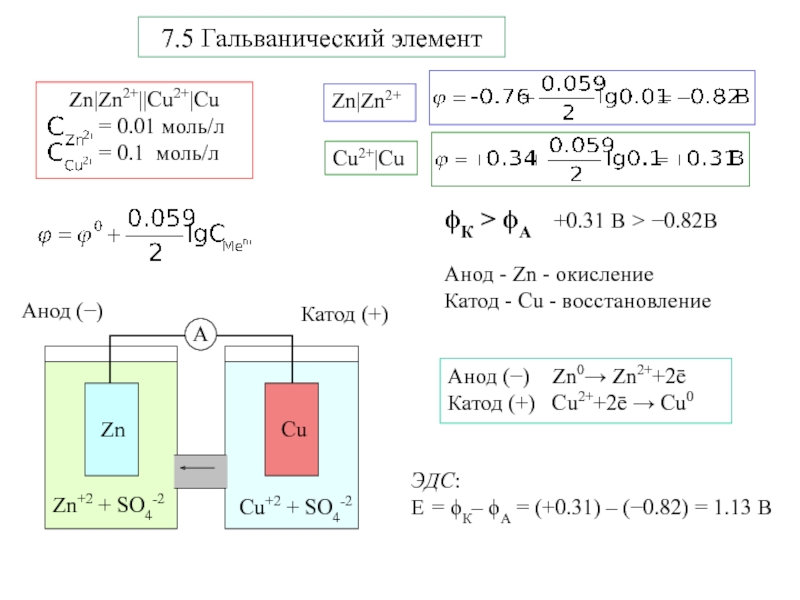
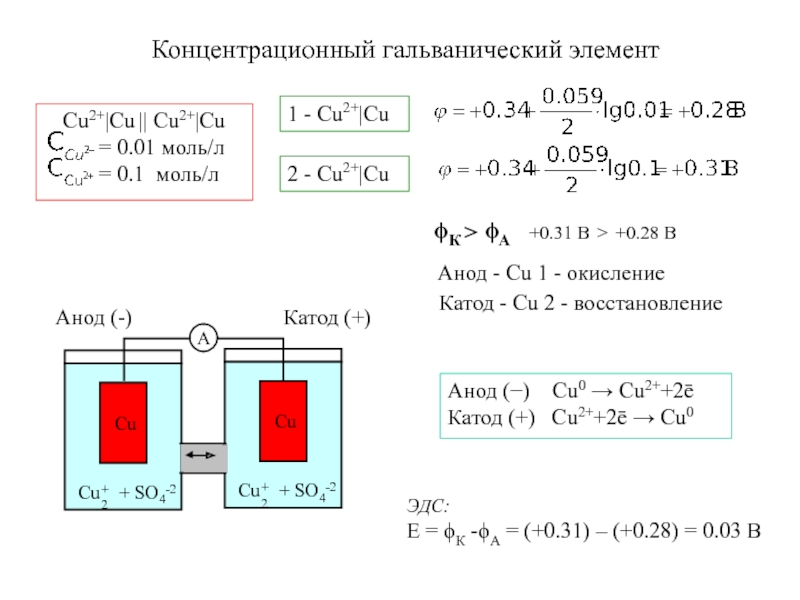
Электрохимическая система
1- электроды
окисление - анод
восстановление - катод
2- электролиты
3 - внешняя
цепь5 - внутренняя цепь
4 – проводник электрического тока
или внешний источник тока
Zn|ZnSO4||CuSO4|Cu
Zn|Zn+2||Cu+2|Cu