Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Липиды 3.ppt
Содержание
- 1. Липиды 3.ppt
- 2. Содержание: - биосинтез насыщенных ЖКбиосинтез
- 3. Биосинтез ЖК Наиболее интенсивно протекает в
- 4. Биосинтез ЖК- это альтернативный вариант
- 5. Исходным субстратом для синтеза яв-ся
- 6. Увеличение цитрат в цитоплазме яв-ся сигналом к
- 7. Для синтеза ЖК необходима одна
- 8. Малонил-КоА -
- 9. Избыток ацетил-КоА в митохондриях не
- 10. На эту реакцию расходуется
- 11. Биосинтез ЖК
- 12. Биосинтез ЖК осуществляется с помощью
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Биосинтез ЖК будет протекать при
- 17. Но в этих условиях
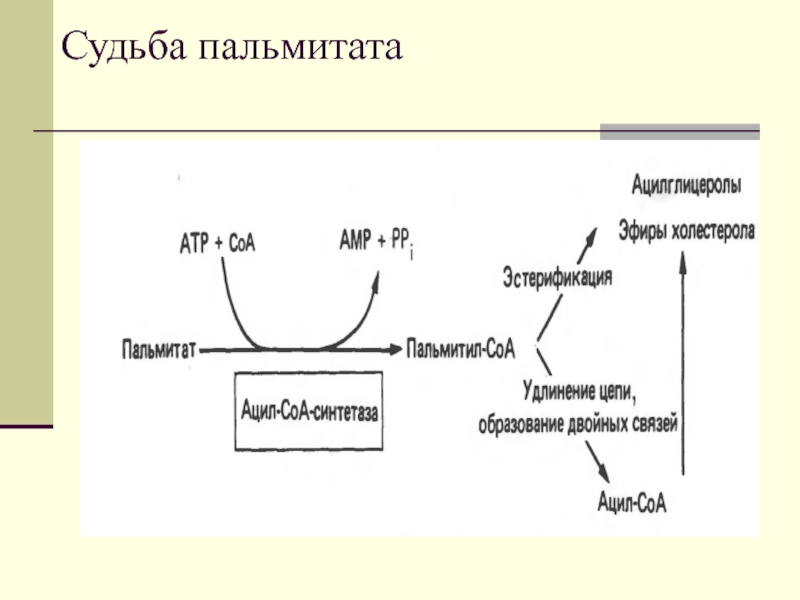
- 18. Судьба пальмитата
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Биосинтез ТГ и ФЛ Синтез ТГ
- 26. В жировой ткани и мыщцах, вследствие
- 27. В печени наблюдаютсяоба пути образования г-3-ф.
- 28. Слайд 28
- 29. Ненасыщенные жирные
- 30. Слайд 30
- 31. Синтез ненасыщенных жирных кислот из
- 32. В качестве субстратов
- 33. Затем они отщепляются в
- 34. Слайд 34
- 35. Слайд 35
- 36. Происхождение ненасыщенных жирных кислот в клетках организма.
- 37. К таким жирным кислотам относятся
- 38. У человека при недостатке в пище
- 39. Случаи подобного дефицита наблюдаются и
- 40. Синтез ненасыщенных жирных кислот из
- 41. Из этих компонентов образуется короткая
- 42. Образование и утилизация кетоновых телДвумя основными видами
- 43. Слайд 43
- 44. Первоначальная стадия этого
- 45. В дальнейшем ацетоуксусная
- 46. Затем фермент - ГОМГ-КоА
- 47. эти реакции происходят в митохондриях. В цитозоле
- 48. Образование кетоновых тел
- 49. При голодании усиливается липолиз,
- 50. В норме кетоновые тела являются источником энергии
- 51. Такая избирательность обусловлена
- 52. Образуется ацетоацетил~КоА, который
- 53. Зато спустя несколько суток
- 54. Тиолаза довершает расщепление
- 55. Интенсивность окисления кетоновых тел
- 56. В определенных метаболических условиях, когда
- 57. Состояние организма, при котором концентрация
- 58. Он обусловлен спонтанным
- 59. Кетоз возникает в
- 60. Это приводит к дисбалансу
- 61. Слайд 61
- 62. Количество ацетоацетата, которое восстанавливается
- 63. Слайд 63
- 64. Биосинтез ХСХС синтезируется гепатоцитами( 80%), энтероцитами (10%)
- 65. Слайд 65
- 66. Ежесуточно человек потребляет от 2-3г
- 67. Слайд 67
- 68. Слайд 68
- 69. Слайд 69
- 70. Слайд 70
- 71. Слайд 71
- 72. Слайд 72
- 73. Слайд 73
- 74. Скачать презентанцию
Содержание: - биосинтез насыщенных ЖКбиосинтез ненасыщенных ЖКбиосинтезТГ и фосфатидовбиосинтез ХС. Пул ХС в клеткемеханизм регуляции углеводного обмена- жиро-углеводный цикл Рэндла
Слайды и текст этой презентации
Слайд 2
Содержание:
- биосинтез насыщенных ЖК
биосинтез ненасыщенных ЖК
биосинтезТГ и
фосфатидов
цикл РэндлаСлайд 3Биосинтез ЖК
Наиболее интенсивно протекает в ЖКТ, гепатоцитах, энтероцитах,
лактирующей молочной железе. Источником углерода для биосинтеза ЖК яв-ся избыточные
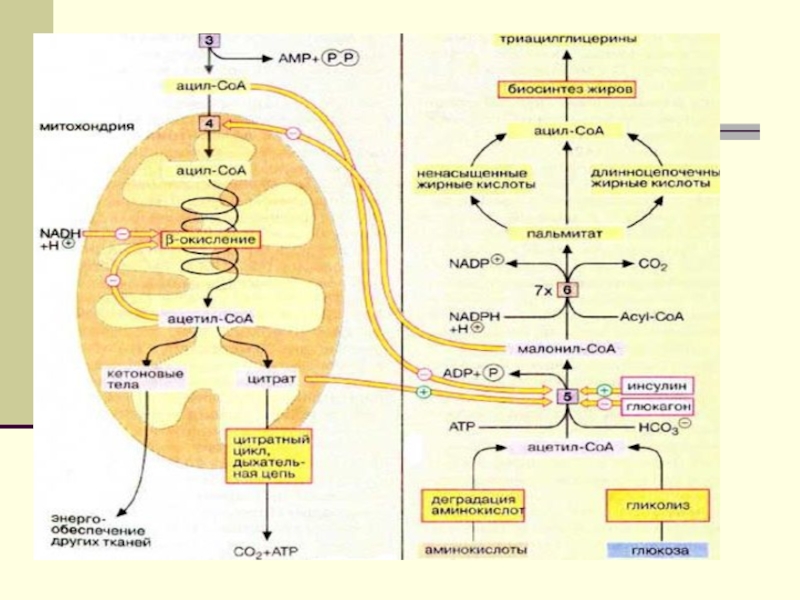
углеводы, аминокислоты, продукты метаболизма ЖК.Слайд 4 Биосинтез ЖК- это альтернативный вариант ß- окисления, но
осуществляемый в цитоплазме. Процесс ß- окисления выдает энергию в форме
FADH2, NADH2 и АТФ, а биосинтез ЖК, поглощает ее в такой же форме.Слайд 5 Исходным субстратом для синтеза яв-ся ацетил-КоА, образующийся в
митохондриальном матриксе. Мембрана митохондрии не проницаема для ацетил-КоА, поэтому он
взаимодействует с ЩУК с образованием цитрата, который свободно проходит в цитоплазму и там расщепляется до ЩУК и ацетил-КоА.Слайд 6Увеличение цитрат в цитоплазме яв-ся сигналом к началу биосинтез ЖК.
Цитрат + АТФ + НSКоА -----?
------? CН3-СО-SКоА+ ЩУК +АДФ
Реакция протекает под действием цитратлиазы.
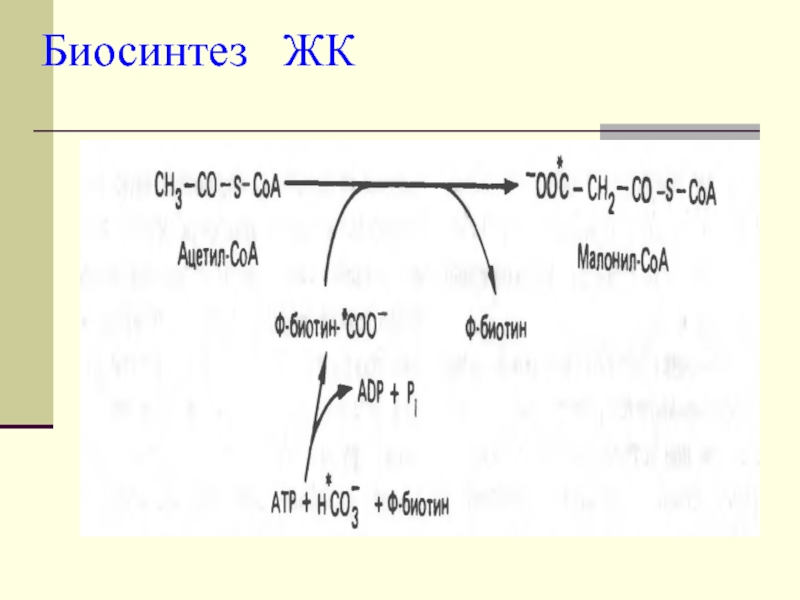
Слайд 7 Для синтеза ЖК необходима одна молекула ацетил-КоА, неактивированная,
тогда как остальные должны быть активированы.
СН3-СО-SКоА + СО2+ АТФ
+ биотин-------------------------------?СООН-СН2-СО-SКоААктиватором фермента- Ацетил-КоА-карбоксилазы яв-ся цитрат
Первой реакцией в биосинтезе яв-ся образование малонил-КоА.
Ацетил-КоА-карбоксилаза
Слайд 8
Малонил-КоА - это начальный промежуточный
продукт в синтезе жирных кислот, образованный из ацетил-КоА в цитоплазме.
Слайд 9 Избыток ацетил-КоА в митохондриях не может самостоятельно пройти
в цитоплазму. Проход через митохондриальную мембрану становится возможным благодаря цитратному
шунту. Ацетил-КоА карбоксилаза катализирует образование малонил-КоА.Слайд 10
На эту реакцию расходуется СО2 и АТФ.
Таким образом, условия, которые способствуют липогенезу (наличие большого количества глюкозы),
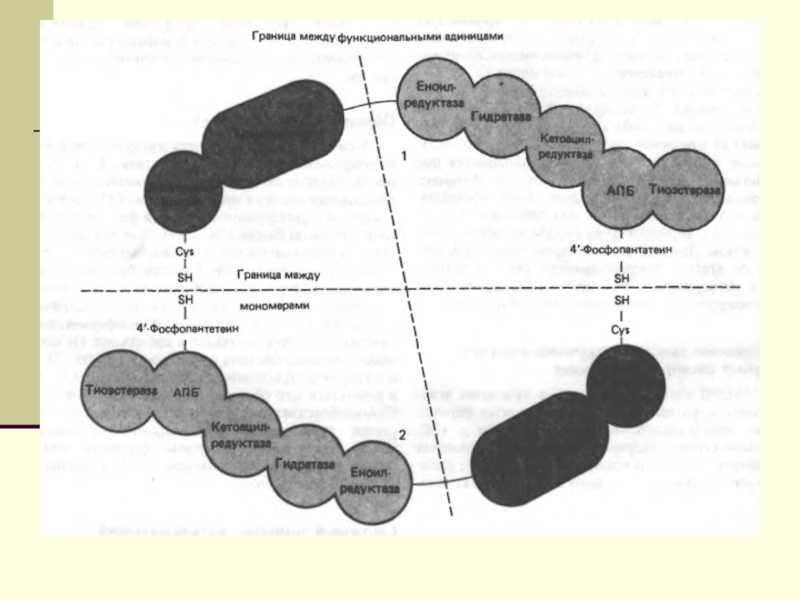
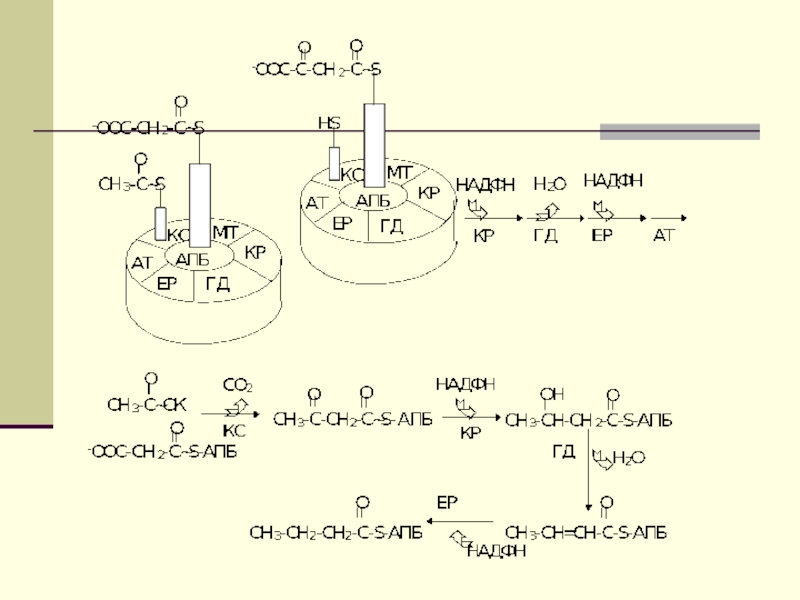
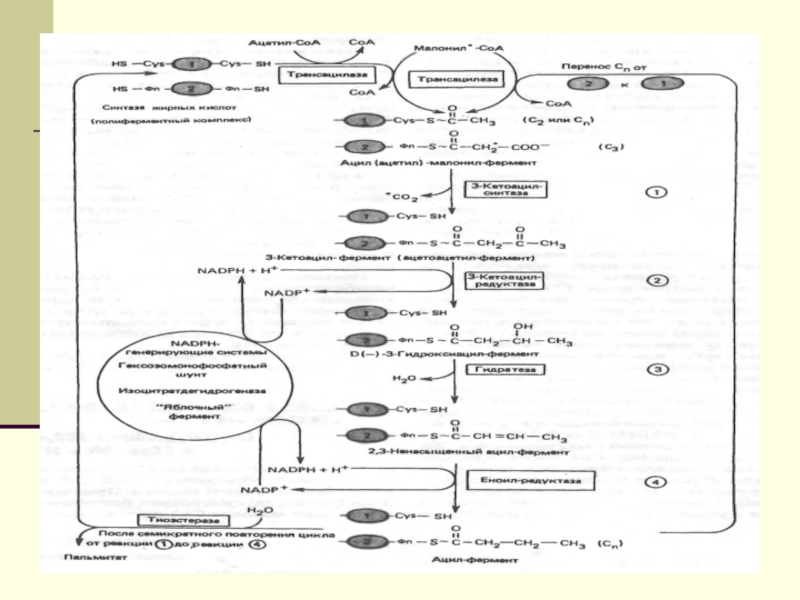
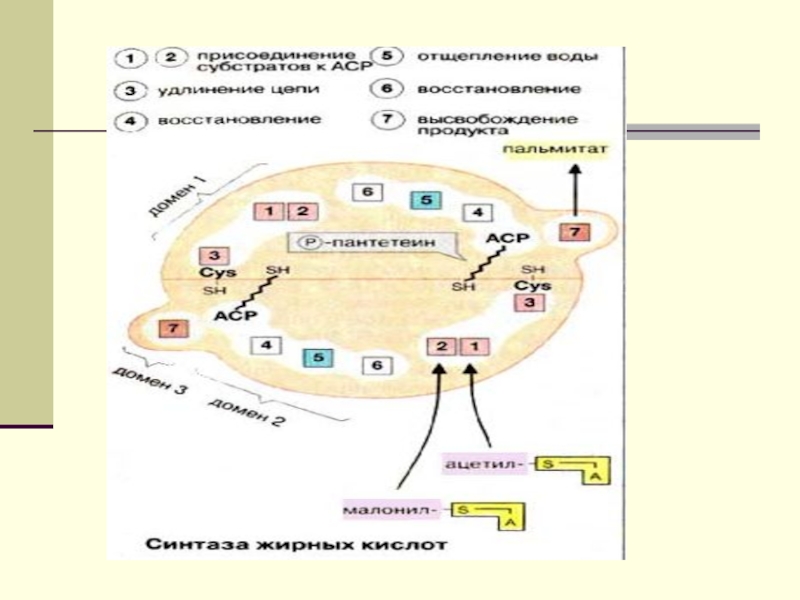
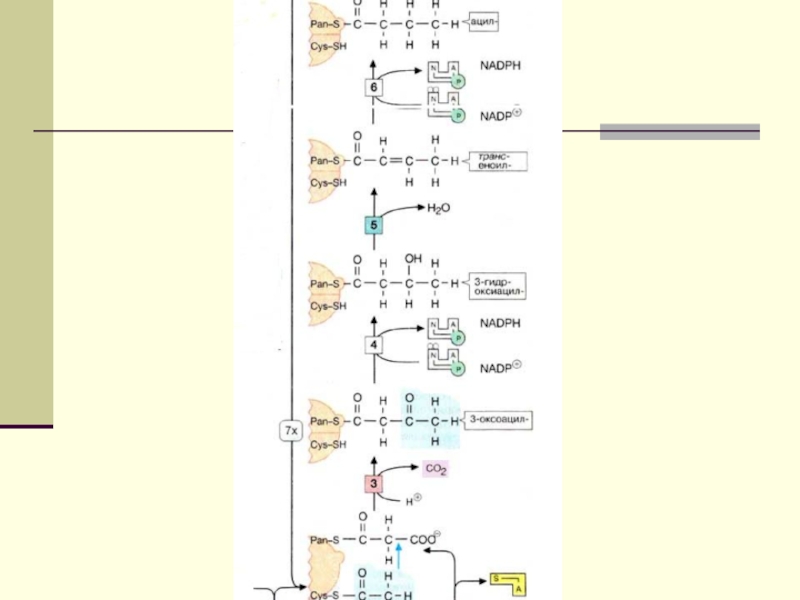
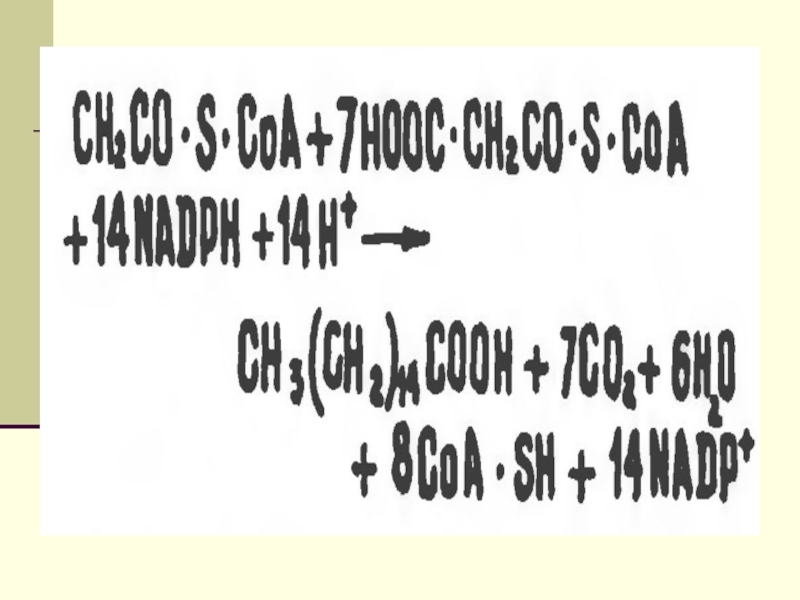
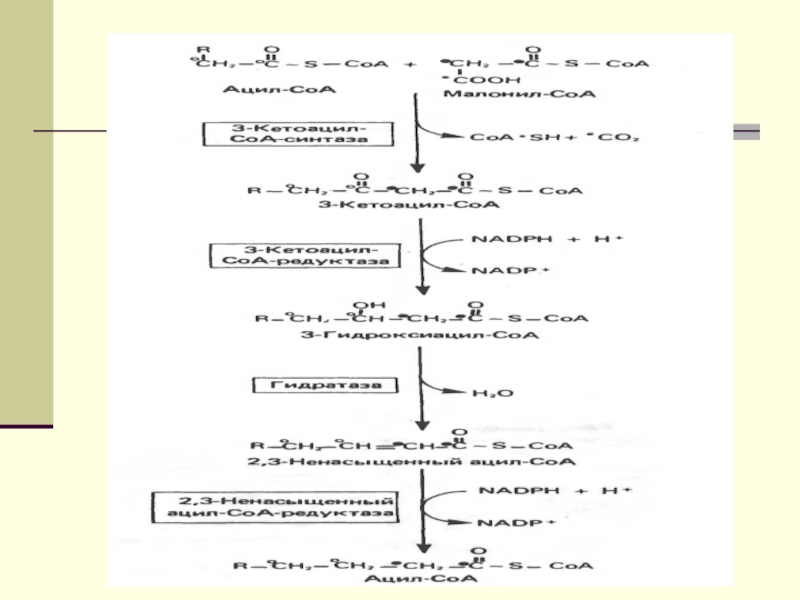
подавляют β-окисление жирных кислотСлайд 12 Биосинтез ЖК осуществляется с помощью мультиферментного комплекса- пальмитоилсинтетазы
жирных кислот. Она состоит из 7 ферментов, связанных с АПБ
( ацилпереносящим белком). АПБ состоит из 2 сбъединиц, на каждую из которых приходится по 250 тыс. д.АПБ содержит 2 SН группы. После образования малонил-КоА происходит перенос ацетильного и малонильного остатков на АПБ.
Слайд 16 Биосинтез ЖК будет протекать при высоком уровне глюкозы
в крови, что обусловливает интенсивность гликолиза( поставщика ацетил-КоА), ПФП( поставщика
NADFH2 и СО2).В условиях голодания, диабета, ситез ЖК маловероятен,т.к. нетГл( при диабете она не поступет в ткани, а находится в крови), следовательно будет низкой ативность гликолиза и ПФП.
Слайд 17 Но в этих условиях в митохондриях печени
имеются запасы СН3-СО-SКоА( источник ß-окисления ЖК). Однако этот ацетил-КоА не
вступает в реакции синтеза ЖК,т.к. он должен лимитироваться продуктами ПЦ, СО2 и NADH2.В данном случае организму выгоднее синтезировать ХС, который требует только лишь NADFH2 и ацетил-КоА, что происходит при голодании и диабете.
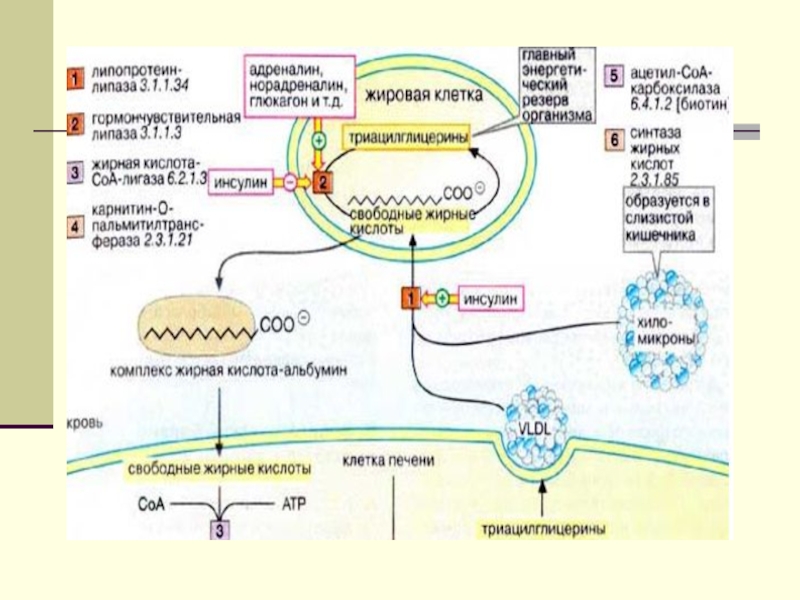
Слайд 25Биосинтез ТГ и ФЛ
Синтез ТГ происходит из Глицерина
(Гн) и ЖК в основном стеариновой , пальмитиновой олеиновой.
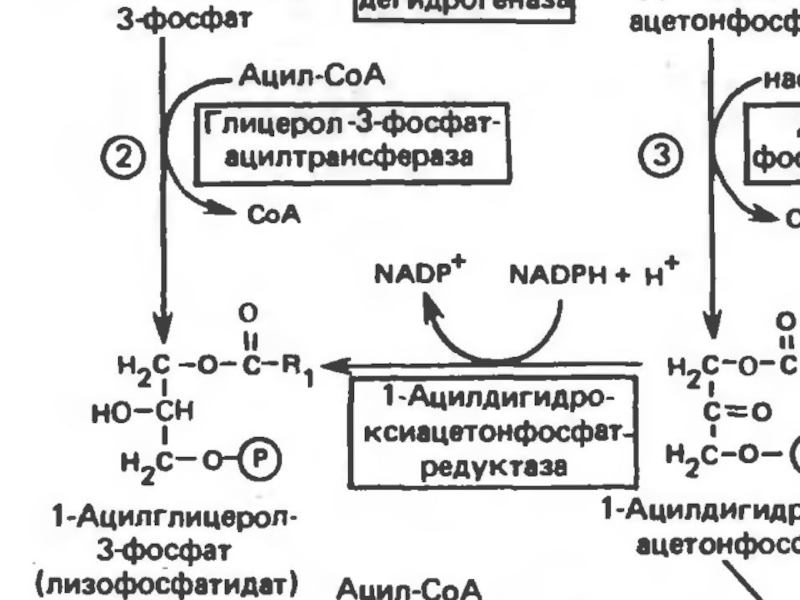
Путь биосинтез ТГ в тканях протекает через образование глицерол-3 фосфата, как промежуточного соединения. В почках, энтероцитах, где активность глицеролкиназы высокая, Гн фосфорилируется АТФ до глицеролфосфата.Слайд 26 В жировой ткани и мыщцах, вследствие очень низкой активности
глицеролкиназы, образование глицеро-3-фосфата, в основном связано с гликолизом.
Известно,
что пригликолизе образуется ДАФ( диоксиацетонфосфат), который в присутствии глицеролфосфат-ДГ способен превращаться в Г-3ф (глицерол-3 фосфат).Слайд 27 В печени наблюдаютсяоба пути образования г-3-ф. В тех случаях,
когда содержанеи Глюкозы в ЖК понижено( при голодании), образуется лишь
незначительное количество Г-3-ф. Поэтому, освободитвшиеся в результате липолиза ЖК не могут быть использованы ввиду этого для ресинтеза. Поэтому они покидают ЖТ и количество резервного жира снижается.Слайд 31 Синтез ненасыщенных жирных кислот из насыщенных с параллельным
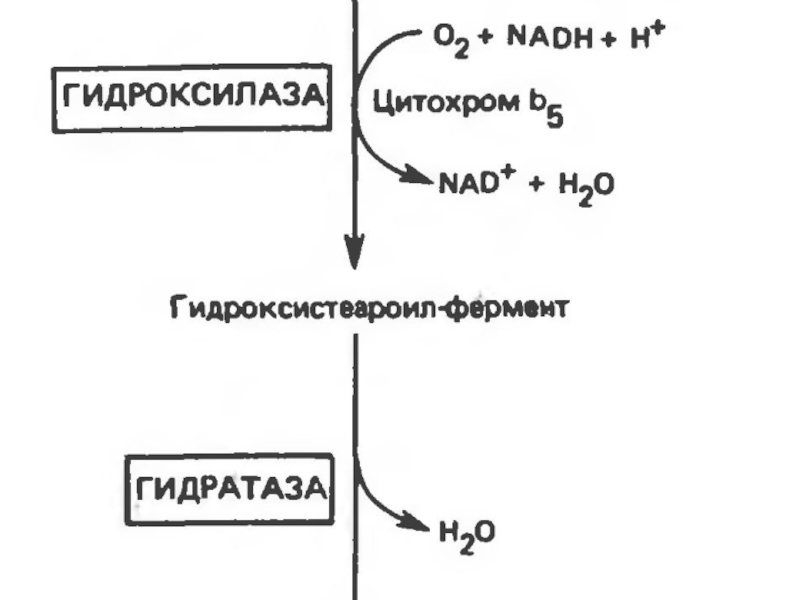
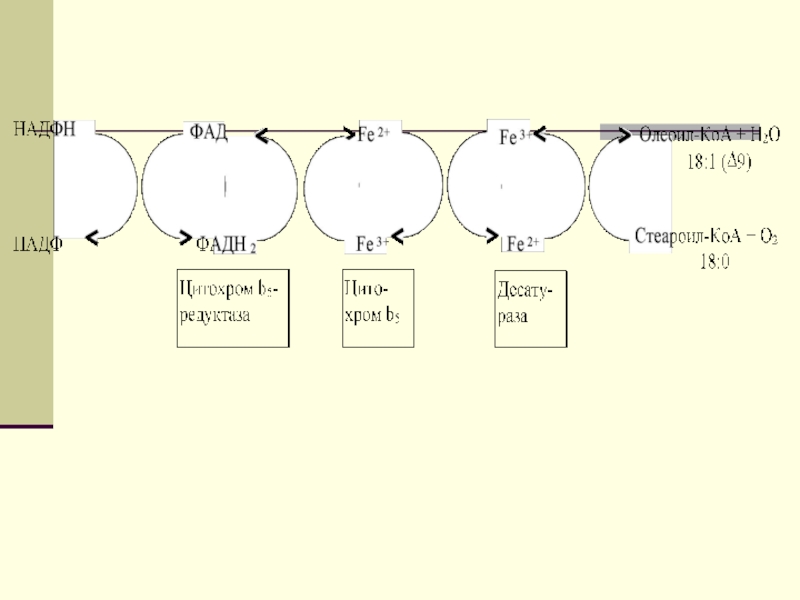
удлинением цепи. Десатурация проходит под действием микросомального комплекса ферментов, состоящего
из трех компонентов белковой природы: цитохрома b5, цитохром b5-редуктазы и десатуразы, которые содержат в своем составе негемовое железо.Слайд 32
В качестве субстратов используются НАДФН и
молекулярный кислород. Из этих компонентов образуется короткая цепь переноса электронов,
с помощью которой на короткий период времени в молекулу жирной кислоты включаются гидроксильные группыСлайд 33
Затем они отщепляются в виде воды, в
результате в молекуле жирной кислоты формируется двойная связь. Имеется целое
семейство субъединиц десатуразы, которые специфичны к определенному месту введения двойной связи.Слайд 36Происхождение ненасыщенных жирных кислот в клетках организма. Метаболизм арахидоновой кислоты
Незаменимые
и заменимые - Среди ненасыщенных жирных кислот в организме человека
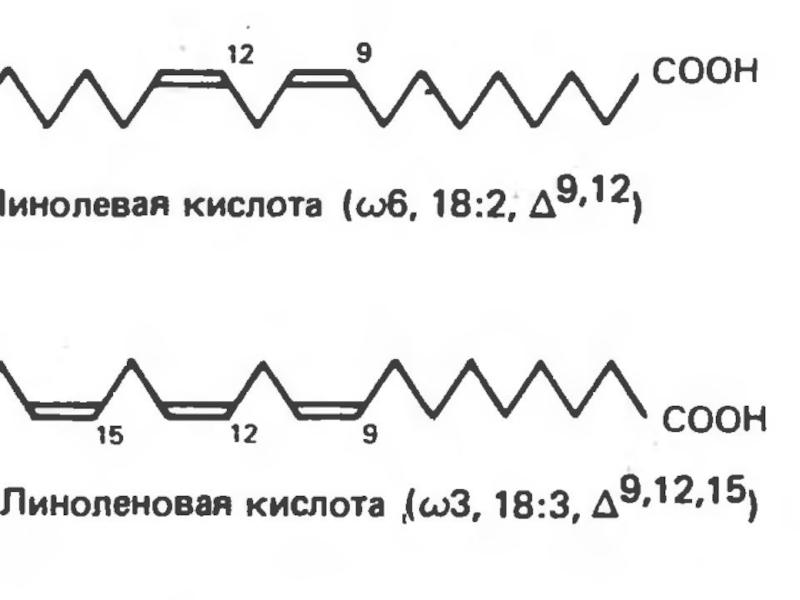
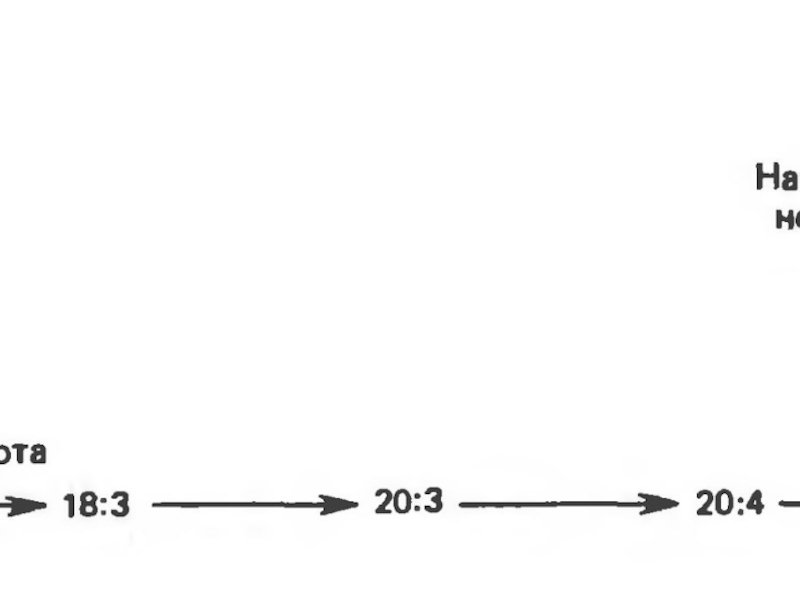
не могут синтезироваться ω-3 и ω-6 жирные кислоты в связи с отсутствием ферментной системы, которая могла бы катализировать образование двойной связи в положении ω-6 или любом другом положении, близко расположенном к ω-концу.Слайд 37 К таким жирным кислотам относятся линолевая кислота (18:2,
Δ9,12), линоленовая кислота (18:3, Δ9,12,15) и арахидоновая кислота (20:4, Δ5,8,11,14).
Последняя является незаменимой только при недостатке линолевой кислоты, поскольку в норме она может синтезироваться из линолевой кислотыСлайд 38 У человека при недостатке в пище незаменимых жирных кислот
описаны дерматологические изменения. Обычный рацион взрослых людей содержит достаточное количество
незаменимых жирных кислот. Однако у новорожденных, которые получают рацион, обедненный жирами, отмечаются признаки поражения кожи. Они проходят, если в курс лечения включается линолевая кислота.Слайд 39 Случаи подобного дефицита наблюдаются и у пациентов, которые
длительное время находятся на парентеральном питании, обедненном незаменимыми жирными кислотами.
В качестве профилактики такого состояния достаточно, чтобы в организм поступали незаменимые жирные кислоты в количестве 1-2% от общей калорической потребности.Слайд 40 Синтез ненасыщенных жирных кислот из насыщенных с параллельным
удлинением цепи. Десатурация проходит под действием микросомального комплекса ферментов, состоящего
из трех компонентов белковой природы: цитохрома b5, цитохром b5-редуктазы и десатуразы, которые содержат в своем составе негемовое железо. В качестве субстратов используются НАДФН и молекулярный кислород.Слайд 41 Из этих компонентов образуется короткая цепь переноса электронов,
с помощью которой на короткий период времени в молекулу жирной
кислоты включаются гидроксильные группы. Затем они отщепляются в виде воды, в результате в молекуле жирной кислоты формируется двойная связь. Имеется целое семейство субъединиц десатуразы, которые специфичны к определенному месту введения двойной связи.Слайд 42Образование и утилизация кетоновых тел
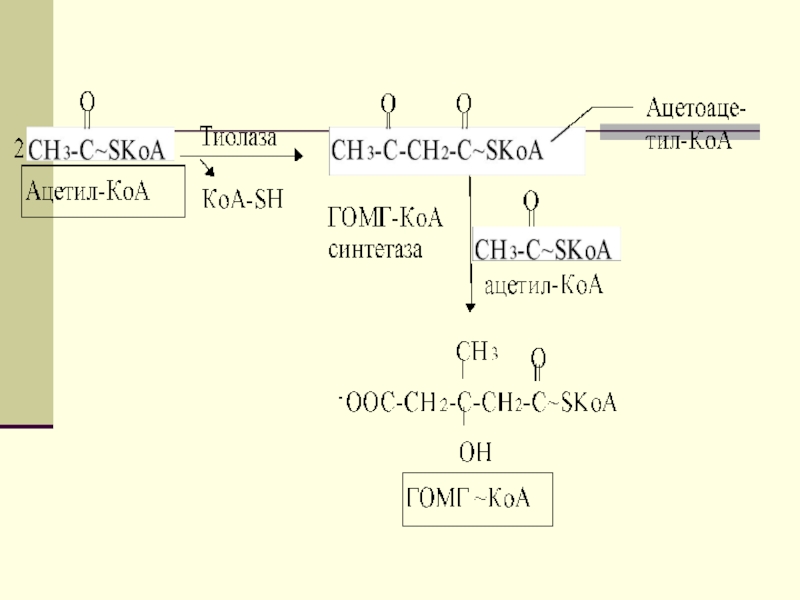
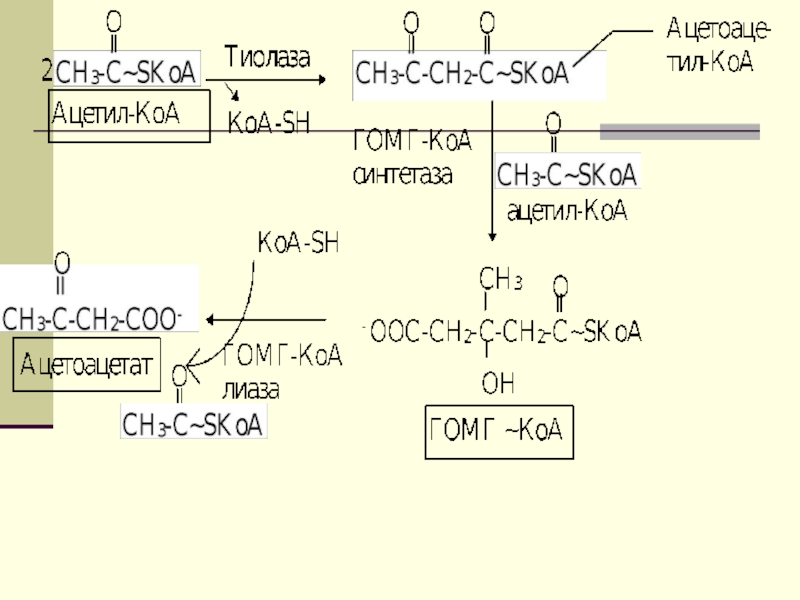
Двумя основными видами ацетоновых тел являются
ацетоацетат и β-гидроксибутират. β-гидроксибутират - это восстановленная форма ацетоацетата. Ацетоацетат
образуется в клетках печени из ацетил~КоА. Образование происходит в митохондриальном матриксе.Слайд 44
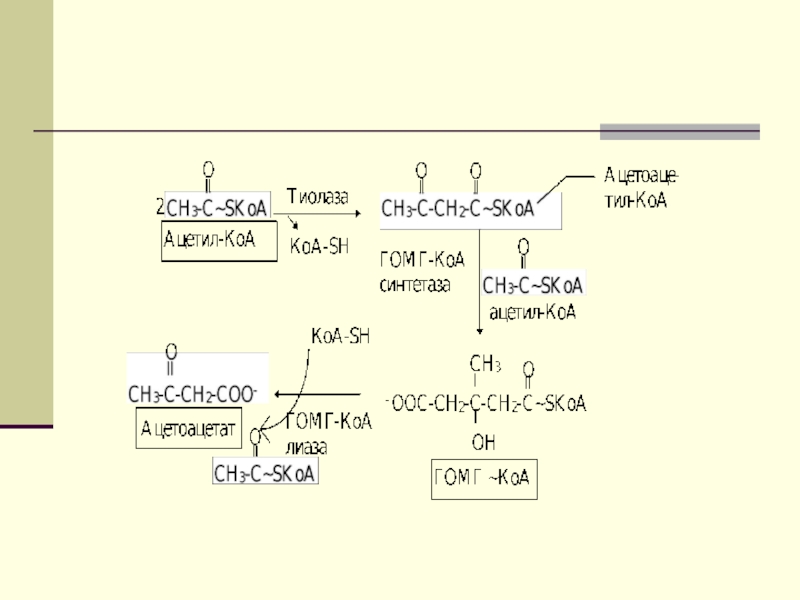
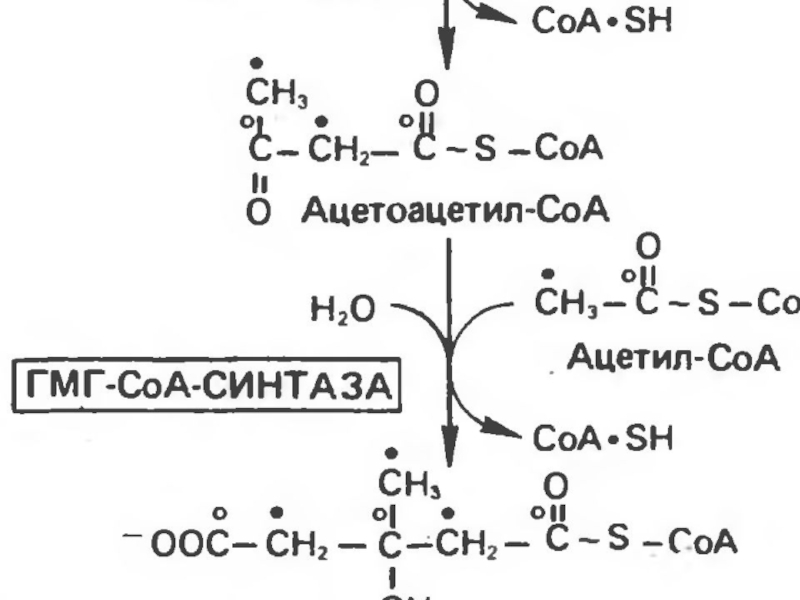
Первоначальная стадия этого процесса катализируется ферментом
- β-кетотиолазой. Затем ацетоацетил-КоА конденсируется со следующей молекулой ацетил-КоА под
влиянием фермента ГОМГ-КоА синтетазы. В результате образуется β-гидрокси-β-метилглютарил-КоА. Затем фермент - ГОМГ-КоА лиаза катализирует расщепление ГОМГ-КоА на ацетоацетат и ацетил-КоА.Слайд 45
В дальнейшем ацетоуксусная кислота восстанавливается под
влиянием фермента b-гидроксибутиратдегидрогеназы и в результате образуется b-оксимасляная кислота.
Слайд 46
Затем фермент - ГОМГ-КоА лиаза катализирует
расщепление ГОМГ-КоА на ацетоацетат и ацетил-КоА. В дальнейшем ацетоуксусная кислота
восстанавливается под влиянием фермента b-гидроксибутиратдегидрогеназы и в результате образуется b-оксимасляная кислота.Слайд 47
эти реакции происходят в митохондриях. В цитозоле имеются изоферменты -
β-кетотиолазы и ГОМГ~КоА синтетазы, которые также катализируют образование ГОМГ~КоА, но
в качестве промежуточного продукта в синтезе холестерола. Цитозольный и митохондриальный фонды ГОМГ~КоА не смешиваются.Слайд 48
Образование кетоновых тел в печени контролируется
состоянием питания. Такое контрольное действие усиливается инсулином и глюкагоном. Принятие
пищи и инсулин снижают образование кетоновых тел, в то время как при голодании стимулируется кетогенез вследствие увеличения количества жирных кислот в клеткахСлайд 49
При голодании усиливается липолиз, растет уровень
глюкагона
и концентрация цАМФ в печени. Происходит фосфорилирование, тем
самым активация ГОМГ-КоА синтетазы. Аллостерическим ингибитором ГОМГ-КоА синтетазы выступает сукцинил-КоА.Слайд 50
В норме кетоновые тела являются источником энергии для мышц; при
продолжительном голодании они могут использоваться центральной нервной системой. Следует иметь
ввиду, что окисление кетоновых тел не может проходить в печени. В клетках других органов и тканей оно протекает в митохондриях.Слайд 51
Такая избирательность обусловлена локализацией ферментов, катализирующих
этот процесс.
Сначала β-гидроксибутират дегидрогеназа катализирует окисление β-гидроксибутирата до
ацетоацетата в НАД+-зависимой реакции. Затем с помощью фермента, сукцинил~КоА -Ацетоацетил~КоА трансферазы, кофермент А перемещается с сукцинил~КоА на ацетоацетат. Слайд 52
Образуется ацетоацетил~КоА, который является промежуточным
продуктом последнего витка β-окисления жирных кислот. Этот фермент в печени
не образуется. Именно поэтому там не может происходить окисление кетоновых тел.Слайд 53
Зато спустя несколько суток после начала
голодания в клетках мозга начинается экспрессия гена, кодирующего этот фермент.
Тем самым мозг адаптируется к использованию кетоновых тел в качестве альтернативного источника энергии, снижая свою потребность в глюкозе и белке.Слайд 54
Тиолаза довершает расщепление ацетоацетил-КоА, встраивая КоА
по месту разрыва связи между α и β углеродными атомами.
В результате образуется две молекулы ацетил-КоА.Слайд 55
Интенсивность окисления кетоновых тел во внепеченочных тканях
пропорциональна их концентрации в крови. Общая концентрация кетоновых тел в
крови обычно ниже 3 мг/100 мл, а средняя ежесуточная экскреция с мочой составляет приблизительно от 1 до 20 мг.Слайд 56 В определенных метаболических условиях, когда происходит интенсивное окисление
жирных кислот, в печени образуются значительные количества так называемых кетоновых
тел.Слайд 57 Состояние организма, при котором концентрация кетоновых тел в
крови выше нормальной, называется кетонемией. Повышенное содержание кетоновых тел в
моче называется кетонурией. В тех случаях, когда имеет место выраженная кетонемия и кетонурия, в выдыхаемом воздухе ощущается запах ацетона.Слайд 58
Он обусловлен спонтанным декарбоксилированием ацетоацетата в
ацетон. Эти три симптома - кетонемия, кетонурия и запах ацетона
при дыхании объединяются общим названием - кетозСлайд 59
Кетоз возникает в результате недостатка доступных
углеводов. Например, при голодании их мало поступает (или не поступает)
с пищей, а при сахарном диабете, вследствие недостатка гормона - инсулина, когда глюкоза не может эффективно окисляться в клетках органов и тканей.Слайд 60
Это приводит к дисбалансу между этерификацией и
липолизом в жировой ткани в сторону интенсификации последнего. Он обусловлен
спонтанным декарбоксилированием ацетоацетата в ацетон.Слайд 62
Количество ацетоацетата, которое восстанавливается в β-гидроксибутират, зависит
от соотношения НАДН/НАД+. Восстановление это происходит под влиянием фермента β-гидроксибутиратдегидрогеназы.
Печень служит главным местом образования кетоновых тел благодаря высокому содержанию ГОМГ-КоА синтетазы в митохондриях гепатоцитов.Слайд 64Биосинтез ХС
ХС синтезируется гепатоцитами( 80%), энтероцитами (10%) , клетками почек
(5%), и кожей.
В сутки образуется 0.3-1 г ХС( эндогенный пул).
Слайд 65 Функции ХС:
Непременный
участник клеточных мембран
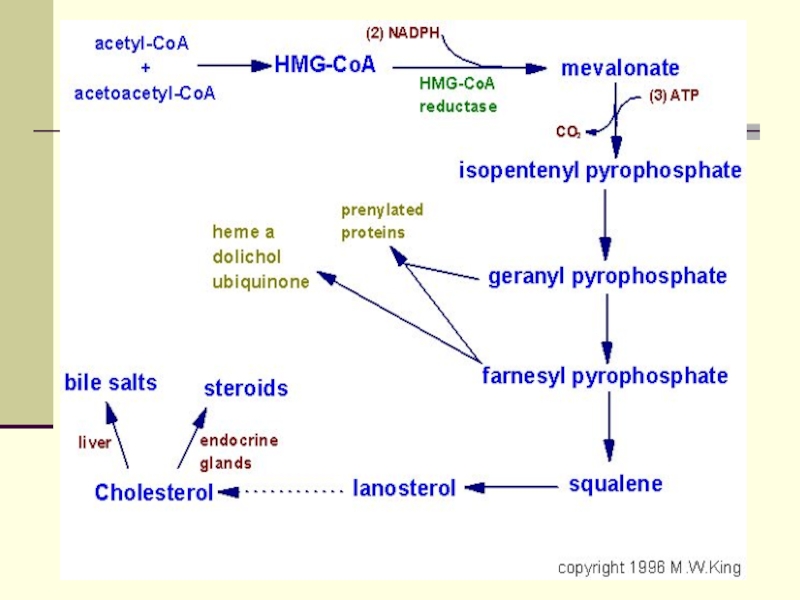
Предшественние стероидных гормонов
Предшественник желчных кислот и витамина Д
Слайд 66 Ежесуточно человек потребляет от 2-3г ХС. Процесс биосинтеза
ХС включает в себя более 35 энзиматических реакций.
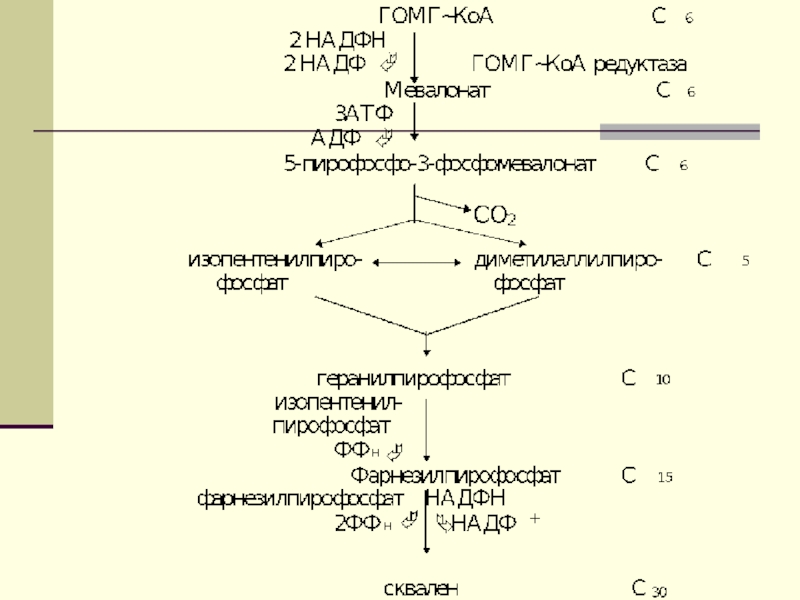
В них выделяют
3 стадии:Превращение ацетил-КоА в мевалоновую кислоту
Образование сквалена из мевалоновой кислоты
Превращение сквалена в ХС