Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты 3 новый.ppt
Содержание
- 1. Ферменты 3 новый.ppt
- 2. Слайд 2
- 3. Слайд 3
- 4. При знакомстве с материалом по кинетике ферментов могло
- 5. У ферментов, подчиняющимся принципам кинетики Михаэлиса и
- 6. Поэтому природа вынуждена обратиться к "кооперативным" системам,
- 7. Графически результат работы такой кооперативной системы (график
- 8. Слайд 8
- 9. Аллостерический белок определяется как белок, содержащий два
- 10. Кооперативность - это модификация константы связывания (Кs)лиганда,
- 11. Км обычно принимается как константа связывания
- 12. Слайд 12
- 13. Значения Vmax и Km определяются при экстраполяции
- 14. Два лиганда один из которых влияет на
- 15. У аллостерических ферментов особые свойстваПолимерная структураСигмоидная (
- 16. Слайд 16
- 17. Центральная линия графика - типичная сигмовидная кривая
- 18. Ингибитор увеличил сигмовидную форму, удлиняя «носок» кривой,
- 19. Денатурация – нарушение пространственной структуры фермента с
- 20. Инггибиторы бывают обратимые и необратимыеВещества со свойствами
- 21. Следствием такого связывания обратимого ингибитора является эффективное
- 22. Необратимые ингибиторы известны также как
- 23. Среди примеров необратимо действующих ингибиторов можно назвать
- 24. ДИПФФ ковалентно связывается
- 25. Ацетилсалициловая кислота (известный всем
- 26. Ингибитором синтеза протеогликанов стенки
- 27. Различают два механизма конкурентного торможения.1.Конкурентное торможение путем
- 28. Если связывание субстрата
- 29. И субстрат и
- 30. Конкурентные ингибиторы не влияют на Vmax, они
- 31. Малоновая кислота тормозит активность
- 32. Конкурентное торможение путем изменения конформации фермента.
- 33. Регуляция активности ферментов путем химической модификации: Реакции
- 34. Активность фермента можно изменить
- 35. Гормональная регуляция активности ферментовОсуществляется при: -функционировании АЦ
- 36. Регуляция активности ферментов Гормональная регуляция
- 37. Аденилатциклазный комплексВ ходе этого процесса образуется небелковое
- 38. В ходе этого процесса
- 39. См. мультимедийную презентацию-Сигнальная трансдукция.
- 40. Гормон, циркулирующий в крови,
- 41. Уровень, образовавшийся под действием
- 42. Наибольшее значение имеет цГМФ.
- 43. цГМФ оказывает эффекты противоположные цАМФ.
- 44. Аденилатциклазный механизм
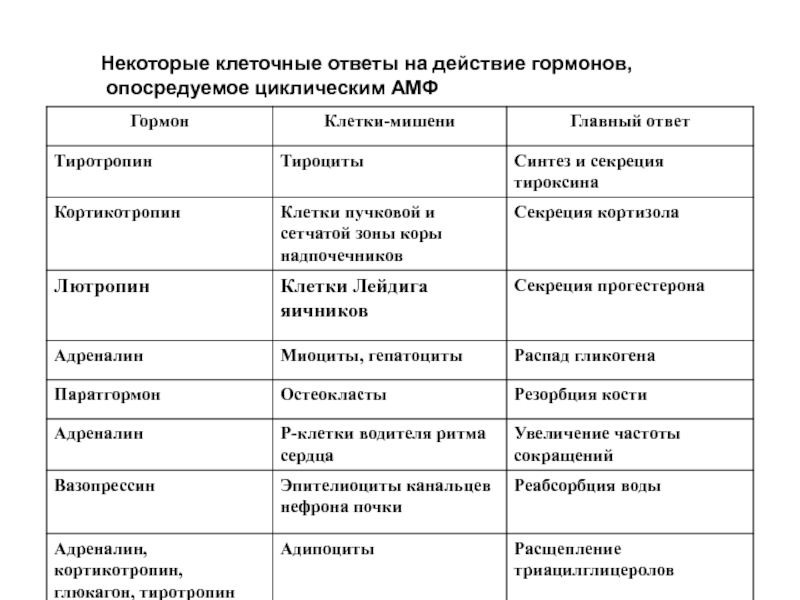
- 45. Некоторые клеточные ответы на действие гормонов, опосредуемое циклическим АМФ
- 46. ИФ3 обеспечивает повышение уровня кальция
- 47. Слайд 47
- 48. Сигнальные роли ДАГ
- 49. Если ИФ3 повышает концентрацию
- 50. Фермент, активируемый ДАГ, называется протеинкиназой С (ПКС)
- 51. Связывание диацилглицерола изменяет конформацию протеинкиназы С, что
- 52. С-киназа, активированная диацилглицеролом и Са2+, переносит концевую
- 53. Концентрация С-киназы выше всего в нейронах головного
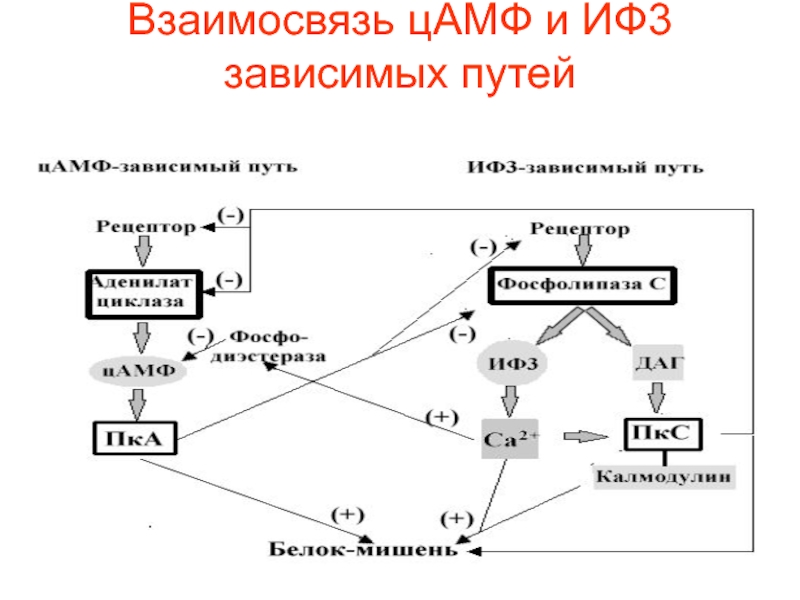
- 54. Взаимосвязь цАМФ и ИФ3 зависимых путей
- 55. Изоферменты, их природа, биологическая роль, строение ЛДГ.Изоферменты
- 56. Изоферменты
- 57. 1) скоростью катализа; 2) направлением катализируемой
- 58. Тетрамерный фермент, состоящий из двух кодируемых генетически
- 59. Изоферменты имеют адаптивное значение, т.
- 60. ЛДГ4, и 5 в печени: ПВК
- 61. Существует 5 изоферментных форм: HHHH
- 62. Остальные изоферменты занимают промежуточное положение.
- 63. Изменение активности ферментов в онтогенезе. Онтогенез человека
- 64. Глюкоза утилизируется анаэробным путем (анаэробный
- 65. 3. Грудной Потребность в глюкозе
- 66. 6. Зрелый. Происходит стабилизация массы
- 67. Активная регуляция ферментов возможна -
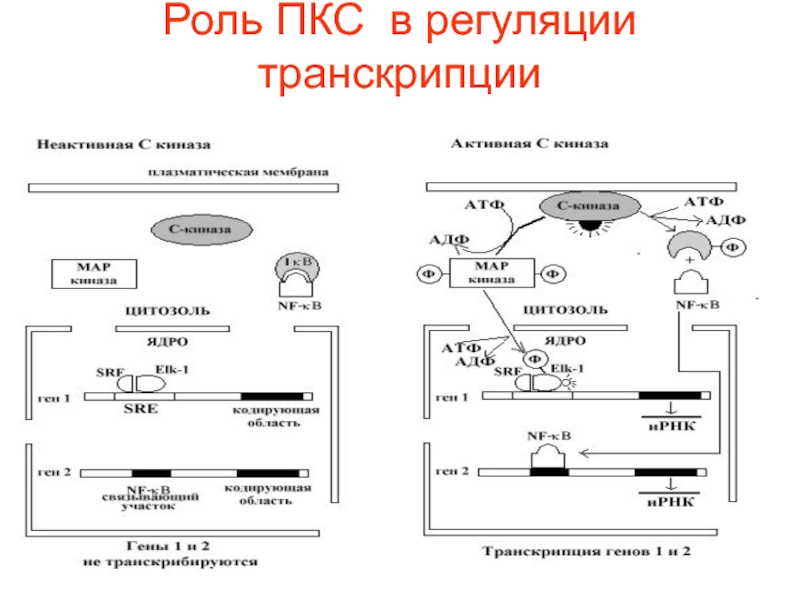
- 68. Роль ПКС в регуляции транскрипции
- 69. Известны два внутриклеточных пути,
- 70. Elk-1 связан с короткой
- 71. В другом пути, активация
- 72. Существует группа соединений, среди которых
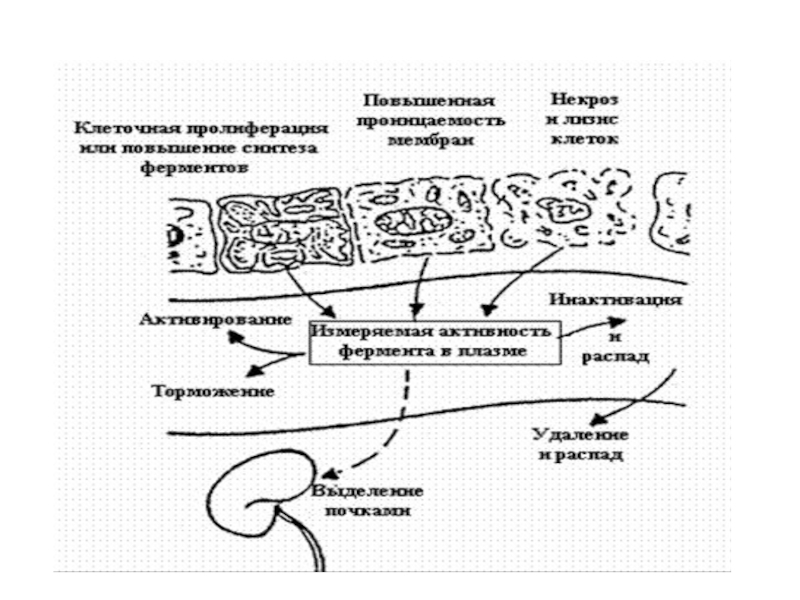
- 73. Метаболизм ферментовПревращение ферментов сходно с обменом других
- 74. Слайд 74
- 75. Имея высокую молекулярную массу, большая
- 76. Активность фермента Активность - это
- 77. Понятие "активность фермента" по сути
- 78. В системе СИ
- 79. Размерность её слишком велика,
- 80. В практике лабораторий широко
- 81. При исследовании кинетики реакций
- 82. Пример для вычисления активности фермента Исходные
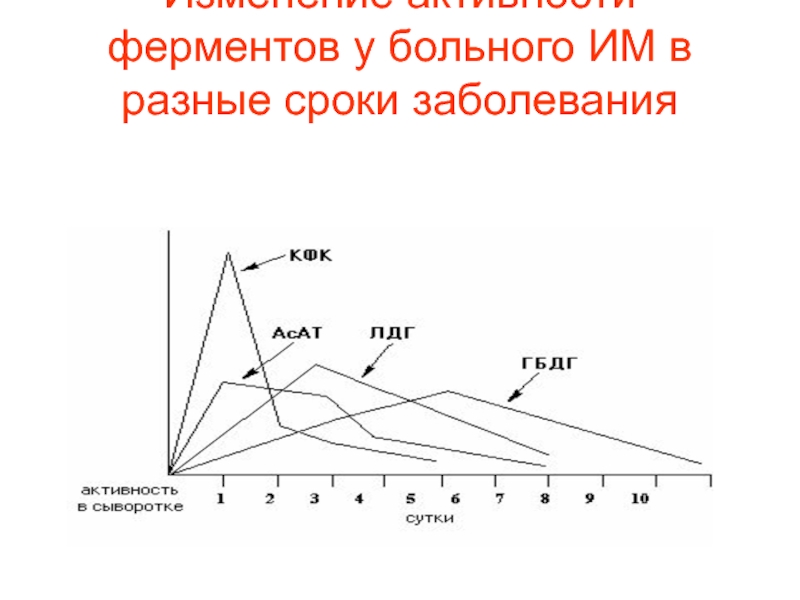
- 83. Изменение активности ферментов у больного ИМ в разные сроки заболевания
- 84. Номенклатура и классификация ферментовКаждый фермент получает специфический
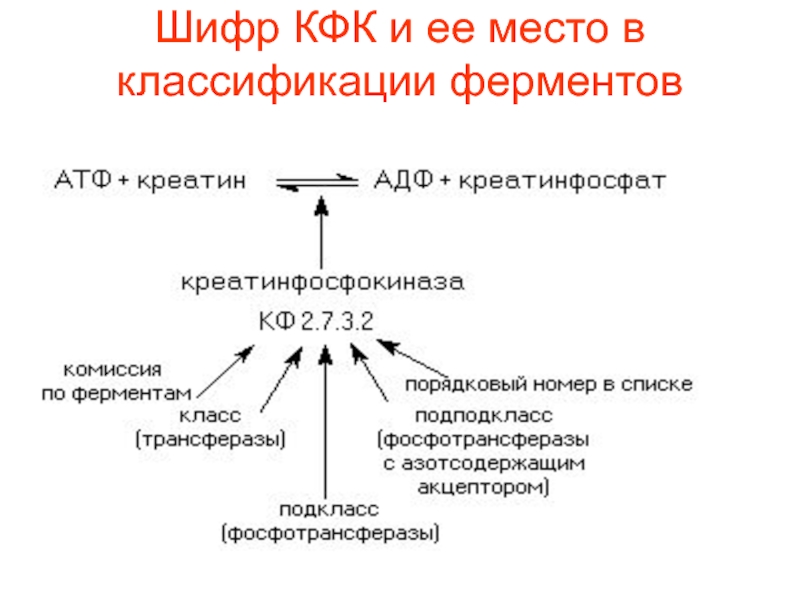
- 85. Шифр КФК и ее место в классификации ферментов
- 86. Каждый подподкласс представляет собой список
- 87. Оксидоредуктазы Оксидоредуктазы (1.0.0.0.) 1.1.0.0. Действуют
- 88. ТрансферазыТрансферазы (2.0.0.0.)2.1.0.0.Переносят одноуглеродные
- 89. Гидролазы (3.0.0.0.) 3.1.0.0.Действуют на
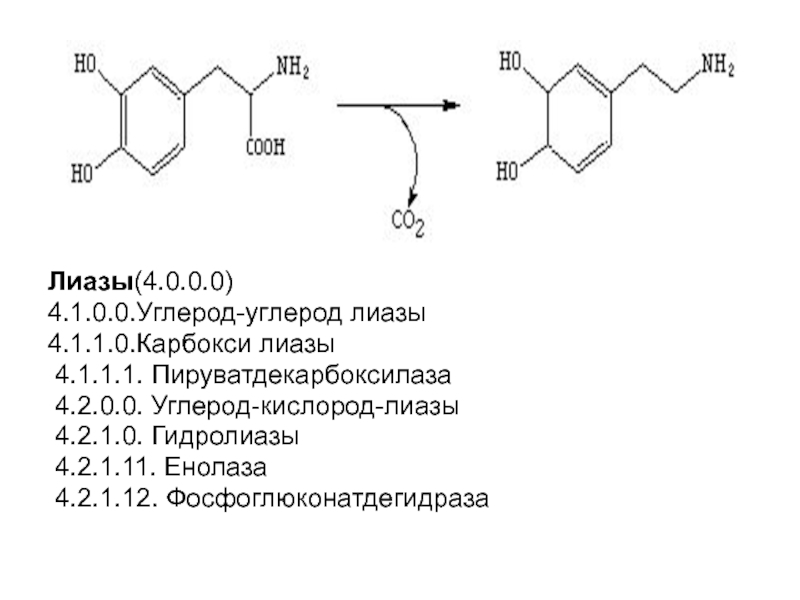
- 90. Лиазы(4.0.0.0)4.1.0.0.Углерод-углерод лиазы4.1.1.0.Карбокси лиазы 4.1.1.1. Пируватдекарбоксилаза 4.2.0.0. Углерод-кислород-лиазы 4.2.1.0. Гидролиазы 4.2.1.11. Енолаза 4.2.1.12. Фосфоглюконатдегидраза
- 91. Лигазы (6.0.0.0) 6.1.0.0. Образуют
- 92. Ферменты 4
- 93. Скачать презентанцию
Содержание:1.Механизм регуляции активности ферментов. Аллостерическая регуляция.2.Характеристика аллостерических ферментов. Виды ингибирования( обратимое, необратимое, конкурентное, неконкурентное, бесконкурентное)3. Регуляция активности путем химической модификации ферментов.4.Изоферменты.5.
Слайды и текст этой презентации
Слайд 2
Содержание:
1.Механизм регуляции активности ферментов. Аллостерическая регуляция.
2.Характеристика аллостерических ферментов. Виды ингибирования(
обратимое, необратимое, конкурентное, неконкурентное, бесконкурентное)3. Регуляция активности путем химической модификации ферментов.
4.Изоферменты.
5. Изменение активности ферментов в онтогенезе.
Слайд 4При знакомстве с материалом по кинетике ферментов могло сложиться впечатление, что
кинетика всех ферментов основана на принципах Михаэлиса и Ментен.
Кинетика
многих ферментов не подчиняется принципам кинетики Михаэлиса и МентенСлайд 5У ферментов, подчиняющимся принципам кинетики Михаэлиса и Ментен с позиций
процессов, протекающих в клетке, имеется ряд недостатков :
-узкий диапазон допустимых
концентраций субстратов в клетке, способных для удовлетворения потребности, быстро реагировать на условия;- потребность в тонкой регуляции концентраций большинства метаболитов для сохранения нормальной жизнедеятельности.
Слайд 6Поэтому природа вынуждена обратиться к "кооперативным" системам, в которых маленькие
изменения в одном параметре, например концентрации ингибитора, вызывают большие изменения
в скорости. Существует большое семейство ферментов, которые представляют собой кооперативные системы. Это аллостерические ферментыСлайд 7Графически результат работы такой кооперативной системы (график зависимости скорости реакции
от концентрации субстрата) выражается не гиперболой, а S-образной сигмоидной кривой
(сигмоидальные кривые всегда сдвинуты вправо в сравнении с гиперболойСлайд 9Аллостерический белок определяется как белок, содержащий два или больше топологически
различающихся центра связывания лигандов (субстраты, ингибиторы и т.д), которые функционально
взаимодействуют друг с другом. Связывание лиганда, с одним центром изменяет свойства другого (их).Большая часть аллостерических белков – аллостерические ферменты, но некоторые белки, типа гемоглобина, выполняют и другие функции.
Слайд 10Кооперативность - это модификация константы связывания (Кs)лиганда, белком, предшествующим связыванию
другого лиганда. Константы связывания - подобны Ks для субстрата или
Ki для ингибитора,и являются в основном константами диссоциации белка и лиганда.Это указывает на силу связывания, или сродство белка и лиганда.Слайд 11 Км обычно принимается как константа связывания субстрата, поскольку ее
проще измерять, чем Ks. Понятие кооперативность означает, что связывание одного
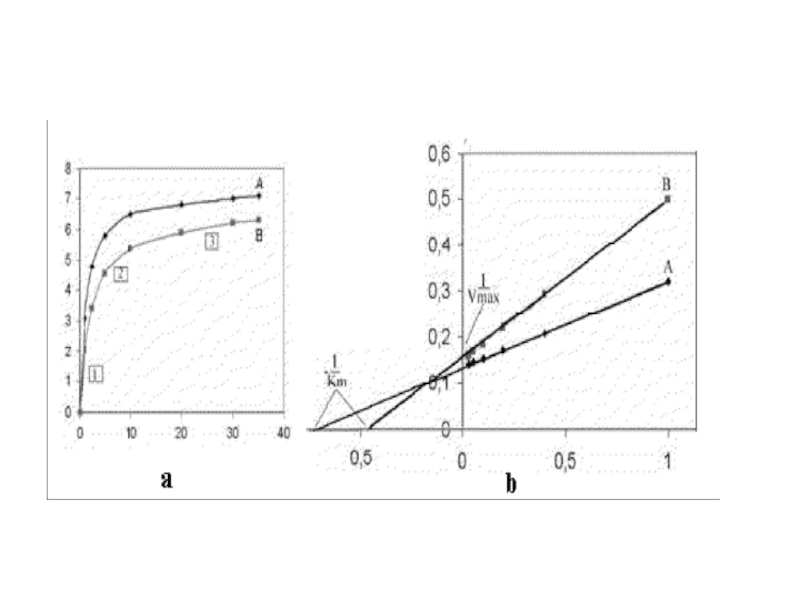
лиганда с белком, либо увеличит, либо уменьшит способность белка, связывать вторую молекулу лиганда. Если модификация увеличивает способность связывания (или сродство), это называют положительной кооперативностью. Если способность связывания снижается - это отрицательная кооперативность.Слайд 13Значения Vmax и Km определяются при экстраполяции линий до пересечения
с осью абсцисс и ординат. Как видно исследуемый фермент отличается
по значению Км от Км контрольного фермента более высокими значениями, что может свидетельствовать о более низком сродстве этого фермента к субстрату и возможном дефекте ферментаСлайд 14Два лиганда один из которых влияет на связывание другого, могут
быть химически идентичны, например, одна молекула субстрата, изменяет связывание другой
молекулы субстрата. Такое взаимодействие называют гомотропным эффектом. Если они химически различаются, например, влияние ингибитора на связывание субстрата, тогда это - гетеротропный эффект.Слайд 15У аллостерических ферментов особые свойства
Полимерная структура
Сигмоидная ( в отличие от
гиперболической для не аллостерических) форма кривой зависимости скорости реакции от
концентрация субстратаСуществование эффекторов
Двухфазный ответ на конкурентные ингибиторы
Потеря аллостерических свойств при денатурации
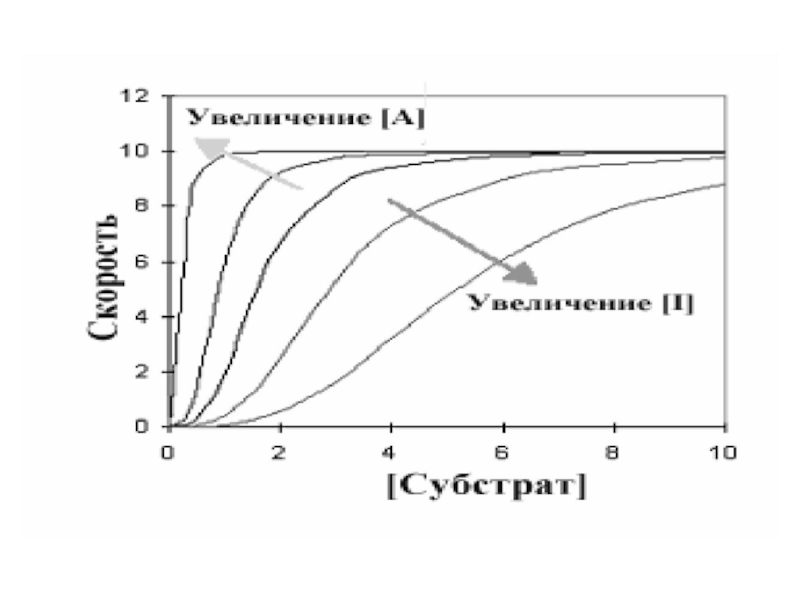
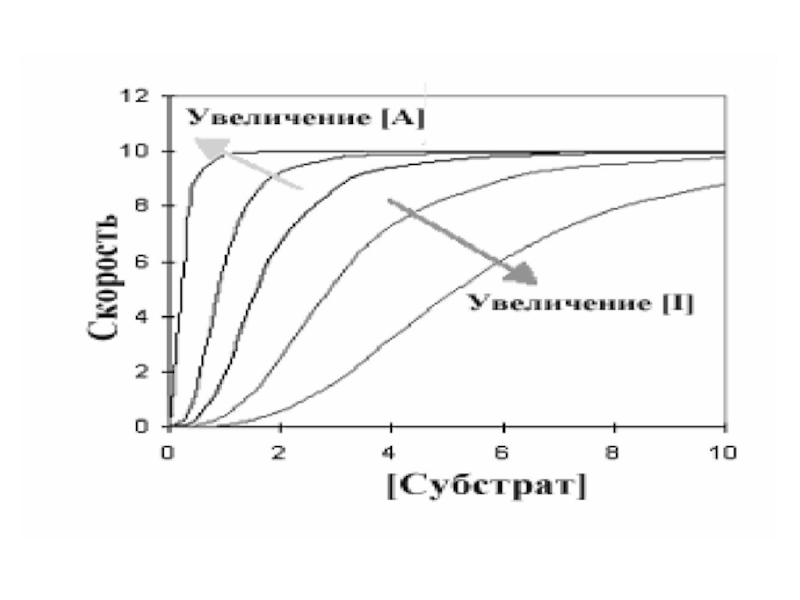
Слайд 17Центральная линия графика - типичная сигмовидная кривая в отсутствии любого
эффектора. В присутствии активатора (А) скорость реакции повышается при любой
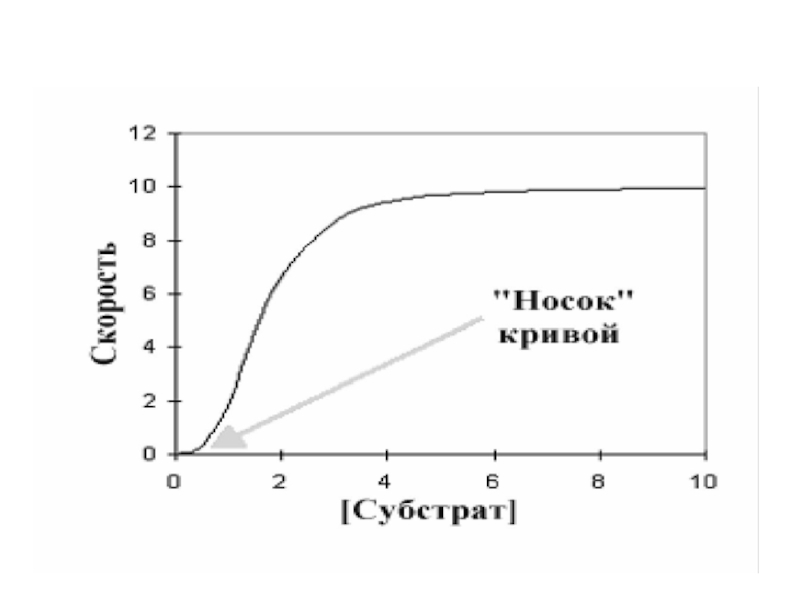
данной концентрации субстрата, в то время как ингибитор уменьшает скорость реакции. Интересны и изменения общей формы кривой по сравнению с центральной линией.Слайд 18Ингибитор увеличил сигмовидную форму, удлиняя «носок» кривой, в то время
как активатор оказывал противоположный эффект. При более высокой концентрации активатора
график в целом приобретает характер гиперболы. Это указывает на то, что аллостерический ингибитор увеличивает уровень субстратной кооперативности, в то время как активатор уменьшает его.Слайд 19Денатурация – нарушение пространственной структуры фермента с последующей потерей активности
фермента. Денатурация вызывается рядом факторов, включая высокую температуру, экстремальные значения
рН и химические денатурирующие реактивы типа мочевины.Слайд 20Инггибиторы бывают обратимые и необратимые
Вещества со свойствами ингибиторов ферментов можно
грубо разделить на обратимые и необратимые. Обратимые ингибиторы связываются с
ферментом, используя слабые связи, подобные тем, которые используются ферментом в связывании субстрата. Эти связи формируются быстро, но также быстро и легко разрушаютсяСлайд 21Следствием такого связывания обратимого ингибитора является эффективное мгновенное действие, но
после удаления ингибитора фермент сохраняет свою активность. Ингибитор находится в
равновесии с ферментом, формируя комплекс ингибитора фермента: Е + I ->EI (реакция обратима).Слайд 22 Необратимые ингибиторы известны также как инактиваторы фермента. Они
связываются с ферментом, формируя прочные, обычно ковалентные связи: Необратимые ингибиторы
известны также как инактиваторы фермента. Они связываются с ферментом, формируя прочные, обычно ковалентные связи:E+I = EI (реакция необратима).
Слайд 23Среди примеров необратимо действующих ингибиторов можно назвать диизопропилфторфосфат (ДИПФФ). Это
соединение вошло в историю энзимологии как соединение использовавшееся для исследования
роли химических групп в в структуре активного центра.Слайд 24 ДИПФФ ковалентно связывается с гидроксильной группой
серина и если эта группа важна в катализе реакции, фермент
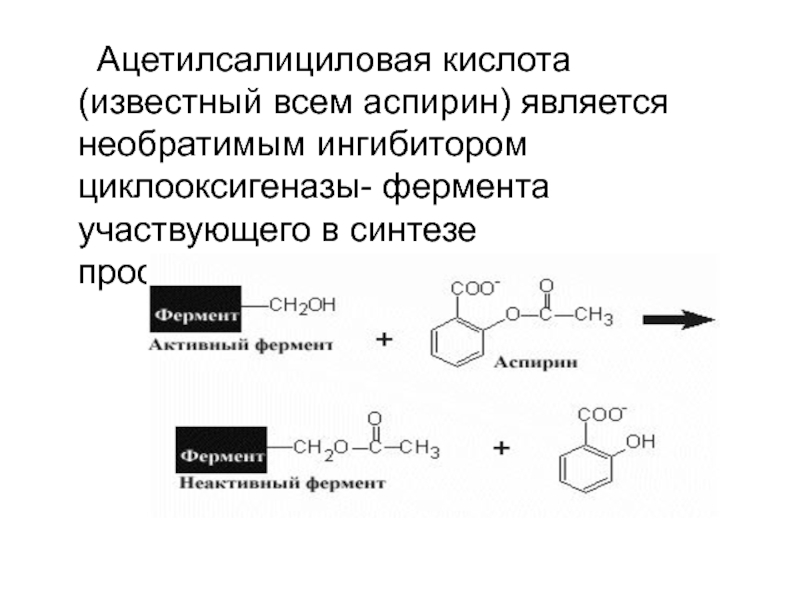
терял свою активность. Эти исследования позволило выявить группу ферментов, в активном центре которых активную роль играет серин (сериновые протеазы).Слайд 25 Ацетилсалициловая кислота (известный всем аспирин) является необратимым
ингибитором циклооксигеназы- фермента участвующего в синтезе простагландинов.
Слайд 26 Ингибитором синтеза протеогликанов стенки бактерий является пенилиллин,
структура которого напоминает D-аланин, встраиваемый в структуру протеогликанов. Связываясь с
активным центром фермента бактерии благодаря своей схожести с переходным состоянием промежуточного продукта в активном центре, пенициллин образует ковалентную связь и тормозит работу ферментаСлайд 27Различают два механизма конкурентного торможения.
1.Конкурентное торможение путем связывания активного центра.
2. Конкурентное торможение путем изменения конформации фермента.
Слайд 28 Если связывание субстрата с АЦ фермента
предшествует изменению конформации центра связывания ингибитора, то последний не связывает
фермент.Слайд 29 И субстрат и ингибитор не могут
одновременно связаться с ферментом. В этом виде конкурентного торможения ингибитор
может иметь любую химическую структуру, поскольку они связываются с различными участками фермента.Слайд 30Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
Оказывая
эффект на:
Km, тем самым оказывают Эффект на
Vmax Наиболее часто приводимый пример конкурентного ингибирования - это использование малоновой кислоты для торможение дегидрогеназы янтарной кислоты. Наиболее близким структурным аналогом сукцината является малоновая кислота.
Слайд 31 Малоновая кислота тормозит активность дегидрогеназы янтарной кислоты,
занимая активный центр на ферменте. Учитывая обратимость реакции, избыток янтарной
кислоты снимет действие малоновой кислоты.Слайд 32Конкурентное торможение путем изменения конформации фермента.
В отличие
от классического варианта, ингибитор связывается не с активным центром, а
со специальным центром, связывающим ингибитор, который расположен вдали от активного центра. Связывание ингибитора вызывает изменение пространственной структуры (изменение конформации) в области активного центра, которое не позволяет присоединиться субстрату.Слайд 33Регуляция активности ферментов путем химической модификации: Реакции ограниченного протеолиза, аденилирования,
рибозилирования, ацетилирования, фосфорилирования (роль гормонов, АЦ-комплекса, цАМФ, цГМФ, ионов Ca).
Слайд 34 Активность фермента можно изменить путем ковалентной модификации
его структуры.
Ковалентная модификация структуры ферментов может быть
обратимой и необратимой. Слайд 35Гормональная регуляция активности ферментов
Осуществляется при:
-функционировании АЦ комплекса,
- с помощью
вторичных посредников-
цАМФ, цГМФ, Са-Кальмодулина, ИТФ,
ДАГ, NO, олигоаденилатами.
Слайд 36Регуляция активности ферментов
Гормональная регуляция осуществляется на генетическом
уровне путем обратного фосфорилирования, и осуществляется при:
-функционировании АЦ комплекса,
-
с помощью вторичных посредников-- цАМФ, цГМФ, Са-Кальмодулина, ИТФ,
- ДАГ, NO, олигоаденилатами.
Слайд 37Аденилатциклазный комплекс
В ходе этого процесса образуется небелковое соединение - цАМФ,
цАМФ - внутриклеточный гормон (вторичный посредник) яв-ся аллостерическим регулятором большого
числа протеинкиназ. цАМФ образуется из АТФ под действием фермента-аденилатциклазыСлайд 38 В ходе этого процесса образуется небелковое соединение
- цАМФ, цАМФ - внутриклеточный гормон (вторичный посредник) яв-ся аллостерическим
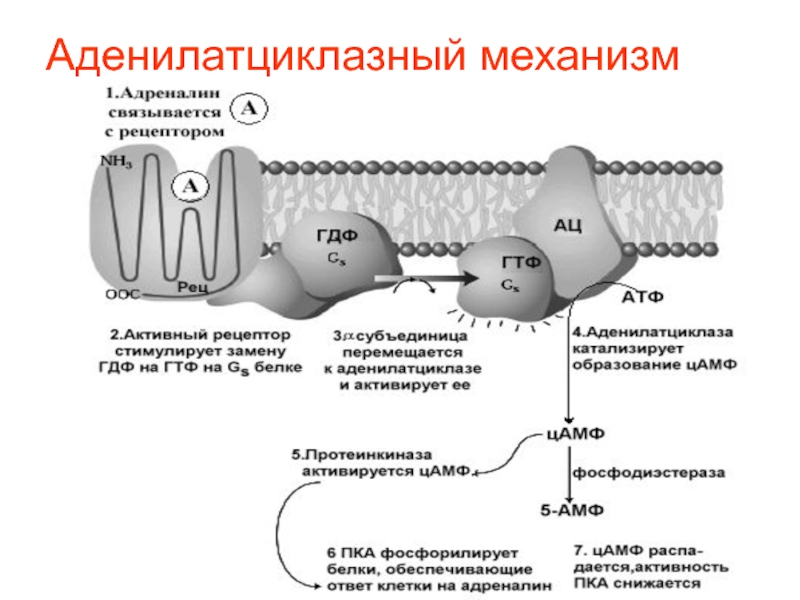
регулятором большого числа протеинкиназ. цАМФ образуется из АТФ под действием фермента-аденилатциклазы.Слайд 40 Гормон, циркулирующий в крови, попадает в межклеточную
жидкость и контактирует с поверхностью клетки, где расположены рецепторы (Rs
и Ri), белки узнающие и связывающие гормон.Гормональный сигнал поступает на АЦ через белки посредники (Gs и Gi), которые активируются в условиях присоединения ГТФ.
Слайд 41 Уровень, образовавшийся под действием АЦ, цАМФ определяется
не только активностью АЦ, но и активностью фосфодиэстераз, которые циклизируют
цАМФ до АМФ.Кроме цАМФ, существуют цГМФ, цУМФ, цЦМФ.
Слайд 42 Наибольшее значение имеет цГМФ. Она образуется под
действием гуанилатциклазы, расположенной как в наружной мембране, так и внутри
клетки, цГМФ единственный фермент, который реагирует на концентрацию Н2О2 и активируется под действием продуктов перекисного окисления.Слайд 43 цГМФ оказывает эффекты противоположные цАМФ.
цАМФ находится
в тесном контакте с ионами Ca2+: высокая концентрация цАМФ в
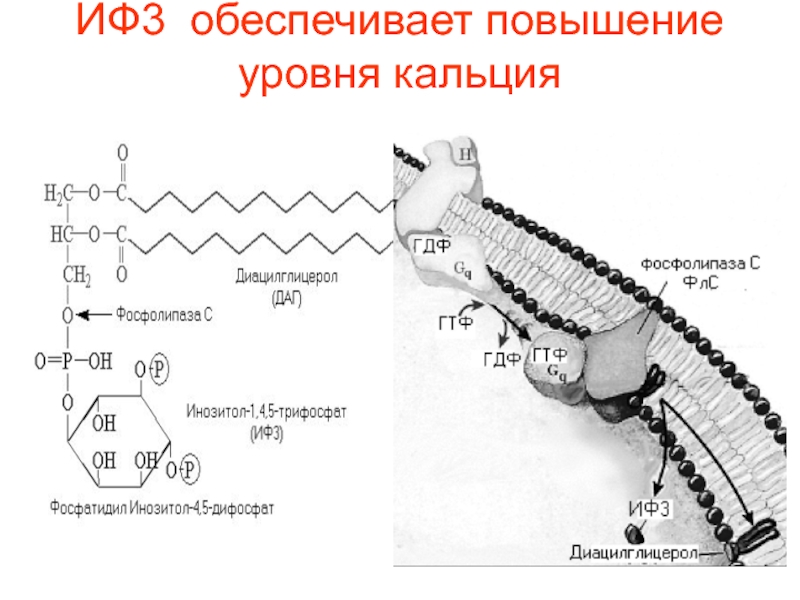
возбудимых тканях приводит к высокой [Ca2+] и стимуляции клетки. И наоборот, резкое уменьшение [Ca2+] тормозит АЦ и снижает уровень цАМФ.Слайд 49 Если ИФ3 повышает концентрацию ионов Са2+ в
цитозоле, другой продукт расщепления фосфатидилинозитол -4,5- дифосфата – ДАГ –
остается в плазматической мембране и вызывает совершенно иные молекулярные эффекты. У него есть две "сигнальные" роли: он может гидролизоваться дальше с образованием арахидоновой кислоты, необходимой для синтеза простагландинов и родственных им медиаторов липидной природы, или способен активировать специфическую протеинкиназу, которая затем фосфорилирует ряд белков с различными функциями в клетке-мишени.Слайд 50Фермент, активируемый ДАГ, называется протеинкиназой С (ПКС) или С–киназой, так
как активность его зависит от уровня Са2+ в цитозоле клетки.
Полипептидная цепь этого фермента содержит четыре консервативных домена и пять вариабельных областей. Консервативные области включают АТФ-, Са2+ - , диацилглицерол- и субстрат-связывающий домены. При низком внутриклеточном уровне Са2+ и отсутствии диацилглицерола протеинкиназа С находится в цитоплазме в неактивном состоянии.Слайд 51Связывание диацилглицерола изменяет конформацию протеинкиназы С, что сопровождается повышением ее
сродства к ионам Са2+ и липидам. Это приводит к связыванию
протеинкиназы С с цитоплазматической поверхностью плазматической мембраны и переводу фермента в активное состояние. Активация С-киназы кратковременна, так как через несколько секунд диацилглицерол фосфорилируется до фосфатидной кислоты или расщепляется с высвобождением арахидоновой кислоты.Слайд 52С-киназа, активированная диацилглицеролом и Са2+, переносит концевую фосфатную группу с
АТФ на специфические сериновые или треониновые остатки белков-мишеней, которые в
разных клетках различны. Например, во многих животных клетках С-киназа фосфорилирует и тем самым активирует Na+/H+ обменный насос плазматической мембраны, контролирующий внутриклеточный рН.Слайд 53Концентрация С-киназы выше всего в нейронах головного мозга, где, помимо,
прочего она фосфорилирует ионные каналы нейронов и, изменяя их проницаемость,
может влиять на возбудимость этих клеток.В некоторых клетках активация С - киназы усиливает транскрипцию определенных генов.
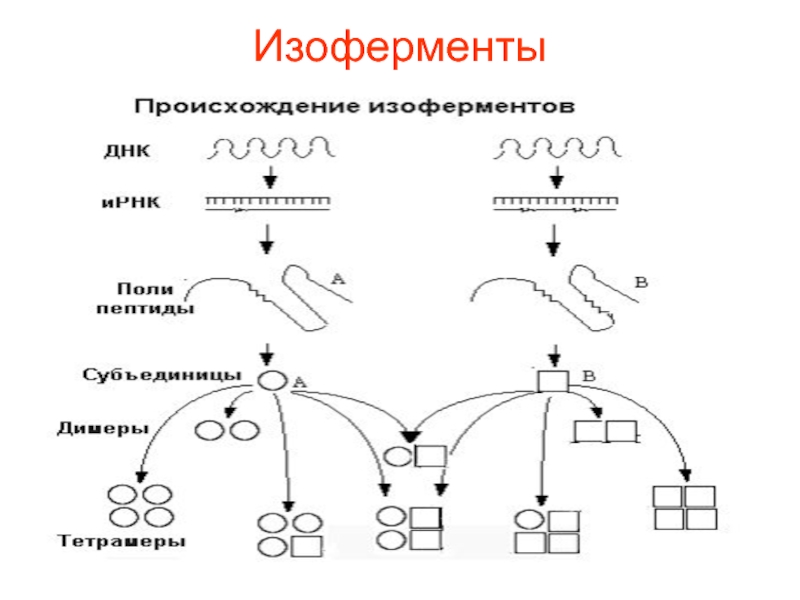
Слайд 55Изоферменты, их природа, биологическая роль, строение ЛДГ.
Изоферменты - это группа
родственных ферментов, катализирующих одну и ту же реакцию. Они происходят
из одного предшественника за счет дупликациии гена с последующей мутацией образуемых аллелей. Они отличаются между собой:Слайд 57 1) скоростью катализа;
2) направлением катализируемой реакции;
3) условиями
протекания реакции;
4) чувствительностью к регуляторам, факторам среды. (Более или менее
устойчивы к ингибиторам);5) сродством к субстрату;
6) особенностями структуры молекулы, ее ИЭТ, Mr, размерами и зарядом.
Слайд 58Тетрамерный фермент, состоящий из двух кодируемых генетически субъединиц А и
В может быть представлен пятью изоферментами А4, АЗВ1, А2В2, А1ВЗ
и В4. Каждый из изоферментов может катализировать одинаковую реакцию, но отличается по своим свойствам, что важно при использовании этих ферментов в разных условиях. Таким путем Природа «экономит» генетический материал, создавая многообразие.Слайд 59 Изоферменты имеют адаптивное значение, т. е. придают специфику
метаболизма.
Изоферменты обеспечивают межорганную связь, например, в процессе мышечной
деятельности. В миокарде и печени существуют различные изоферменты ЛДГ, которые обеспечивают метаболизм лактата:
Слайд 60 ЛДГ4, и 5
в печени: ПВК -----> лактат
ЛДГ1,
и 2
в сердце: лактат ------> ПВК
ЛДГ - олигомерный
фермент, состоящий из 4-х субъединиц 2 типов.H (heart) и M (muscle).
Слайд 61 Существует 5 изоферментных форм:
HHHH HHHM HHMM HMMM
MMMM
H4 H3M H2M2 HM3
M4ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5.
Поскольку H-протомеры несут более выраженный отрицательный заряд, то изофермент H4 (ЛДГ1) будет мигрировать при электрофорезе с наибольшей скоростью к аноду.
С наименьшей скоростью к аноду будет двигаться М4.
Слайд 62 Остальные изоферменты занимают промежуточное положение.
Изоферменты ЛДГ
локализованы в различных тканях:
ЛДГ1,2 ----> мозг, аэробные ткани
(миокард).ЛДГ3 ----> лейкозные клетки.
ЛДГ4,5 ----> анэробные ткани: мышечная, скелетная.
Изоферменты появляются на различных этапах онтогенеза и реализуют программу индивидуального развития.
Изоферментный профиль меняется в процессе развития.
При патологиях имеется существенный изоферментный сдвиг.
Слайд 63Изменение активности ферментов в онтогенезе.
Онтогенез человека развивается по определенной
генетической программе, которая записана на уровне ткани, всего организма в
гипоталамусе.1. Внутриутробный период.
Характеризуется высокой активностью ферментов синтеза белка, липидов, происходит увеличение массы организма. Плод находится в анаэробных условиях и для метаболизма характерно анаэробная направленность.
Основной источник энергии - жирные кислоты, поступающие из организма матери; ЖК также выполняют строительную функцию (фосфолипиды мембран).
Слайд 64 Глюкоза утилизируется анаэробным путем (анаэробный гликолиз), т. к.
ткани плода не способны к ГНГ, и идет на развитие
ЦНС.2. Пренатальный период.
Характеризуется изменением активности ферментов, происходит подготовка организма к пребыванию в аэробной среде. Изменяется спектр гемоглобина, уменьшается его сродство к кислороду, изменяется активность митохондриальных ферментов
Слайд 65 3. Грудной
Потребность в глюкозе резко возрастает, она
начинает утилизироваться аэробно, но примерно до двух лет основным источником
энергии является все же липиды, причиной чего является соматотропин. (Гормон роста).4. Ранний дошкольный период.
С 3-х до 5-и лет. В этот период клетки начинают питаться углеводами. Происходит стабилизация обмена и интенсивная миелизация нервных волокон.
5. Школьный и пубертантный период.
Обмен веществ модулируется под действием половых гормонов
Слайд 66 6. Зрелый.
Происходит стабилизация массы тела, репродуктивного гомеостаза.
После 35-40 лет основным источником энергии являются опять липиды, что
связано с ослаблением чувствительности тканей к Гл и изменение гормонального фона: гиперстресс (увеличивается уровень гормонов) заставляет клетку работать на пределе, т. е. использовать в качестве энергии жиры.Слайд 67 Активная регуляция ферментов возможна - на геномном уровне
( лактозный оперон);
Регуляция конститутивными и индуцибельными ферментами. Синтез
первых не зависит от индуктора, т.к. есть определенный уровень фермента, даже при отсутствии индуктора- это базовый уровень.Индуцибельные ферменты это ферменты ЦСМ, цитохром Р-450, бета-ГОМГ-КоА-редуктаза.
Биосинтез аргиназы увеличивается при повышенном потреблении белков и ускорении ЦСМ.
Биосинтез липазы возрастает при голодании, обеспечивая мышцы, в том числе и миокард жирными кислотами.
Слайд 69 Известны два внутриклеточных пути, через которые активированная
С-киназа усиливает транскрипцию генов. В одном, С-киназа активирует протеинкиназный каскад,
приводяций к фосфорилированию митоген-активируемой протеинкиназы (МАП – киназы), которая фосфорилирует и активирует ген-регуляторный белок Elk-1.Слайд 70 Elk-1 связан с короткой последовательностью ДНК (обозначаемой
serum response element – SRE) и ассоциирован с другим ДНК
- связывающим белком (обозначаемым serum response factor – SRF).Слайд 71 В другом пути, активация С-киназы приводит к
фосфорилированию ингибиторного белка Ik-B, что сопровождается высвобождением из комплекса ген-регуляторного
белка NF – kB, который мигрирует из цитозоля в ядро и активирует транскрипцию соответствующего гена.Слайд 72 Существует группа соединений, среди которых наиболее хорошо изучены
форболовые эфиры, которые являются мощными активаторами ПКС. Они действуют подобно
ДАГ как вторичные посредники, но в отличие от естественного ДАГ, они разрушаются медленно. Постоянно активируя ПКС, эти синтетические вещества вмешиваются в нормальную регуляцию клеточного роста и деления и служат факторами, стимулирующими образование опухолей..Слайд 73Метаболизм ферментов
Превращение ферментов сходно с обменом других белков. Определенный уровень
ферментов в тканях поддерживается их постоянным синтезом и распадом. В
результате гибели клеток ферменты попадают в крвь, где при участии протеаз или в клетках РЭС подвергаются деградации.Слайд 75
Имея высокую молекулярную массу, большая часть ферментов не
экскретируется с мочой. Ферменты экскретируемые с желчью -ЩФ, ГГТП, 5-
нуклеотидаза, аминотрансферазы.Слайд 76Активность фермента
Активность - это изменение количества субстрата
под влиянием фермента в единицу времени. Под изменением субстрата понимают
снижающееся в единицу времени количество субстрата или же увеличивающееся количество продукта.Слайд 77 Понятие "активность фермента" по сути дела идентична понятию
"скорость ферментативной" реакции. Ферментативная активность выражается в единицах активности. В
связи с существованием различных систем единиц исчисления введена интернациональная (стандартная) единица активности. Она носит символ "U" (unit-единица) и определяется как 1 мкмоль субстрата/мин. В системе СИ в качестве единицыСлайд 78
В системе СИ в качестве
единицы ферментативной активности используют "катал" (kat). Катал определяется как 1
моль/сек.1kat = 1 моль/сек.
Слайд 79 Размерность её слишком велика, на практике пользуются
меньшими кратными значениями, начиная с нанокатала (нкат). Это одна миллиардная
катала или 10-9 кат. В сравнении с международной единицей следующее уравнение1 U = 16,67 нкат
Слайд 80 В практике лабораторий широко пользуются понятием удельная
активность. Для этого число cтандартных единиц пересчитывают на какую-либо единицу
сравнения. Это может быть мг белка в пробе или объем исследуемой биологической жидкости. Определение активности ферментов широко распространено в любой современной клинической лаборатории.Слайд 81 При исследовании кинетики реакций используется и такое
понятие как молекулярная активность. Она показывает, сколько молекул субстрата в
секунду превращаются в продукт 1 молекулой фермента и используется для сравнительной характеристики активности нескольких ферментов.Слайд 82Пример для вычисления активности фермента
Исходные данные:25.0 x 10-3
моль л--1 пептида-субстрата,
объем реакционной смеси 2.5 мл,
0.50 µг химотрипсина[1]
Слайд 84Номенклатура и классификация ферментов
Каждый фермент получает специфический кодовый номер-шифр фермента,
отражающий его положение в классификации: первая цифра характеризует класс фермента,
вторая –подкласс и третья подподкласс.Слайд 86 Каждый подподкласс представляет собой список ферментов. Порядковый номер
фермента в этом списке – четвертая цифра кода. Например- показан
шифр креатинфосфокиназы – КФ.2.7.3.2. Этот фермент катализирует реакцию фосфорилирования креатина. Систематическое название фермента АТФ: креатинфосфотрансфераза. Рабочее название этого фермента креатинкиназа или креатинфофокиназаСлайд 87Оксидоредуктазы
Оксидоредуктазы (1.0.0.0.)
1.1.0.0. Действуют на СН-ОН группы
доноров
1.1.1.0. НАД+ или НАДФ+ в качестве акцепторов
1.1.1.1. Алкогольдегидрогеназа 1.14.0.0. Действуют на парные доноры при включении в один из них кислорода
1.14.15.0. Один из доноров восстановленный железо-серный белок и включение одного атома кислорода
1.14.15.1. Цитохром Р-450
1.14.15.5. Кортикостерон 18-монооксигеназа
Слайд 88Трансферазы
Трансферазы (2.0.0.0.)
2.1.0.0.Переносят одноуглеродные
группы
2.1.1.0. Метилтрансферазы
2.1.1.1. Никотинамид метилтрансфераза
2.1.1.45. Тимидилат синтаза
2.3.0.0. Ацилтрансферазы
2.3.1.6. Холинацетил трансфераза
Слайд 89 Гидролазы (3.0.0.0.)
3.1.0.0.Действуют на эфирные связи
3.1.1.0.Гидролазы эфиров карбоновых кислот
3.1.1.17. Ацетилхолинэстераза3.2.1.0. Гликозидгидролазы 3.2.1.1. a-амилаза
3.2.1.2. b-амилаза
3.4.0.0. Действуют на пептидные связи 3.4.21.0.Сериновые протеазы 3.4.21.1.Химотрипсин 3.4.21.4. Трипсин 3.4.21.5. Тромбин