Слайд 1СТРОЕНИЕ АТОМА
Весь мир вокруг нас: объекты и системы, формы движения,
отношений и взаимодействий– материя.
Формы существования материи: движение и время.
Пространственные
характеристики материи: положение тел относительно друг друга, их размеры, тип симметрии, межъядерные расстояния, углы между связями и др.
Временные характеристики: длительность процессов, продолжительность между моментами совершения событий, ритмичность процессов, константа скорости и т.п.
Слайд 2Свойство материи - развитие – изменение, характеризующееся необратимостью, направленностью и
закономерностью.
Материя состоит из различного типа дискретных частиц, находящихся во взаимодействии.
Общие характеристики частиц: масса, заряд, спин, время жизни.
Масса – определяет инерционные и гравитационные свойства.
Виды материи, частицы которых имеют конечную массу покоя называются веществом: протон, электрон и другие.
Электрон – частица, обладающая наименьшей массой. mе=0,91095·10-27г, mпротона=1836mе, mнейтрона=1840mе.
Слайд 3Виды материи частицы которых не имеют массы покоя – поля.
Электрон
имеет заряд –1,602·10-19 Кл. Заряд протона положителен и равен заряду
электрона.
Среднее время жизни электрона в свободном состоянии больше 5·1021лет, а протона 2·1030лет.
Частицы кроме нейтрона устойчивы. Свободный нейтрон находящийся в вакууме нестабилен. Среднее время его жизни около 16 минут. Распадается на протон, электрон и нейтрино:
n = р+е+ν
Соотношение чисел протонов и нейтронов в ядре определяет его устойчивость, и распространенность элемента в природе.
Слайд 4Между элементарными частицами совершаются взаимодействия, которые на сильные, электромагнитные и
слабые.
Сильные: обуславливают связь частиц в атомных ядрах.
Электромагнитные: связывают электроны
с ядрами и образуются молекулы, осуществляют межмолекулярные взаимодействия.
Слабые: взаимодействие нейтрино с веществом.
Слайд 5Энергия – мера движения и взаимодействия всех видов материи.
Каждое
тело, изменяющее энергию (ΔЕ), одновременно изменяет в эквивалентном количестве свою
массу (Δm).
Е=mс2 или Δm=ΔЕ/с2
Если тело теряет энергию, то масса уменьшается и наоборот.
Энергия движущегося тела увеличивается при увеличении скорости его движения и одновременно увеличивается масса движущегося тела.
Слайд 6ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА.
Этапы изучения строения атома:
1) Изучение электрических разрядов
в газах доказало, что атом не является неделимой частицей. Изучение
катодных лучей показало, что они представляют собой быстродвижущиеся отрицательно заряженные частицы.
2) Электрохимические исследования Петрова, Дэви, Фарадея определили электронейтральность атома.
3) В 1897 г. Дж. Томпсон (Англия) открыл электрон.
Слайд 74) В 1909 г. Р. Малликен определил заряд электрона: 1,6·10-19
Кл.
5) В 1910 г. в лаборатории Резерфорда был открыт протон.
6) Первая модель атома Дж. Томпсона – положительно заряженная сфера с вкрапленными электронами.
7) Модель Резерфорда – тяжелое ядро, вокруг которого движутся по орбитам электроны, как планеты солнечной системы.
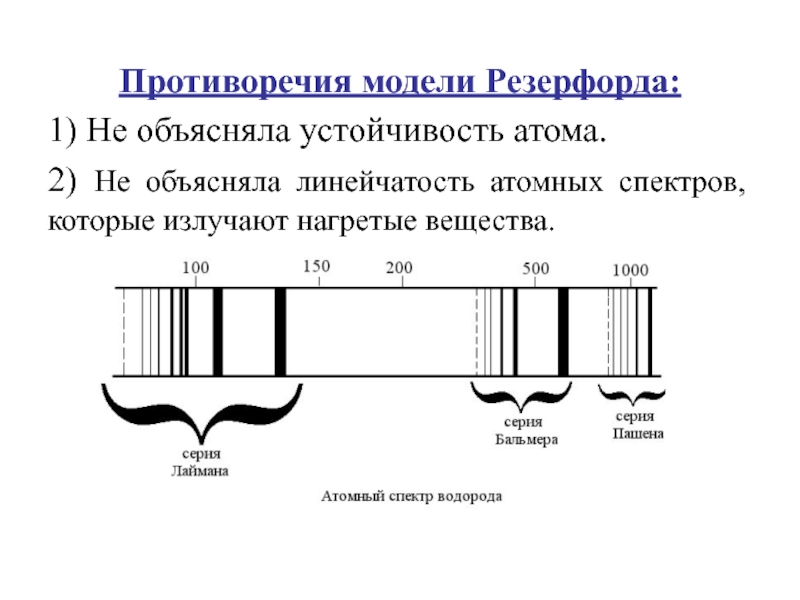
Слайд 8Противоречия модели Резерфорда:
1) Не объясняла устойчивость атома.
2) Не объясняла линейчатость
атомных спектров, которые излучают нагретые вещества.
Слайд 9Связь между частотой ν и энергией
Е=hν,
h–постоянная Планка
6,62·10-34 Дж·с.
Зависимости между линиями спектра:
n и m целые числа,
Кн
= 1,097·107–постоянная Ридберга
Чем меньше n, тем меньшим длинам волн соответствует излучение, и тем больше его энергия.
Слайд 10Наибольшая энергия заключена в УФ- области в спектре линий Лаймана
(n=1) m=2,3,4,5…
Далее идет видимая область или серия Бальмера
(n=2) m=3,4,5…
Серии инфракрасной области: серия Пашена (n=3) m =4,5….
Слайд 11Квантово-механическая модель атома
1) Энергия распространяется и передается, поглощается и испускается
не непрерывно, а дискретно-отдельными порциями.
2) Энергия системы микрочастиц принимает
только определенные значения, которые являются кратными числами квантов.
3) Энергия системы изменяется скачкообразно - квантуется .
Слайд 12Постулат Планка
Энергия (Е) излучается и поглощается отдельными порциями – квантами,
пропорциональными частоте колебаний излучения (υ).
Е = hυ
h – коэффициент
пропорциональности или постоянная Планка h=6,62·10-34 Дж·с.
υ = с/λ
с – скорость света; λ - длина волны.
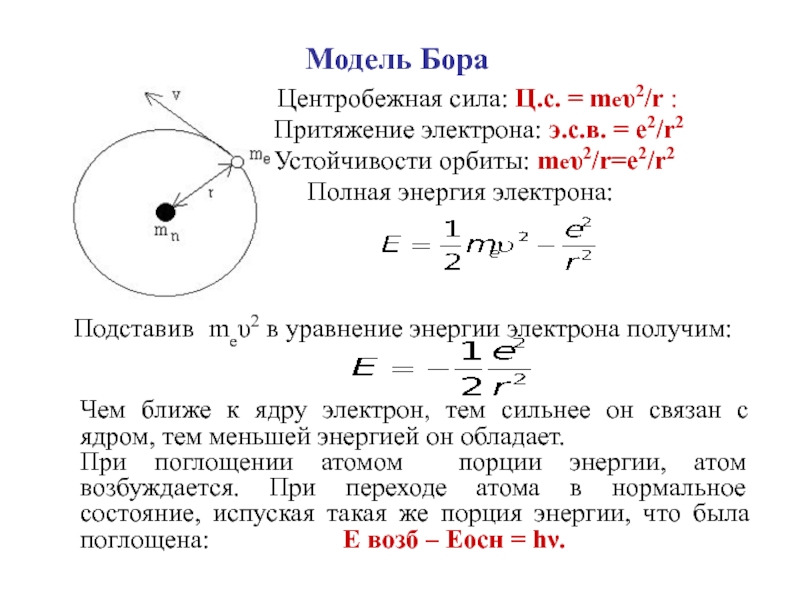
Центробежная сила: Ц.с. = mеυ2/r
:
Притяжение электрона: э.с.в. = е2/r2
Устойчивости орбиты: mеυ2/r=е2/r2
Полная энергия электрона:
Подставив mеυ2 в уравнение энергии электрона получим:
Чем ближе к ядру электрон, тем сильнее он связан с ядром, тем меньшей энергией он обладает.
При поглощении атомом порции энергии, атом возбуждается. При переходе атома в нормальное состояние, испуская такая же порция энергии, что была поглощена: Е возб – Еосн = hν.
Слайд 14Постулаты Бора:
Первый постулат: Атомы могут существовать не изменяя своей энергии,
т.е. не излучая и не поглощая её, только в определенных
состояниях, которые образуют дискретный ряд значений энергий Е1, Е2, Е3…, причем атом, испуская или поглощая энергию, скачкообразно переходит из одного состояния в другое.
Второй постулат: При переходе из одного состояния в другое атом испускает или поглощает только один квант энергии, частота которого определяется из уравнения: ΔЕ = hν.
Энергия электрона: Еn = -13,6(1/n2).
Слайд 15Предположение де Бройля: электроны (как и все частицы) при движении
проявляют свойства волны.
Масса фотона: Е = mс2
Энергия и
частота связаны: Е = hν
Приравняв получим : mс2 = hν
Выразим массу: m= hν/с2 (1)
Импульс фотона: р=mυ = mс (2)
Подставим уравнение (1) в уравнение (2): р=hν/с Длина волны: λ=υ/ν, т.к. р= mυ, то λ = h/р
Уравнение де Бройля: λ = h/(mυ),
h - постоянная Планка, λ - длина волны,
υ – скорость, m – масса частицы
Слайд 16Согласно уравнению де Бройля:
любой частице с массой m, движущейся
со скоростью υ, соответствует волна длины λ.
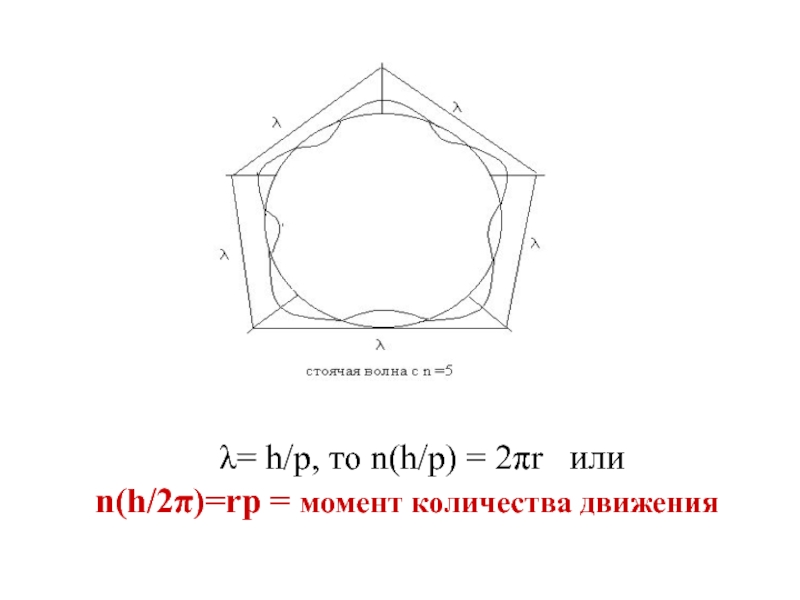
Условие устойчивости орбиты:
чтобы электрон, двигаясь по круговой боровской орбите, образовывал стоячую волну (волновое условие устойчивости орбиты), на длине окружности орбиты должно укладываться целое число волн или
nλ=2πr
λ= h/р, то n(h/р) = 2πr или
n(h/2π)=rр =
момент количества движения
Слайд 18Принцип дополнительности:
Электрон не может одновременно обладать и волновыми,
и корпускулярными свойствами; однако для описания реального поведения электрона необходимо
учитывать и те, и другие свойства, которые взаимно дополняют друг друга.
Слайд 19Материя (вещество и поле) обладает одновременно и корпускулярными и волновыми
свойствами.
С уменьшением массы частицы её волновые свойства усиливаются, а корпускулярные
ослабляются, а у излучений с ростом энергии, или с увеличением частоты и уменьшением длины волны, происходит усиление корпускулярных свойств.
Слайд 20Неопределенность положения и скорости
Условие устойчивости орбиты:
mеυ2/r = е2/r2
Отсюда:
υ2 = е2/mr
(1)
Момент количества движения = h/2π принимает дискретные значения.
Скорость принимает тоже дискретные значения:
υ=nh/2πmr (2)
Слайд 21Приравняв (1) и (2) и вычислим радиус:
r =n2h2/4π2mе2
Радиус принимает
дозволенные, дискретные значения, зависящие от n.
Между собой радиус дозволенных
орбит относятся как квадраты чисел n.
Слайд 22Принцип неопределенности:
В любой момент времени невозможно определить и положение в
пространстве, и скорость (импульс) электрона.
В. Гейзенберг показал, что произведение
неопределенностей в положении (Δх) и в скорости ( или импульсе) электрона (Δv) не может быть меньше определенной величины:
Δх·Δv x ≥ h/(2πm)
Так же и по всем остальным осям.
Слайд 23Волновое уравнение Шредингира
первые три члена – это сумма вторых производных
волновой функции по координатам х, у, z (часто эту сумму
обозначают), m – масса электрона, h – постоянная Планка
Физический смысл волновой функции: её квадрат Ψ2 характеризует вероятность нахождения электрона в данной точке атомного пространства
.
Слайд 24Решение уравнения Шредингира
для атома водорода
ψnlml = [N][Rnl(r)][Фlml (х/r,
у/r, z/r)]
N – постоянная нормировки. Определяется из условия, что
вероятность нахождения электрона где-либо в пространстве равна единице.
Rnl(r) – радиальная часть волновой функции.
/Rnl(r)/2 дает вероятность нахождения электрона на некотором расстоянии r от ядра.
Фlml(х/r, у/r, z/r) – угловая часть волновой функции
Слайд 25ψ зависит от трех пространственных координат.
Электрон может находиться в
любом месте пространства. В области, где значения ψ2 выше, он
пребывает чаще и эти области соответствуют минимальной энергии электрона.
Совокупность мест пространства, где квадрат функции ψ2 имеет максимальное значение, называется электронной орбиталью, или электронным облаком атома.
Вероятность нахождения электрона в сферическом слое радиуса r толщиной dr называется плотностью электронного облака: D = 4πr2ψ2.
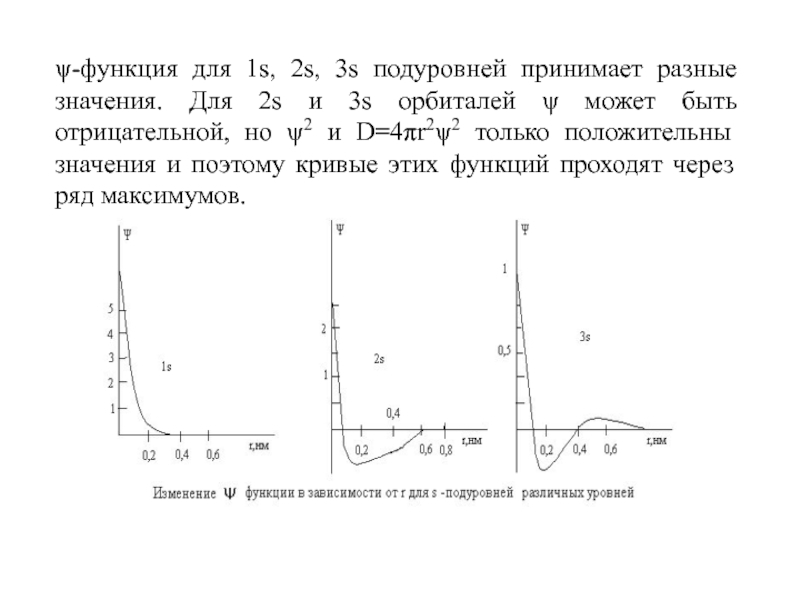
Слайд 26ψ-функция для 1s, 2s, 3s подуровней принимает разные значения. Для
2s и 3s орбиталей ψ может быть отрицательной, но ψ2
и D=4πr2ψ2 только положительны значения и поэтому кривые этих функций проходят через ряд максимумов.
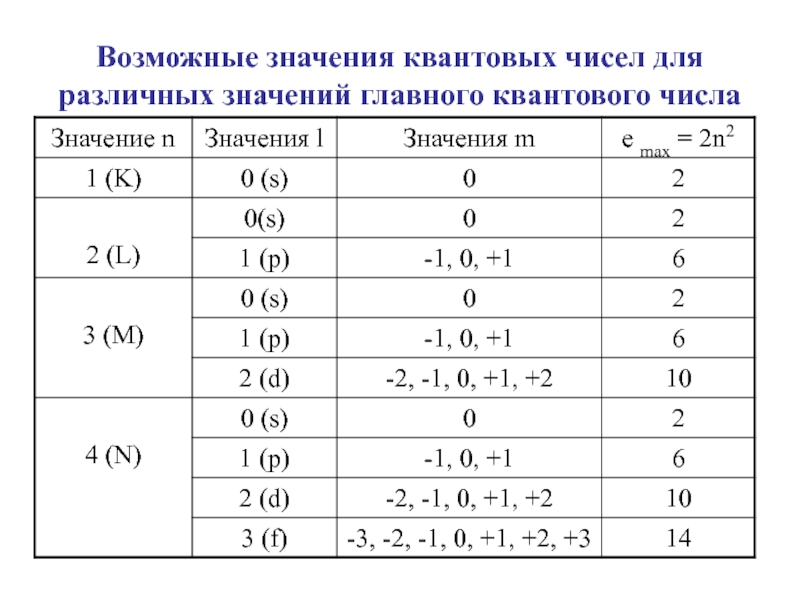
Слайд 27Квантовые числа
Главное квантовое число n определяет энергию и размеры электронных
орбиталей. Оно принимает значения: 1,2,3,4,5...Чем больше n, тем выше энергия.
Орбитальное квантовое число l определяет форму атомной орбитали.
Принимает значения от 0 до n-1, всего n значений.
Каждое значение l имеет своё обозначение: s, p, d, f.
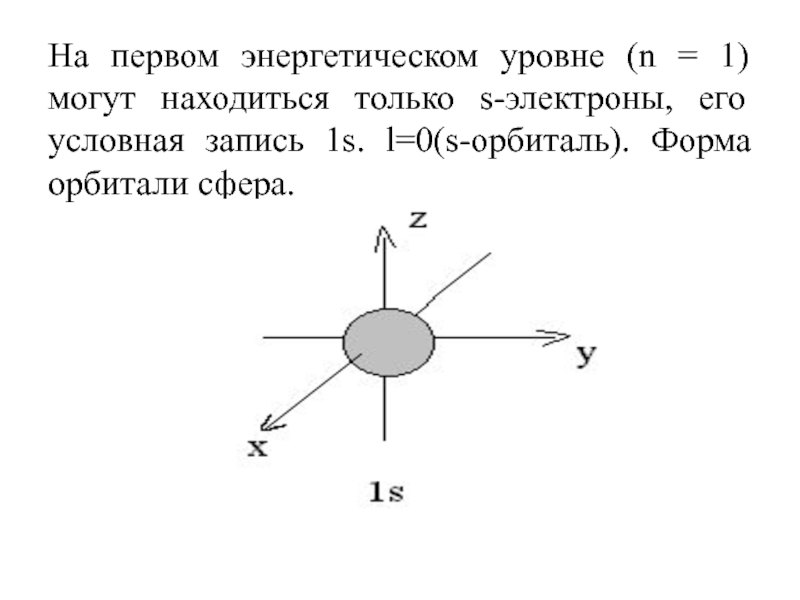
Слайд 28На первом энергетическом уровне (n = 1) могут находиться только
s-электроны, его условная запись 1s. l=0(s-орбиталь). Форма орбитали сфера.
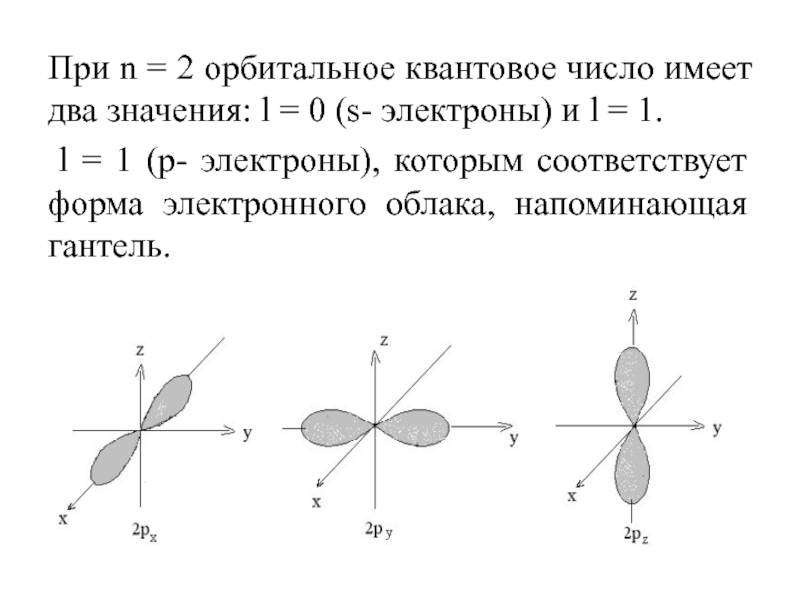
Слайд 29При n = 2 орбитальное квантовое число имеет два значения:
l = 0 (s- электроны) и l = 1.
l
= 1 (р- электроны), которым соответствует форма электронного облака, напоминающая гантель.
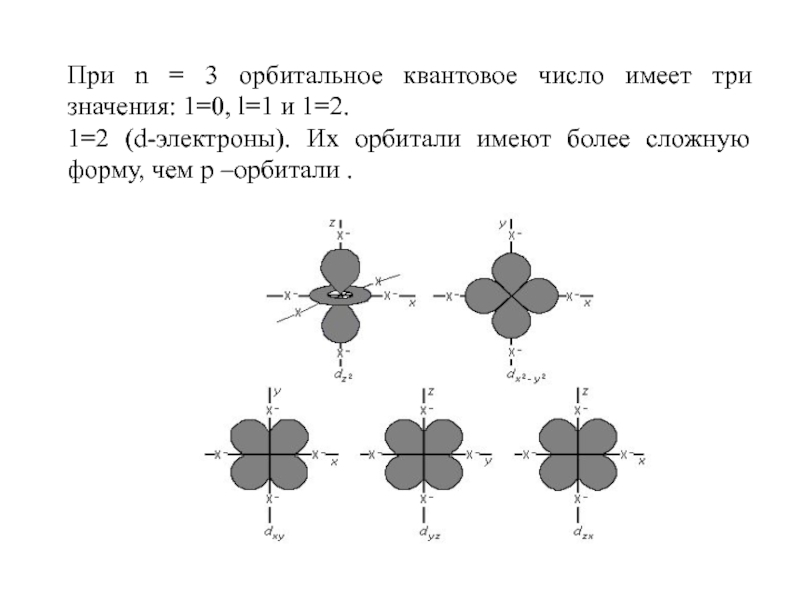
Слайд 30При n = 3 орбитальное квантовое число имеет три значения:
1=0, l=1 и 1=2.
1=2 (d-электроны). Их орбитали имеют более сложную
форму, чем р –орбитали .
Слайд 31Электроны с 1=3 называют f–электронами, у них форма орбитали ещё
более сложная, чем у d–электронов.
На одном и том же
уровне энергия подуровней возрастает в ряду:
Es< Ep< Ed< Ef
1=4 -g-орбиталь , 1=5 - h –орбиталь.
Слайд 32m - магнитное квантовое число – характеризует ориентацию орбитали в
пространстве.
Принимает целые значения от -l через 0 до +l.
Всего
2l +1 значение.
Физический смысл m: В спектрах атомов, помещенных во внешнее магнитное поле, обнаруживается дополнительное расщепление специальных линий, что говорит о различной взаимной ориентации электронных облаков.
Слайд 33s-подуровни в несильном постоянном магнитном поле не расщепляются.
р-подуровни расщепляются
в магнитном поле на три близкие линии ( три различных
типа ориентации р - облаков в пространстве (оси х, у, z).
d-подуровни расщепляются в магнитном поле на пять близких линии (пять различных типов ориентации р - облаков в пространстве).
Слайд 34Четвертое квантовое число - спиновое, обозначается ms, характеризует не орбиталь:
а сам электрон.
Оно моделируется моментом количества движения электрона, как
если бы электрон - волчок, который вращается всегда с одной скоростью, но только либо влево, либо вправо. ms = +1/2, -1/2.
Электроны с разными спинами обычно обозначаются ↑↓.
Слайд 35
Строение многоэлектронных атомов
Принцип Паули: в атоме не может быть двух
электронов, у которых были бы одинаковыми все четыре квантовых числа.
На одной орбитали, характеризующейся определёнными значениями квантовых чисел n, l и m может находиться либо один электрон, либо два, различающихся значением s.
Принцип Паули запрещает нахождение на той же орбитали третьего электрона, так как это означало бы, что у двух из них все четыре квантовых числа одинаковы.
Слайд 36Электроны, находящиеся на одной орбитали имеющие одинаковые значения квантовых чисел
, кроме спинового квантового числа, называются спаренными.
Единичные электроны называются
неспаренными.
Слайд 37Вещества с неспаренными электронами парамагнитны.
Они проводят магнитные силовые линии
лучше, чем вакуум, и магнитное поле втягивает эти вещества, из-за
взаимодействия спинов электронов как элементарных магнитов с внешним магнитным полем.
Слайд 38Вещества, у которых все электроны спаренные- диамагнитны.
Они проводят магнитные
силовые линии хуже, чем вакуум и магнитное поле выталкивает их.
Слайд 39Максимальное число электронов (энергетическая емкость):
на энергетическом уровне N =
2n2
и на подуровне: N = 2(21 +1)
Например, на третьем уровне
максимально может быть: N=2·32 =18 электронов.
На d – подуровне (1=2) находятся
N = 2(2·2 +1) = 10 электронов.
Т.к. 2 электрона находятся на одной орбитали, то следовательно на d – подуровне имеется 10/2 = 5 орбиталей.
Слайд 40Принцип наименьшего запаса энергии
(минимума энергии):
Наиболее устойчивому состоянию электрона в
атоме отвечает минимальная из возможных его энергий.
Правило Клечковского: заполнение орбиталей
происходит в порядке возрастания суммы чисел n + l, а при равных значениях этой суммы - в порядке возрастания n.
Слайд 41На какой подуровень электрон должен сперва вступать на 4s или
на 3d
для 4s:
для 3d:
n=4 n=3
1=0 1=2
---------------- -----------------------
n+1=4+0=4 n+1 = 3+2=5.
Значит согласно правила Клечковского сначала заполняется 4s подуровень, а затем 3d-подуровень.
Слайд 42В каком порядке будут заполняться 3d, 5s, 4р орбитали?
для 3d:
для 4р:
для 5s:
n=3 n=4 n=5
1=2 1=1 1=0
-----------------------------------------------------
3+2=5 4+1=5 5+0=5
Для всех подуровней сумма значений n и 1 равна пяти. Поэтому согласно правила Клечковского последовательность заполнения идет в порядке увеличения n, т.е. 3d – 4р – 5s.
Слайд 43Порядок заполнения подуровней:
1s
Слайд 44Правило Хунда (Гунда): на данном подуровне электроны стремятся занять энергетические
состояния таким образом, чтобы суммарный спин был максимальный.
Например, у
азота в основном состоянии заполняются 2р орбитали 3 электронами.
Орбитали можно заполнить :
или
Σ ms = ½*1 < Σ ms = 3 * 1/2 =1½.
неверно верно
Слайд 45Электроны верхнего заполняемого слоя - валентными электронами.
Например, электронная конфигурация
валентного уровня кремния в основном состоянии: 3s2 3p2.
Суммарный спин
атома
кремния Σms = 1
В возбуждённом
состоянии происходит
распаривание связки 3s2
и электронная конфигурация
становится 3s13p3.
Суммарный спин становится равным 2.
Слайд 46Возможные значения квантовых чисел для различных значений главного квантового числа
Слайд 47Подуровни р, d, f обладают повышенной устойчивостью, когда они не
заполнены, заполнены наполовину (неспаренными электронами) и заполнены полностью.
Для хрома
электронная конфигурация внешнего уровня должна быть 4s23d4.
Но более устойчиво состояние когда подуровень заполнен наполовину, поэтому происходит проскок электрона с 4s подуровня на 3d подуровень, и конфигурация на самом деле выглядит 4s13d5:
Слайд 48Энергетические характеристики атомов
Энергия ионизации (I) - энергия, необходимая для
удаления одного моля электронов от одного моля атомов какого либо
элемента.
Э –е = Э+
Слайд 49Характеризует восстановительную способность вещества.
Энергия ионизации возрастает с увеличением их
номеров I1
оболочки.
Слайд 50Сродство к электрону - энергетический эффект присоединения моля электронов к
молю нейтральных атомов.
Э + е = Э -
Наименьшее
сродство у атомов с полностью заполненной s оболочкой, у атомов с полностью или наполовину заполненной р и d- оболочками.




















![СТРОЕНИЕ АТОМА.ppt Решение уравнения Шредингира для атома водорода ψnlml = [N][Rnl(r)][Фlml (х/r, у/r, Решение уравнения Шредингира для атома водорода ψnlml = [N][Rnl(r)][Фlml (х/r, у/r, z/r)] N – постоянная нормировки.](/img/thumbs/e79b32ec54b002ee73bbbcfbb847255e-800x.jpg)