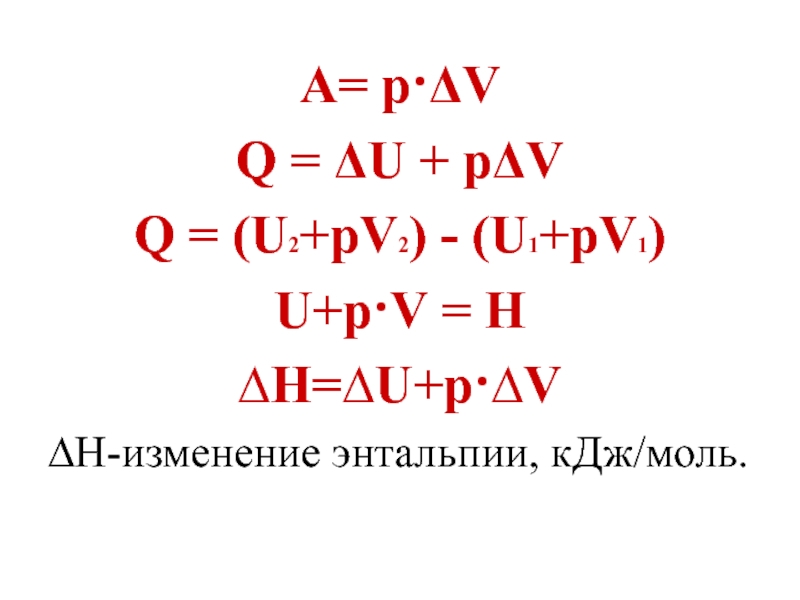Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика.ppt
Содержание
- 1. Термодинамика.ppt
- 2. Виды систем:изолированная - не обменивается ни веществом,
- 3. Компоненты - химические вещества, входящие в состав
- 4. Гомогенная система одинакова по составу, структуре и
- 5. Состояние системы характеризуется экстенсивными и интенсивными параметрами.Экстенсивные
- 6. Термодинамическое состояние системы равновесно, если его термодинамические
- 7. Некоторые параметры могут остаться без изменения.Р =
- 8. Характеристические функции.Не зависят от способа (пути) достижения
- 9. Внутренняя энергия (U) системы - её полная
- 10. ΔU>0 -происходит поглощение энергии из внешней среды (эндотермические реакции). ΔU
- 11. Теплота Q, подведённая к системе, расходуется на
- 12. А= р·ΔV Q = ΔU + pΔV
- 13. Энтальпия.Тепловой эффект или энтальпия реакции- это изменение
- 14. Тепловой эффект химической реакции - это количество
- 15. ТеплоемкостьТеплоёмкость - количество теплоты, которое необходимо подвести
- 16. Теплоемкость зависит от температуры.
- 17. Закон КирхгоффаУвеличение теплового эффекта при повышении температуры
- 18. Расчет теплоемкостиПри постоянном объеме:СV = dQV/dT
- 19. Энтальпия образованияТепловой эффект реакции образования одного моля
- 20. Энтальпия образования соединений из элементов одного
- 21. 3) Энтальпия образования соединений одного и того
- 22. Правило термохимической логарифмики:Энтальпия образования неорганических соединений элементов
- 23. 4) Энтальпия присоединения каждого следующего атома к
- 24. Стандартное состояние - реальное, состояние вещества при
- 25. Стандартные энтальпии образования простых веществ принимают равными
- 26. Термохимическое уравнение - уравнение химической реакций, в
- 27. Первый закон термохимии закон Лавуазье -
- 28. Второй закон термохимии (закон Гесса) Тепловой
- 29. Энтальпийные диаграммы
- 30. Следствия из закона Гесса 1) тепловой эффект
- 31. 2)Значение энтальпии прямой и обратной реакций численно
- 32. Теплота сгоранияТеплота сгорания органического соединения - это
- 33. Удельная теплота сгорания Qт равна количеству теплоты,
- 34. Связь внутренней энергии и энтальпии. ΔU0=ΔH0-Δn·R·T
- 35. Энтальпия нейтрализации - количество теплоты, выделяющееся при
- 36. Энергия атомизации - энергия, необходимая для разрыва
- 37. Энергия возгонки (энергия сублимации) - энергия, требующаяся
- 38. Энергия кристаллической решетки - энергия, необходимая для
- 39. Энергия ионной кристаллической решетки - работа, которую
- 40. Уравнение БорнаU=-(Z1·Z2·e2)/r+(b·e2/r·n) где Z1 и Z2 -
- 41. Энергия в ионном кристаллеЦепочка ионов с чередующимися по знаку зарядами.Расстояние между ближайшими ионами равно r.
- 42. Трехмерная кристаллическая решетка хлорида натрияОдинаково обозначены ионы, находящиеся на равных расстояниях от центрального иона.
- 43. Энергия притяжения иона с другими ионами в
- 44. Уравнение Борна для кристаллаU = (-αм ·N·e2·Z1·Z2/r)
- 45. Термодинамические свойства плеядРяд соединений, образуемых одной парой
- 46. Энтальпия образования газообразных оксидов и галогенидов из
- 47. Энтальпия образования газообразных окислов углерода из свободных
- 48. Энтальпии образования окислов марганца ∆Нобр,
- 49. Если элемент А соединяется с элементом В,
- 50. Термодинамический цикл Борна - Габера Если, осуществляя
- 51. Энтальпией растворения называют количество теплоты, поглощающейся или
- 52. Принцип Бертоло-ТомсенаХимические процессы осуществляются в том случае,
- 53. Закон КлаузиусаТеплота сама собой переходит лишь от
- 54. ЭнтропияТермодинамическая вероятность системы W - число микросостояний.
- 55. Энтропия обратной реакции численно равна и противоположна
- 56. ΔS>0 - переход системы из более упорядоченного в менее упорядоченное состояние. ΔS
- 57. Второй закон термодинамикив изолированной системе самопроизвольно протекают
- 58. Уравнение КлаузиусаΔS=ΔH·1000/T Связь энтропии и теплоемкостиΔS=С·2,303lgТ2/Т1 При фазовых переходах Qp=∆Нф.п. Sф.п.= ∆Нф.п./Т
- 59. Энергия ГиббсаЭнергия Гиббса (изобарно-изотермический потенциал) ΔG -
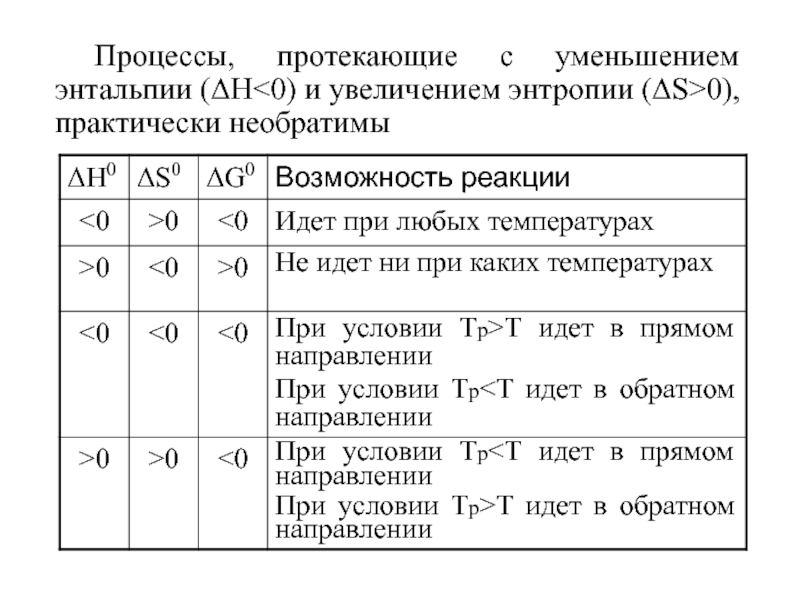
- 60. Процессы, протекающие с уменьшением энтальпии (ΔН0), практически необратимы
- 61. Травновесн. = ΔН0 /ΔS0Изменение энергии Гиббса системы
- 62. Изотерма Вант-Гоффа имеет вид: Для реакции:dD+bB=lL+mM ΔG=
- 63. Если процесс проходит в изохорно-изотермических условиях (постоянные
- 64. Скачать презентанцию
Виды систем:изолированная - не обменивается ни веществом, ни энергией (в природе такие системы не существуют);закрытая — обменивается только энергией (запаянная ампула с каким-либо веществом);открытая - обменивается и веществом и энергией (открытая
Слайды и текст этой презентации
Слайд 1Система - это совокупность находящихся во взаимодействии веществ, мысленно или
фактически обособленная от окружающей среды.
Слайд 2Виды систем:
изолированная - не обменивается ни веществом, ни энергией (в
природе такие системы не существуют);
закрытая — обменивается только энергией (запаянная
ампула с каким-либо веществом);открытая - обменивается и веществом и энергией (открытая пробирка с веществом).
Слайд 3Компоненты - химические вещества, входящие в состав системы.
Число независимых компонентов
в системе:
n компонентов = n веществ – n реакций
Хранящийся на
воздухе СаО.Число возможных реакций в системе 2:
СаО+Н2О=Са(ОН)2 Са(ОН)2+СО2=СаСО3+Н2О Значит число веществ в системе 5:
СаО, Н2О, Са(ОН)2, СО2, СаСО3
Тогда число компонентов: 5-2=3
Слайд 4Гомогенная система одинакова по составу, структуре и свойствам во всех
своих микроучастках.
Гетерогенная система состоит из нескольких фаз, разграниченных поверхностями раздела.
Фаза - часть системы, однородная во всех точках по составу и свойствам и отделенная от других частей системы поверхностью раздела.
Слайд 5Состояние системы характеризуется экстенсивными и интенсивными параметрами.
Экстенсивные параметры зависят от
количества вещества, находящегося в системе. Это - масса, объем, энергия,
теплоемкость.Интенсивные параметры не зависят от количества вещества в системе. Это - температура, давление, плотность, концентрация.
Слайд 6Термодинамическое состояние системы равновесно, если его термодинамические параметры одинаковы во
всех точках системы, и не изменяются самопроизвольно (без затраты работы)
во времени.Состояние задаётся набором значений термодинамических параметров: температура, давление, массовый состав системы, плотности, концентрации и т.п.
Уравнения, связывающее значения V, p, T для изучаемой системы называются уравнениями состояния.
Слайд 7Некоторые параметры могут остаться без изменения.
Р = const - процесс
изобарный
V = const - процесс изохорный
Т = const - процесс
изотермическийР= const, Т = const - процесс изобарно-изотермический и т.д.
Слайд 8Характеристические функции.
Не зависят от способа (пути) достижения данного состояния системы,
а определяются состоянием системы.
К ним относятся:
внутренняя энергия U,
энтальпия Н,
изохорно-изотермический потенциал (свободная энергия или энергия Гемгольца) F,изобарно-изотермический потенциал (энергия Гиббса) G,
энтропия S.
Слайд 9Внутренняя энергия (U) системы - её полная энергия, которая складывается
из кинетической и потенциальной энергий молекул, атомов, атомных ядер, электронов,
ионов и др. частиц, составляющих систему.ΔU = U2 - U1
U1 и U2 - внутренняя энергия системы в начальном и конечном состояниях,
ΔU - изменение внутренней энергии в ходе химического процесса.
Слайд 10ΔU>0 -происходит поглощение энергии из внешней среды (эндотермические реакции).
ΔU
способность системы к совершению работы или передаче теплоты.Теплота Q (Дж) - количественная мера хаотичного движения частиц данной системы или тела.
Работа А (Дж) - количественная мера направленного движения частиц, мера энергии, передаваемая от одной системы к другой за счет перемещения вещества от одной системы к другой под действием тех или иных сил.
Слайд 11Теплота Q, подведённая к системе, расходуется на увеличение её внутренней
энергии ΔU и на совершение системой работы А над внешней
средой.Q = ΔU + А
I -ый закон термодинамики
Слайд 12А= р·ΔV
Q = ΔU + pΔV
Q = (U2+pV2)
- (U1+pV1)
U+р·V = Н
∆Н=∆U+р·∆V
∆Н-изменение энтальпии, кДж/моль.
Слайд 13Энтальпия.
Тепловой эффект или энтальпия реакции- это изменение энергии системы при
протекании в ней химических реакций при условии, что система не
совершает никакой другой работы кроме работы расширения.Изменение энтальпии (ΔН) - является мерой энергии, переданной от одного тела к другому, за счёт разницы температур этих тел.
Q = H2 - H1 = ΔH
Слайд 14Тепловой эффект химической реакции - это количество энергии (тепла), которое
должно быть получено продуктами реакции (или отведено от них), чтобы
они имели такую же температуру, как исходные вещества.ΔН>0, ΔU>0 - теплота подводится к системе, реакция – эндотермическая.
ΔН < 0, Δ U<0 - теплота выделяется при реакции, реакция - экзотермическая.
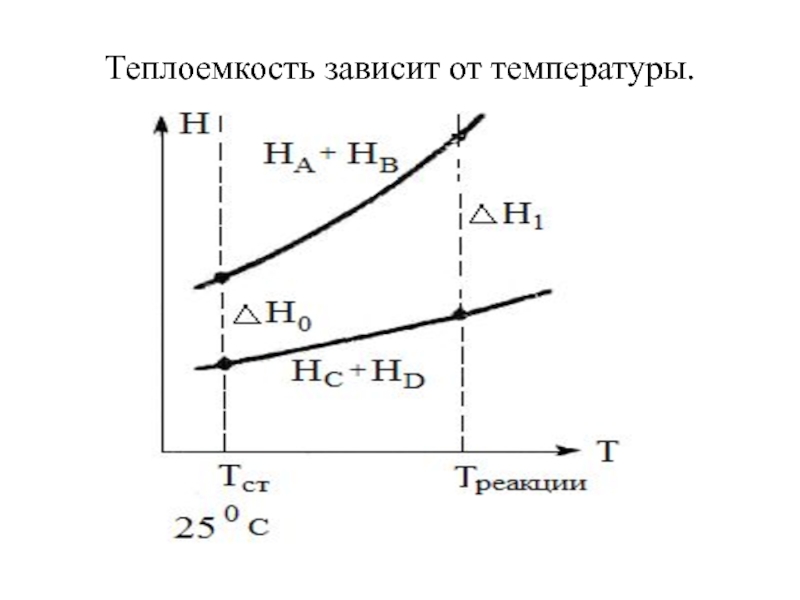
Слайд 15Теплоемкость
Теплоёмкость - количество теплоты, которое необходимо подвести к телу, чтобы
повысить его температуру на 1 К.
или
Теплоёмкость - это отношение количества
теплоты, полученное телом (веществом) при бесконечно малом изменении его состояния в каком-либо процессе, к вызванному им приращению температуры. Слайд 17Закон Кирхгоффа
Увеличение теплового эффекта при повышении температуры на 10С равняется
разности между теплоемкостью исходных веществ (С1) и теплоемкостью продуктов реакции
(С2).ΔQ/ ΔT = С1 - С2
ΔQ - тепловой эффект реакции, кДж/моль;
ΔТ - изменение температуры, 0С.
Слайд 18Расчет теплоемкости
При постоянном объеме:
СV = dQV/dT
СV -теплоемкость при постоянном объеме, кДж/моль·град;
dQV
- первая производная теплоты при постоянном объеме;dT - производная температуры.
При постоянном давлении:
CP = dQP/dT
СР-теплоемкость при постоянном давлении, кДж/моль·град;
dQР - первая производная теплоты при постоянном давлении;
dT - производная температуры.
Слайд 19Энтальпия образования
Тепловой эффект реакции образования одного моля сложного вещества из
простых веществ называется энтальпией образования ΔНобр. данного вещества.
Слайд 20 Энтальпия образования соединений из элементов одного и того же
периода периодической системы уменьшается по мере увеличения порядкового номера:
ΔН0(NaC1) = -411,1 кДж/моль ΔН0(MgC12) = -641,1 кДж/моль
ΔН0(A1C13) = -704,2 кДж/моль
2) Кристаллическому состоянию вещества соответствует большая энтальпия образования, нежели аморфному.
Слайд 213) Энтальпия образования соединений одного и того же металла с
металлоидами одной и той же группы периодической системы растет с
ростом атомного веса металлоида:ΔН0(KF) = -567,4 кДж/моль
ΔН0(KC1) = -435,9 кДж/моль
ΔН0(KBr) = -392,5 кДж/моль
ΔН0(KI) = -327,6 кДж/моль
Слайд 22Правило термохимической логарифмики:
Энтальпия образования неорганических соединений элементов одного ряда или
одной подгруппы периодической системы, отнесенная к одному грамм-эквиваленту, находится в
линейной зависимости от логарифма порядкового номера этих элементов.Слайд 234) Энтальпия присоединения каждого следующего атома к металлу меньше, чем
предыдущего:
ΔН0(FeC12)= -341,45 кДж/моль ΔН0(FeC13) = -390,4 кДж/моль
5) Элементы, объединяемые общностью химических свойств, соединяясь с другими элементами, дают мало различающиеся тепловые эффекты, например, для семейства железа:
ΔН0(FeO) = -268,4 кДж/моль
ΔН0(CoO) = -239,3 кДж/моль
ΔН0(NiO) = -239,7 кДж/моль
ΔН 0(FeS) = -100,4 кДж/моль
ΔН0(CoS) = -84,5 кДж/моль
ΔН0(NiS) = -79 кДж/моль
Слайд 24Стандартное состояние - реальное, состояние вещества при данной температуре и
давлении 101,3 кПа (1атм) в термодинамически устойчивых при данной температуре
фазах и модификациях.Стандартная энтальпия (теплота) образования химического соединения ΔН0Т -изменение энтальпии в процессе получения одного моля этого соединения, находящегося в стандартном состоянии, из простых веществ, стандартных при данной температуре (это величина справочная).
Стандартная температура 250С (298 К).
Слайд 25Стандартные энтальпии образования простых веществ принимают равными нулю, если их
агрегатные состояния и модификации устойчивы при стандартных условиях.
Энтальпия образования
молекулы из свободных атомов - это сумма термохимических энергий связей в этой молекуле.Слайд 26Термохимическое уравнение - уравнение химической реакций, в котором указан его
тепловой эффект.
Признаки термохимического уравнения:
1) Указываются агрегатные состояния вещества: (г) или
(п) - газообразное, (ж) - жидкое, (т) или (кр)- твердое состояния воды.2) Описывает реакцию между молями веществ, а не отдельными молекулами, поэтому в уравнениях допускаются дробные коэффициенты.
3) В уравнении указывается тепловой эффект реакции.
С6Н6(ж)+7,5О2(г)=6СО2(г)+3Н2О(ж); ΔН0298=-3267,7Дж
Слайд 27Первый закон термохимии
закон Лавуазье - Лапласа
Количество тепла, поглощающегося
(выделяющегося) при разложении какого-либо сложного вещества на простые вещества, равно
количеству тепла, выделяющегося (поглощающегося) при образовании этого же сложного вещества из простых веществили
Тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с обратным знаком.
Слайд 28Второй закон термохимии
(закон Гесса)
Тепловой эффект ряда последовательных реакций
равен тепловому эффекту любого другого ряда реакций, если исходные вещества
и конечные продукты в обоих случаях одни и те же и находятся в одинаковых состояниях и условиях.или
Тепловой эффект химической реакции не зависит от пути её протекания, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции.
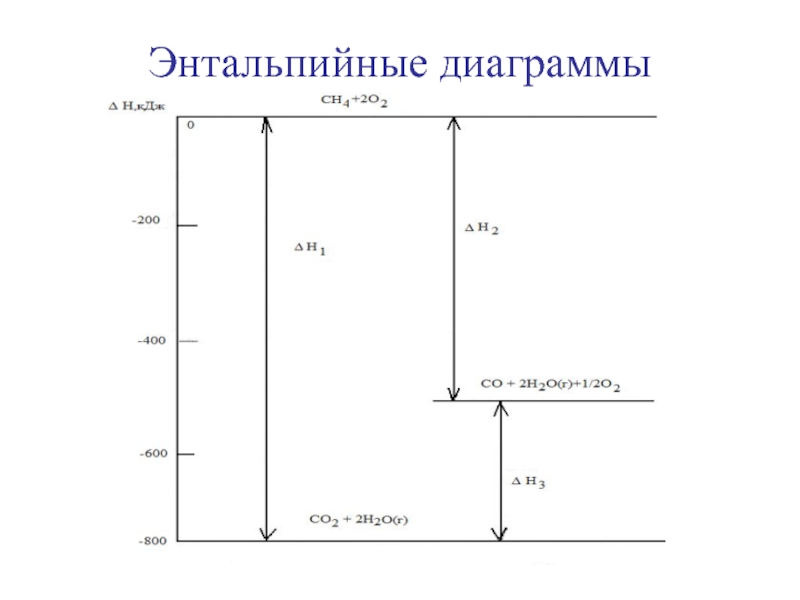
Слайд 30Следствия из закона Гесса
1) тепловой эффект химической реакции (ΔН0х.р.)
равен сумме теплот (энтальпий) образования продуктов реакции (ΔH0oбр.пpoд.) минус сумма
теплот (энтальпий) образования исходных веществ (ΔН0обр.исх.) с учётом коэффициентов перед формулами этих веществ в уравнении реакции.ΔН0х.р.= ΣΔН0обр.прод - Σ ΔН0обр.исх
Слайд 312)Значение энтальпии прямой и обратной реакций численно равны, но противоположны
по знаку.
ΔН0(прямого процесса)=-ΔН0(обратного процесса)
3)Если реагенты превращаются в продукты по
многостадийному механизму, то всегда верно соотношение:ΔН0(реакции) = Σ ΔН0(стадий)
Слайд 32Теплота сгорания
Теплота сгорания органического соединения - это количество теплоты, которое
выделяется при полном сгорании 1 моля вещества.
Теплота образования органического соединения
равна разности между теплотой сгорания элементов, входящих в его состав, и теплотой сгорания данного соединения.Слайд 33Удельная теплота сгорания Qт равна количеству теплоты, выделяющейся при сгорании
1 кг жидкого или твердого вещества или 1 м3 газообразного
вещества до образования высших оксидов:Qт = - ΔН0сгор· 1000/М
М –молярная масса
или
Qт = ΔН0сгор ·1000/22,4
22,4 – объём моля газа.
Слайд 34Связь внутренней энергии и энтальпии.
ΔU0=ΔH0-Δn·R·T
ΔU0 - изменение
внутренней энергии системы, кДж/моль;
ΔH0 - изменение энтальпии системы, кДж/моль;
Т -
температура, К.R - универсальная газовая постоянная, 8,314 Дж/моль·К;
Δn-изменение числа молей газообразных веществ в ходе реакции:
Δn=Σnпродуктов - Σnисх. в-в
ΔU0= (ΔH0 - Δn·R·T)·n
Слайд 35Энтальпия нейтрализации - количество теплоты, выделяющееся при взаимодействии одного моля-эквивалента
кислоты с одним молем - эквивалента щелочи.
Слайд 36Энергия атомизации - энергия, необходимая для разрыва связей в 1
моле простого вещества и превращения его в свободные атомы.
Слайд 37Энергия возгонки (энергия сублимации) - энергия, требующаяся для возгонки (перехода
из твердого состояния в газообразное) одного грамм-атома вещества, при этом
вещество должно испаряться с образованием одноатомных молекул.Слайд 38
Энергия кристаллической решетки - энергия, необходимая для разрушения 1 моля
кристаллического вещества и удаления образовавшихся атомов за пределы их взаимодействия.
Слайд 39Энергия ионной кристаллической решетки - работа, которую необходимо затратить для
разрушения одного моля кристаллического вещества на ионы и удаление газообразных
ионов на бесконечно большое расстояние друг от друга.Зависимость энергии взаимодействия ионов от расстояния между ними
Слайд 40Уравнение Борна
U=-(Z1·Z2·e2)/r+(b·e2/r·n)
где Z1 и Z2 - величины зарядов катиона
и аниона (т.е. формальные валентности);
е - заряд электрона в
электростатических единицах заряда,r- равновесное расстояние между ионами;
b и n - некоторые постоянные величины (параметры).
На 1 моль:
U= N·(-(Z1·Z2·e2)/r+(b·e2/r·n)
N - число Авогадро
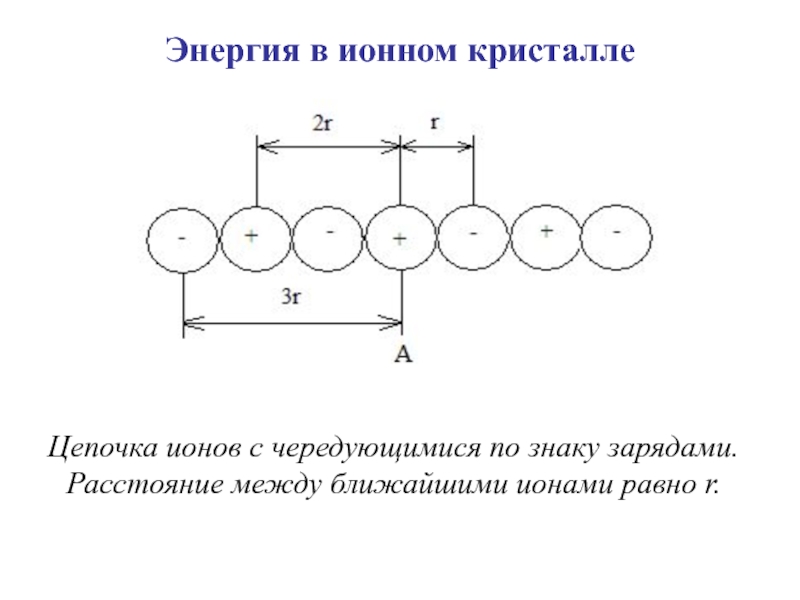
Слайд 41Энергия в ионном кристалле
Цепочка ионов с чередующимися по знаку зарядами.
Расстояние
между ближайшими ионами равно r.
Слайд 42Трехмерная кристаллическая решетка хлорида натрия
Одинаково обозначены ионы, находящиеся на равных
расстояниях от центрального иона.
Слайд 43Энергия притяжения иона с другими ионами в кристалле
Епр=-2·ln2·e2/r
Притяжение одного
моля ионов в кристалле:
Eпр=N·(e2/r)·(6/√1-12/√2+8/√3-6/√4+24/√5-…)
Сумма в скобках является постоянной величиной и
назвается постоянной Маделунга или структурной константой αм Слайд 44Уравнение Борна для кристалла
U = (-αм ·N·e2·Z1·Z2/r) + (β·e2/r·n)
β=N·b
- структурная постоянная, учитывающая степень отталкивания инертноподобных электронных оболочек ионов.
Слайд 45Термодинамические свойства плеяд
Ряд соединений, образуемых одной парой элементов, один из
которых имеет переменную валентность, называется плеядой.
Эндоэффект координации: по мере
увеличения числа атомов В, окружающих атом А (координированных вокруг атома А) в ∆Н процесса присоединения каждого нового атома В к энергетическому балансу добавляется некая эндотермическая составляющая. Эндоэффект координации зависит от валентности и размера присоединяемых частиц.
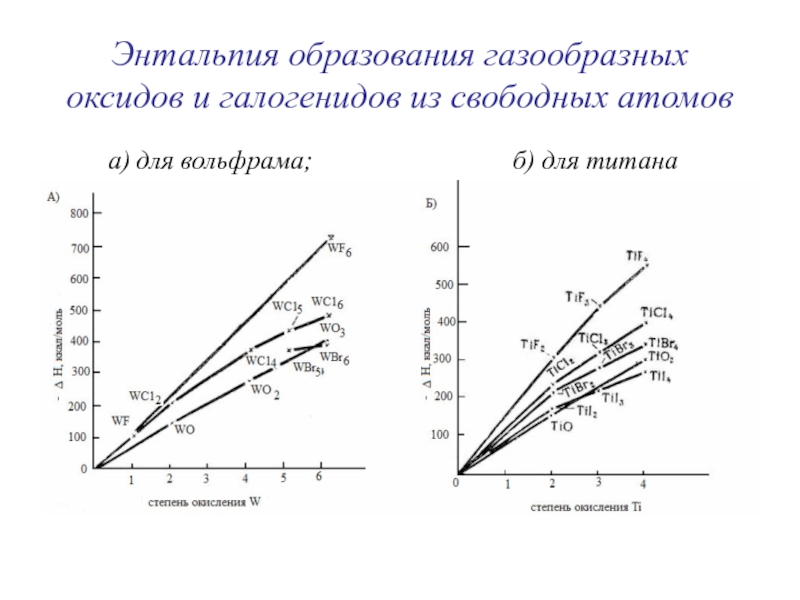
Слайд 46Энтальпия образования газообразных оксидов и галогенидов из свободных атомов
а) для вольфрама;
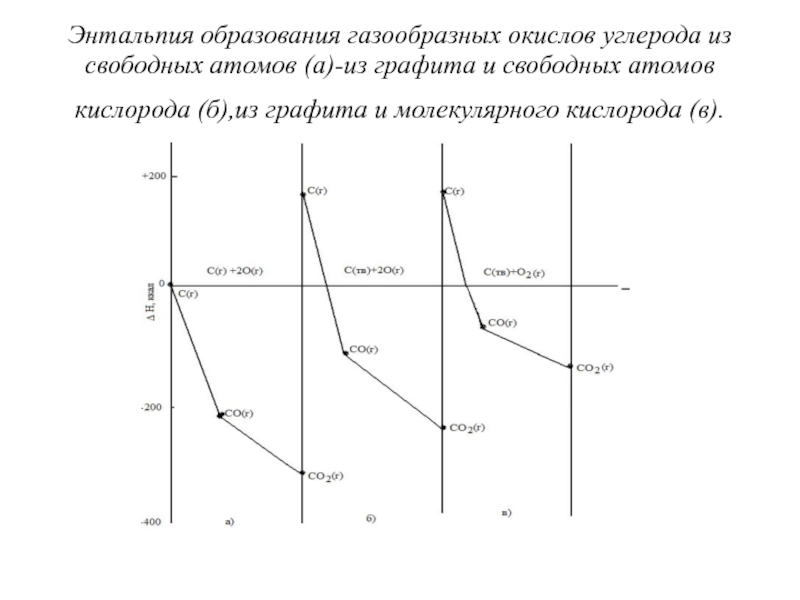
б) для титанаСлайд 47Энтальпия образования газообразных окислов углерода из свободных атомов (а)-из графита
и свободных атомов кислорода (б),из графита и молекулярного кислорода (в).
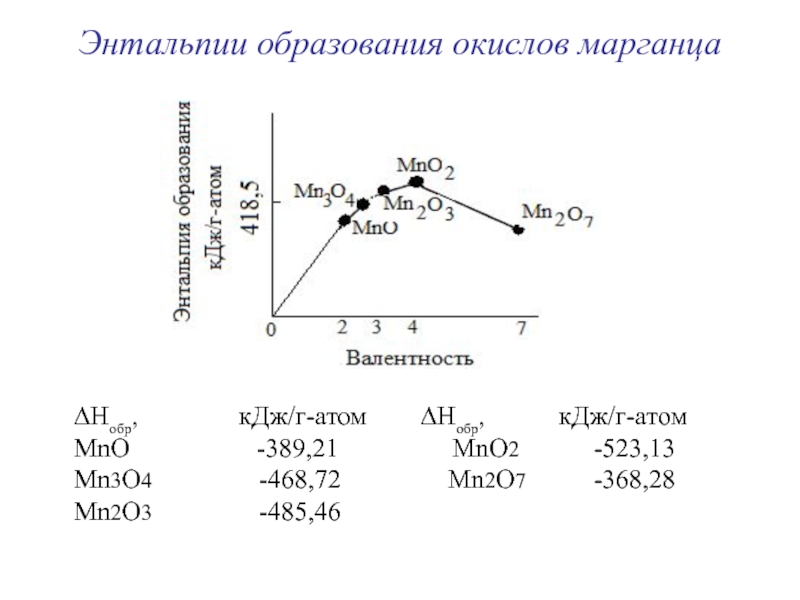
Слайд 48Энтальпии образования окислов марганца
∆Нобр,
кДж/г-атом ∆Нобр,
кДж/г-атомМnО -389,21 МnО2 -523,13
Мn3О4 -468,72 Мn2О7 -368,28
Мn2О3 -485,46
Слайд 49Если элемент А соединяется с элементом В, а энергия атомизации
простого вещества А много больше, чем энергия атомизации простого вещества
В, то маловероятно, чтобы соединения с невысоким содержанием элемента В были устойчивыми.Эти соединения будут либо эндотермичными, а эндотермичные мало устойчивы, либо экзотермичными, но будут экзотермически диспропорционировать, например по схеме: 2АВ = А + АВ2.
Если какое-то соединение в плеяде очень экзотермично по сравнению с другими соединениями этой плеяды, то оно как бы «поглотит» своих менее экзотермичных соседей.
Слайд 50Термодинамический цикл Борна - Габера
Если, осуществляя процесс, поучается то
же самое вещество, с которого начали, то процесс называется круговым
или циклическим.Слайд 51Энтальпией растворения называют количество теплоты, поглощающейся или выделяющейся при растворении
одного моля вещества в очень большом количестве растворителя, т.е. растворителя
берут столько, чтобы при дальнейшем разбавлении раствора уже не наблюдалось добавочного теплового эффектаСлайд 52Принцип Бертоло-Томсена
Химические процессы осуществляются в том случае, если они сопровождаются
выделением энергии, т. е. являются экзотермическими.
или
Химические процессы стремятся протекать в
направлении достижения минимума энергии. ΔНх.р.<0 – энтальпийный фактор реакции
Слайд 53Закон Клаузиуса
Теплота сама собой переходит лишь от тела с большей
температурой к телу с меньшей температурой и не может самопроизвольно
переходить в обратном направлении.или
Невозможно построить вечный двигатель второго рода, работа которого производилась бы только за счет охлаждения теплоотдатчика.
Слайд 54Энтропия
Термодинамическая вероятность системы W - число микросостояний.
Энтропия (S) -
количественная мера беспорядка.(Дж/моль·К).
Уравнение Больцмана:
S = k lnW
Теорема Нернста: приращение
энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система. Слайд 55Энтропия обратной реакции численно равна и противоположна по знаку энтропии
прямой реакции.
Изменение энтропии системы (ΔS0х.р.) в результате химической реакции равно
сумме энтропии продуктов реакции (ΣS0прод.) за вычетом суммы энтропии исходных веществ (ΣS0исх.). Суммирование проводят с учетом числа молей участвующих в реакции веществ. ΔS0х.р. = Σ S0обр.прод. - ΣS0обр.исх
.
Слайд 56ΔS>0 - переход системы из более упорядоченного в менее упорядоченное
состояние.
ΔS
более упорядоченное. Третий закон термодинамики
При абсолютном нуле энтропия идеального кристалла равна нулю
Слайд 57Второй закон термодинамики
в изолированной системе самопроизвольно протекают только те процессы,
которые сопровождаются увеличением энтропии системы.
Т·dS≥dQe
Здесь знак равенства относится
к обратимым процессам.Слайд 58Уравнение Клаузиуса
ΔS=ΔH·1000/T
Связь энтропии и теплоемкости
ΔS=С·2,303lgТ2/Т1
При фазовых переходах Qp=∆Нф.п.
Sф.п.= ∆Нф.п./Т
Слайд 59Энергия Гиббса
Энергия Гиббса (изобарно-изотермический потенциал) ΔG - максимальная работа, которую
нужно совершить, чтобы остановить данную химическую реакцию.
ΔG =ΔH -T·ΔS
ΔG0<0 - реакция может идти самопроизвольно.
ΔG0>0 - реакция самопроизвольно не протекает.
ΔG0=0 - состояние термодинамического равновесия.
Слайд 61Травновесн. = ΔН0 /ΔS0
Изменение энергии Гиббса системы при образовании 1
моля вещества из простых веществ, устойчивых при 298 К, называется
энергией Гиббса образования веществаΔG реакции рассчитывают как сумму ΔG образования продуктов реакции за вычетом суммы ΔG образования исходных веществ с учетом стехиометрических коэффициентов.
ΔG0х.р. = Σ ΔG0обр.прод. - ΣΔG0обр.исх
Слайд 62Изотерма Вант-Гоффа имеет вид:
Для реакции:
dD+bB=lL+mM
ΔG= ΔG0 + R·T·ln(ClL·CmM/
CdD·CbB)
где С - концентрация вещества
или
ΔG = ΔG0 +
R·T·ln(plL· pmM/ pdD рbв) где р- парциальные давления веществ
Слайд 63Если процесс проходит в изохорно-изотермических условиях (постоянные температура и объём
системы), то он описывается энергией Гельмгольиа F.
ΔF=ΔU-T·ΔS=-19,14·T·lgKc( V=const)
ΔF и
ΔG связаны:ΔG=ΔH-T·ΔS=ΔU+p·ΔV-T·ΔS=ΔF+p·ΔV-ΔF+Δn·R·T