Слайд 1Три физических состояния – газообразное, жидкое и твердое. При очень
высоких температурах разновидность газообразного состояния – плазма.
В газообразном - молекулы
далеко друг от друга; занимают малую долю объёма. При невысоких давлениях и температурах молекулы в газообразном состоянии не взаимодействуют друг с другом. Структура упорядочена.
В жидком - расстояние между частицами меньше, чем в газообразном состоянии. Частицы занимают основную часть объёма, соприкасаются и притягиваются друг к другу, но частицы подвижны относительно друг друга. Наблюдается упорядочность частиц (ближний порядок).
В твердом - частицы сближены друг с другом и между ними возникают прочные связи. Движение частиц относительно друг друга отсутствует и существует высокая упорядочность структуры.
Физические (агрегатные) состояния веществ.
Слайд 3Модель идеального газа
Использую предположения:
а) молекулы газа занимают малую долю
объёма;
б) молекулы газа не притягиваются друг к другу;
в) молекулы находятся
в непрерывном движении, время столкновения молекул друг с другом очень мало по сравнению с временем между столкновениями;
г) средняя кинетическая энергия молекул газа пропорциональна абсолютной температуре.
Слайд 4Законы идеальных газов
Закон Авогадро: Равные объемы газов при одинаковой температуре
и давлении содержат одинаковое число молекул. В одном моле содержится
6,022.1023‑молекул. При нормальных)условиях моль газа занимает объём 22,4 л.
Следствие из закона Авогадро: Плотности различных газов при одинаковых температуре и давлении относятся как молярные массы этих газов.
Объединенный газовый закон:
р*V/Т = Р0*V0/Т0
Уравнение Менделеева -Клайперона:
PV = n RT
Диффузия – распространение молекул газа по всему объёму, из-за их непрерывного движения.
Закона Грэхэма: скорость диффузии молекул газа через пористую перегородку обратно пропорциональна корню квадратному из плотности газа.
νд = √1/ρ, следовательно, νд1 /νд2 = √ρ2 /ρ1 или νд1 /νд2 = √М2 /М1
С помощью диффузии через пористую перегородку можно разделить газы, имеющие разные молярные массы.
Слайд 5Реальные газы
Существуют отклонения от газовых законов. Они растут с увеличением
давления и понижением температуры.
Причины отклонения:
межмолекулярные взаимодействия (ван-дер-ваальсовы силы).
молекула
имеет собственный объём
Уравнение состояния реального газа
(уравнение Ван-дер-Ваальса):
(р + аn2/V2)*(V- nb) = nRT
а – поправка вносимая в давление, учитывает межмолекулярное взаимодействие; растет с увеличением энергии ван-дер-ваальсовых сил.
b –поправка вносимая в объём молекул, растет с увеличением размера молекул.
Слайд 6Плазма
При температурах 104К и выше) образуется плазма.
Газ содержит катионы
и электроны за счет диссоциации молекул при очень высоких температурах,
например Ar→Аr+ +е.
Плазма обладает ионно-электронной проводимостью.
Частицы плазмы имеют высокий энергетический уровень.
Плазма подчиняется газовым законам.
Отличие от газов - при воздействии магнитного и электрического полей в плазме возникает направленное движение молекул и электронов.
Плазма с температурой 10-100 тысяч градусов - ''холодная'‘.
Плазма с температурой порядка 1000000 градусов – ''горячая''.
В “горячей” нейтральные атомы существовать не могут. Она состоит из смеси электронов, ионов и атомных ядер.
На земле плазменное состояние реализуется в молниях, северном сиянии, электрической дуге, аргоновых и неоновых лампах и др.
Слайд 7Жидкое состояние.
Жидкое и твёрдое состояние –это конденсированное состояние вещества.
1) Молекулы
находятся ближе друг к другу, чем в газах.
2) Удерживаются друг
относительно друга силами межмолекулярного взаимодействия.
3) Располагаются регулярным образом относительно друг друга
4) Появляется порядок во внутренней структуре вещества.
5) Вещество приобретает собственный объём, из-за наличия сил притяжения отдельных молекул жидкости.
6) Не имеют собственной формы, а приобретают форму сосуда. Только в очень небольших количествах они способны сохранять форму капли.
7) Мало сжимаемы.
При высоких температурах свойства жидкостей приближаются к свойствам газов, при низких температура свойства жидкости приближаются к свойствам твердых. веществ.
Слайд 8Молекулярно-кинетическая теория строения жидкости.
В жидкости присутствует «ближний порядк»: в среднем
по времени ближайшие друг к другу частицы в жидкостях располагаются
не хаотически, а более или менее упорядоченно, образуя стабильные группы- кластеры и ассоциаты.
Степень упорядоченности растет с увеличением полярности молекул (вода, аммиак, фтороводород).
Частицы жидкости совершают в секунду 1012-1013 колебаний, находясь в определенном месте, в течение 10-11-10-10 секунд. До перестройки структуры вокруг неё, частица совершает от 10 до 100 колебаний, т.е. 10% колебательных движений частиц приводят к перемещению в пространстве.
В жидкости за счет теплового движения (Броуновского) частиц, структура в отдельных местах уплотняется за счет других мест.
Постоянные кратковременные местные изменения в структуре жидкости называются флуктуациями (подтверждение ближнего порядка).
Слайд 9Частицы с высокой энергией, могут вырываться из жидкости и переходить
в газообразное состояние - испарение. Склонность жидкости к испарению -
летучесть. Чем меньше силы межмолекулярного взаимодействия, тем выше летучесть.
При испарении растет парциальное давление пара данной жидкости в газовой фазе над жидкостью и ускоряется процесс захвата газообразных молекул жидкостью - конденсация.
Давление насыщенных паров жидкости - парциальное давление при котором скорость испарения равна скорости конденсации.
При увеличении межмолекулярных взаимодействий при одинаковой температуре давление насыщенных паров уменьшается( это заметно у веществ с водородными связями).
Зависимость давления насыщенных паров от температуры:
р = А*ехр(-В/RТ), где А и В – константы.
При условии рпарциальное=ратмосферное начинается кипение.
Температура, при которой достигается это состояние – это температура кипения.
При увеличении межмолекулярных взаимодействий и при увеличении давления температура кипения увеличивается.
Слайд 10Текучесть - направленное перемещение отдельных частиц жидкости (флуктуация её плотности)
под действием внешних сил (например, силы тяжести). Жидкость изменяет форму
в сторону приложенной силы, но сохраняет общий объём.
Текучесть – специфическое свойство жидкого состояния вещества.
Оценивается по вязкости
Вязкость η - это сила трения F, с которой можно сдвинуть один слой жидкости относительно другого, отстоящего от него на Δl (м) со скоростью ΔV (м/сек), если площадь соприкосновения слоев равна S (м2).
Вязкость зависит от вида жидкости:
η(200) фосфорной кислоты~10 Па.сек, η(200) воды- 1,05.10-4 Па.сек
Вязкость растёт с увеличением межмолекулярных взаимодействий и падает с ростом температуры:
η(200) воды =1,05.10-4 Па.сек, η(900) воды= 2.10-5 Па.сек
Слайд 11Силы межмолекулярного взаимодействия молекул, находящиеся на поверхности, не уравновешены. Результирующая
сила взаимодействия поверхностных молекул направлена вглубь жидкости. Под действием этой
силы жидкость стремиться к сокращению площади поверхности.
Сфера имеет наименьшую площадь поверхности по сравнению с другими формами и капля жидкости имеет сферическую форму .
Для образования новой поверхности требуется дополнительная энергия, называющаяся поверхностным натяжением: σ = σо - КσТ, где σо и К σ - константы.
Метанол σ=22,6 мДж/м2 Вода σ=72,8 мДж/м2 Ртуть σ=471,6 мДж/м2
Жидкости изотропны - обладают идентичностью свойств по любому из выбранных направлений.
Но существуют жидкости, обладающие анизотропностью - зависимостью свойств от направления. Это жидкие кристаллы.
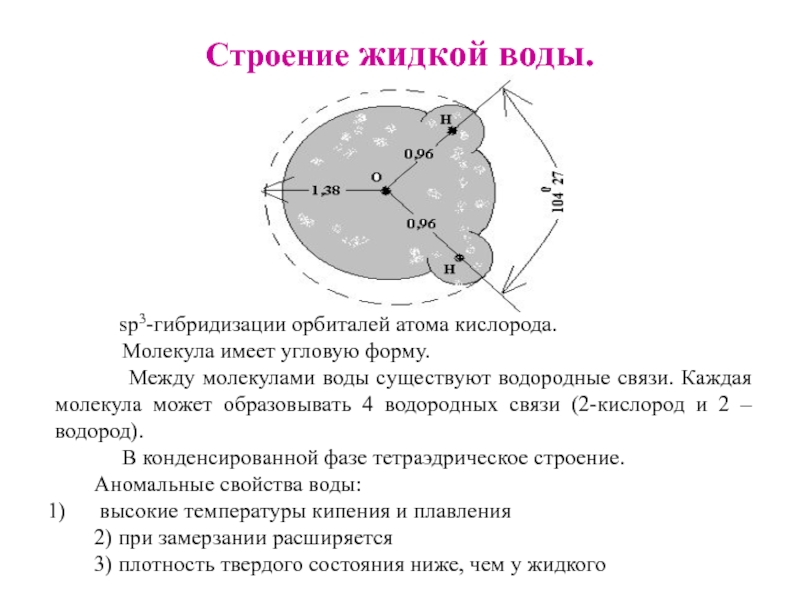
Слайд 12Строение жидкой воды.
sр3-гибридизации орбиталей атома кислорода.
Молекула имеет угловую форму.
Между молекулами воды
существуют водородные связи. Каждая молекула может образовывать 4 водородных связи (2-кислород и 2 – водород).
В конденсированной фазе тетраэдрическое строение.
Аномальные свойства воды:
высокие температуры кипения и плавления
2) при замерзании расширяется
3) плотность твердого состояния ниже, чем у жидкого
Слайд 13Твердое состояние
При охлаждении жидкости снижается кинетическая энергия частиц.
Частицы утрачивают
поступательное движение и только колеблются около своего положения.
Средние расстояния
между микрочастицами равны размеру частиц.
Имеют «дальний»порядок.
«Дальний порядок» - достаточно знать ближнее окружение частиц, чтобы иметь возможность предвидеть их расположение во всем объёме твердого тела.
Носителями свойств твердого тела является фаза.
Твёрдые тела имеют собственную форму, не сжимаемы и механическую прочность, у них отсутствует текучесть.
Твердые вещества имеют аморфное или кристаллическое состояния
Слайд 14Аморфное состояние.
Не имеют упорядоченной структуры.
Наблюдается «ближний» порядок.
3) Медленно текут.
4)
Изотропны - имеют одинаковые свойства во всех направлениях.
5)Плавятся не
при определенной температуре, а в интервале температур.
Вещества в аморфном состоянии называют переохлажденными жидкостями с аномально высокой вязкостью.
Аморфное состояние ещё называют стеклообразным.
Многие полимеры находятся в аморфном состоянии.
Слайд 15Кристаллическое состояние
1) частицы расположены регулярно
2) имеется «дальний» порядок.
3) Плавятся
при определенной температуре. Из твердого в жидкое состояние переходят скачкообразно.
4)
расположение частиц изображается в виде решетки: в узлах находятся частицы, соединенные воображаемыми линиями.
Грани тела - поверхностные слои атомов, направленные друг к другу под определенными углами.
5) монокристаллы обладают анизотропными свойствами: величина того или иного параметра в кристалле будет различной в направлении разных его осей.
Поликристаллические вещества состоят из множества кристаллов, ориентированных по разным осям координат, поэтому в поликристаллических телах анизотропия не проявляется.
Кристаллическая структура энергетически более устойчива, чем аморфная, т.к. регулярное расположение частиц в кристалле позволяет устанавливать между собой максимальное число связей, что способствует снижению запаса внутренней энергии.
Слайд 16Различают агрегатное и фазовое состояния вещества.
Агрегатное состояние вещества – определяется
способностью его образца сохранять собственный объём и форму.
Фазовое состояние
вещества определяется упорядоченностью его внутренней структуры.
Слайд 18Мезомерное состояние
Мезоморфное состояние промежуточное между твердым и жидким состоянием.
Образуют
вещества, состоящие из цепных молекул.
При плавлении или растворении таких
веществ получают жидкие системы(по агрегатному состоянию), но с анизотропными свойствами (признак кристаллического состояния) - жидкими кристаллами.
Их частицы располагаются так, чтобы все молекулы были ориентированы в одном направлении, но могли перемещаться друг относительно друга, сохраняя ориентацию.
Ориентация молекул и прозрачность жидких кристаллов меняется под действием температуры, электрических и магнитных полей, механических напряжений.
Используют в термометрах, дисплеях, цифровых индикаторах.
Слайд 19Различают: термотропные (плавление кристалла) и лиотропные (растворение вещества).
По структуре
жидкие кристаллы бывают:
а) нематические (нить)
б) смектические (мыло).
Слайд 20Характеристики кристаллов
Координационное число - число частиц, непосредственно примыкающих у данной
частице в кристалле.
Чем больше координационное число, тем плотнее упаковка
кристалла.
Постоянная кристаллической решетки - расстоянием между центрами частиц, занимающих узлы в кристалле, в направлении характеристических осей.
Энергия кристаллической решетки - энергия, необходимую для разрушения одного моля кристалла и удаления частиц за пределы их взаимодействия (кДж/моль).
Полиморфизм –способность одного вещества в зависимости от условий иметь различную кристаллическую структуру.
Полиморфизм простых веществ – частный случай аллотропии химических элементов.
Аллотропия - способность элемента существовать в различных формах (модификациях).
Изоморфизм (равномерность) способность различных веществ образовывать кристаллы, решетки которых имеют одинаковые параметры, если частицы, из которых они состоят, близки по размера, и между ними существуют сходные связи.
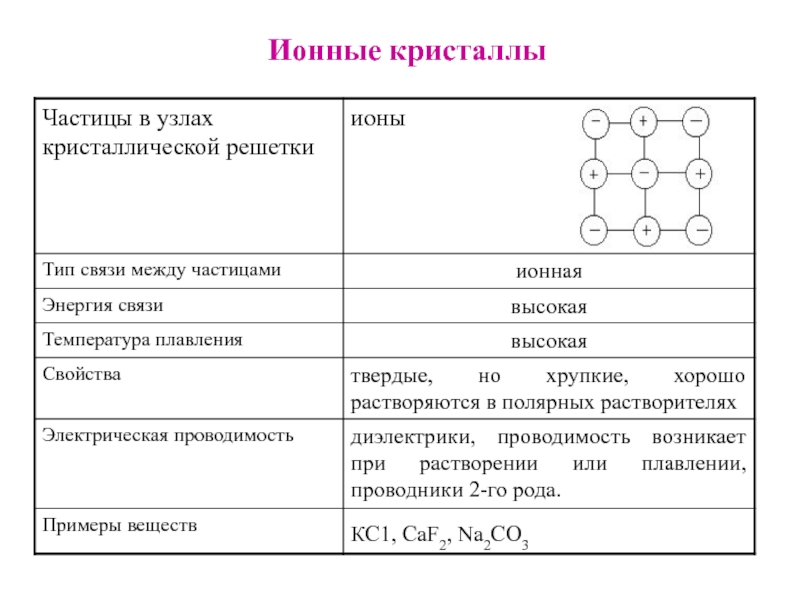
Слайд 21Типы кристаллических решеток
Различают молекулярные; атомно-ковалентные; ионные и металлические.
Атомные кристаллы
Слайд 24Металлические кристаллы.
Пластичность – способность металла под действием механических сил
необратимо изменять свою форму – деформироваться.
Слайд 25Кристаллы со смешанными связями
Определенный вид химической связи в чистом виде
в кристаллах встречается редко. Обычно между частицами существуют сложные взаимодействия,
которые можно описать наложением двух или более видов связей друг на друга.
Например, в молекулярном кристалле воды кроме ван-дер-ваальсовых сил возникают водородные связи, упрочняющие кристалл.
Слайд 26Зонная теория кристаллов
В кристалле число МО равно сумме АО
отдельных атомов. Если учитывать только внешние s и р орбитали,
то при содержании в кристалле огромного числа N атомов (для 1 см3 порядка 1022 – 1023) в нем имеется 4N МО. Число МО может быть ещё больше за счет комбинации d и f орбиталей (на 5N + 7N).
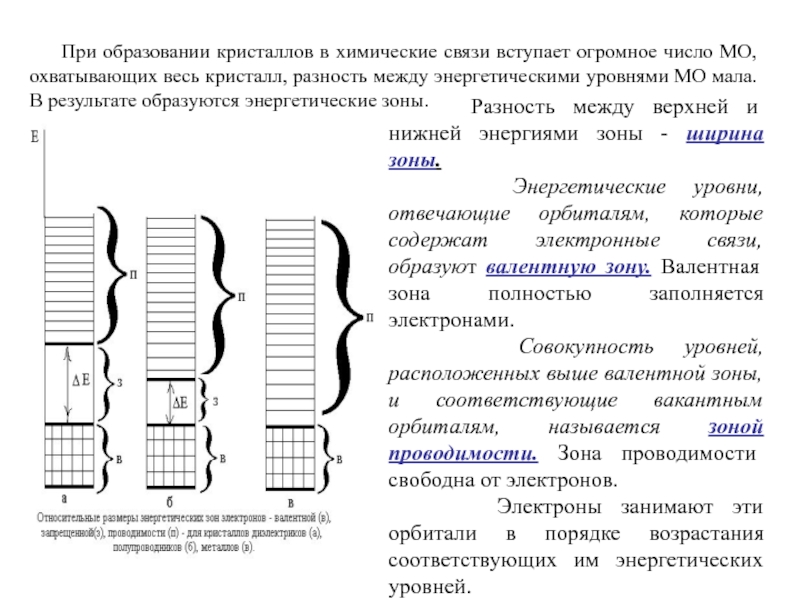
Слайд 27При образовании кристаллов в химические связи вступает огромное число МО,
охватывающих весь кристалл, разность между энергетическими уровнями МО мала. В
результате образуются энергетические зоны.
Разность между верхней и нижней энергиями зоны - ширина зоны.
Энергетические уровни, отвечающие орбиталям, которые содержат электронные связи, образуют валентную зону. Валентная зона полностью заполняется электронами.
Совокупность уровней, расположенных выше валентной зоны, и соответствующие вакантным орбиталям, называется зоной проводимости. Зона проводимости свободна от электронов.
Электроны занимают эти орбитали в порядке возрастания соответствующих им энергетических уровней.
Слайд 28Из-за близости энергетических уровней электроны способны переходить с уровня на
уровень, осуществляя между атомами нелокализованные связи.
Валентная зона и зона проводимости
либо могут перекрываться, либо не перекрываться друг с другом.
Если зоны не перекрываются, то между ними существует запрещенная зона с шириной ΔЕ.
Ширину запрещенной зоны определяет тип кристалла: металла, полупроводника, диэлектрика.
В зависимости от структуры атомов и особенностей кристаллической решетки вещества могут быть диэлектриками (ΔЕ > 3 эВ), полупроводниками (ΔЕ от 0,1 до 3 эВ), проводниками (металлы).
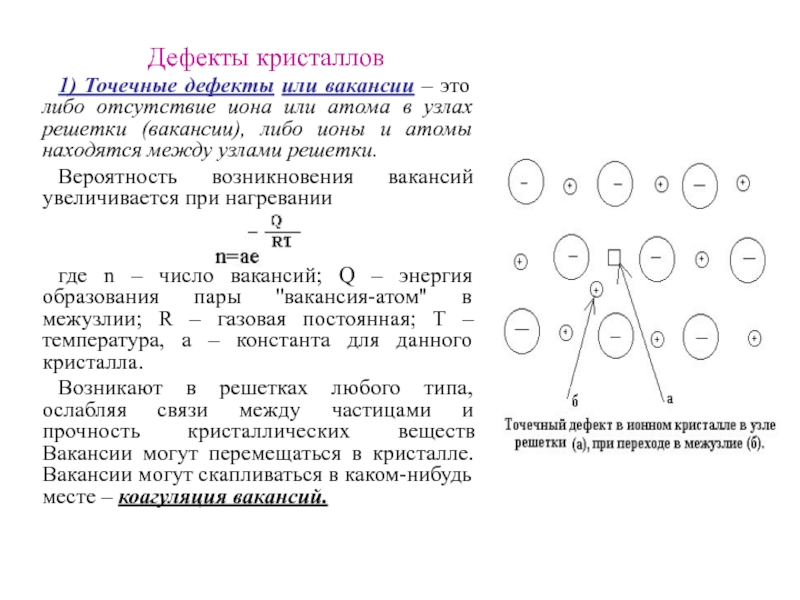
Слайд 29Дефекты кристаллов
1) Точечные дефекты или вакансии – это либо отсутствие
иона или атома в узлах решетки (вакансии), либо ионы и
атомы находятся между узлами решетки.
Вероятность возникновения вакансий увеличивается при нагревании
где n – число вакансий; Q – энергия образования пары ''вакансия-атом'' в межузлии; R – газовая постоянная; Т –температура, а – константа для данного кристалла.
Возникают в решетках любого типа, ослабляя связи между частицами и прочность кристаллических веществ Вакансии могут перемещаться в кристалле. Вакансии могут скапливаться в каком-нибудь месте – коагуляция вакансий.
Слайд 30Причины точечных дефектов:
1) тепловое движение частиц,
Частицы, с высокими энергиями, вырываются
из состояния равновесия (узла решетки) и переходят в межузлие на
более высокий энергетический уровень. При увеличении температуры число таких частиц увеличивается.
2) наличие в кристаллах примесей
Обусловлены примесями, попадающими в твердое тело при его кристаллизации. Примеси могут вызывать полупроводниковые свойства некоторых твердых тел с ковалентной решеткой., (I2O3)0,1).
3) нестехиометрия кристаллов
Из-за наличия дефектов некоторые ионные кристаллы обладают ионной проводимостью и называются твердыми электролитами ( (ZrO2)0,9
Слайд 312) Линейные дефекты или дислокация –это нарушение идеального расположения групп
частиц, которые можно расположить вдоль воображаемой прямой или кривой линии.
Возникают при пластических деформациях и нарушении совпадения кристаллических плоскостей.
Могут зарождаться за счет внешней силы, и за счет внутренних напряжений (при нагреве или охлаждении).
Дислокации бывают положительные и отрицательные.
Могут перемещаться в теле кристалла, накапливаться в месте наибольших напряжений.
Могут выходить на поверхность кристалла и создавать нарушения поверхностного слоя.
Винтовые дислокации возникают при деформации сдвига.
3) Плоские дефекты это смещение положения групп частиц, которые можно расположить на какой-нибудь плоскости.
Слайд 32Кристаллы переменного состава.
При образовании вакансии химический состав твердых тел изменяются.
Например, TiO стабильно существeует при изменении состава от TiO0,6 до
TiО1,33 при этом тип кристаллической решетки не изменяется.
Такие соединения называются нестехиометрическими или переменными.
Соединения переменного состава называются бертоллидами, а постоянного состава дальтонидами.
Образование нестехиометрических соединений вызывает изменение степеней окисления.
Например, при образовании оксида железа (II) FеО1+х, часть Fe(II) →Fe (III).
Из-за дефектов может меняться окраска соединения.
Например, окраска бронзы NахWO3 изменяется от желтого до сине-зеленого цвета через красный и фиолетовый цвета, когда х уменьшается от 1 до 0,3.
Слайд 33Кристаллы включения
В кристаллическую решетку из-за большого расстояния между плоскостями,
и низкой энергией связи между плоскостями могут внедряться атомы других
элементов, в результате образуются слоистые соединения (интеркаляты)..
Например, в кристалл графита могут внедряться фтор, щелочные металлы.
Слоистые соединения - разновидностью класса соединений - клараты или соединения включения: которые образованы включением молекул (гостей) в полости кристаллического каркаса, состоящего из частиц другого вида (хозяев).
Например, кларат состава СН4*6Н2О, в котором на 46 молекул воды имеется 8 полостей, занятых метаном.
Нестехиометрические соединения обладают высокотемпературной сверхпроводимостью.
Например, соединение La2-хВахСuО4δ (где δ – нестехиометричность соединения) критическая температура 30-35К.
Соединения с высокими значениями Тк называются высокотемпературными сверх полупроводниками., т.к. у некоторых из них Тк приближается к температуре жидкого азота.