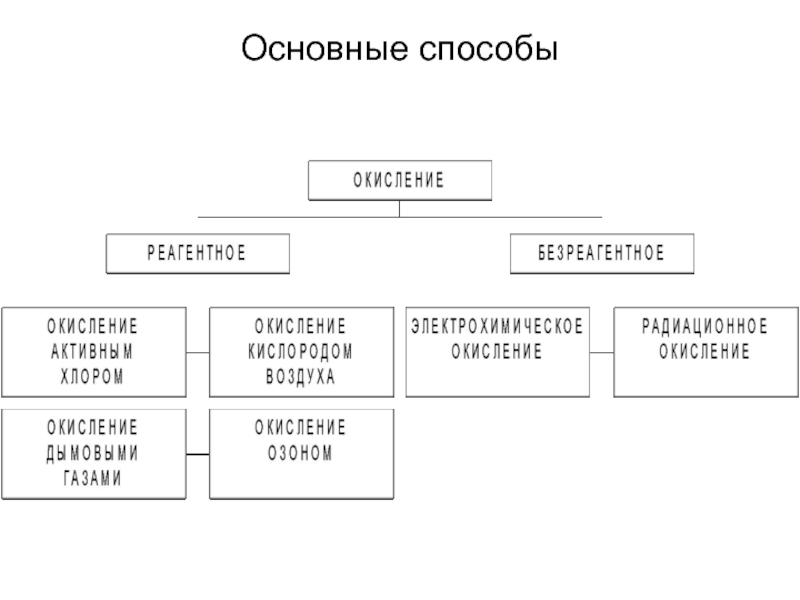
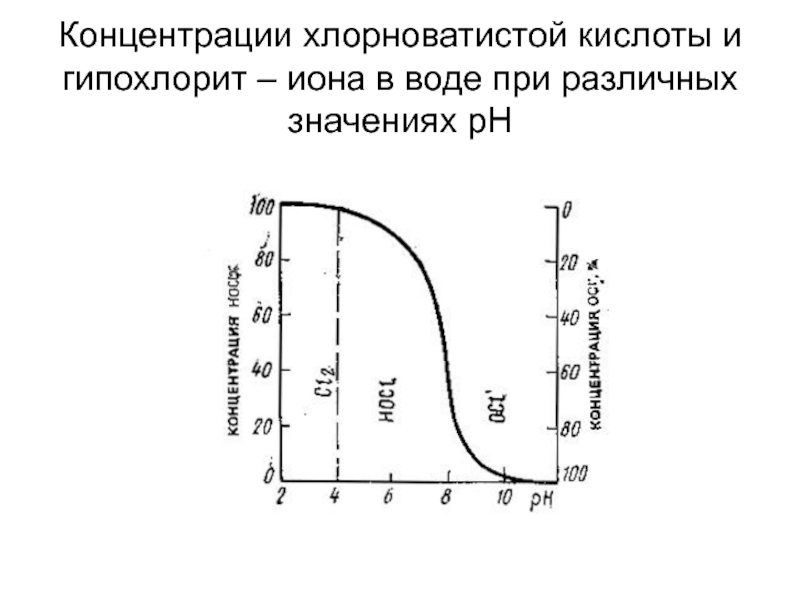
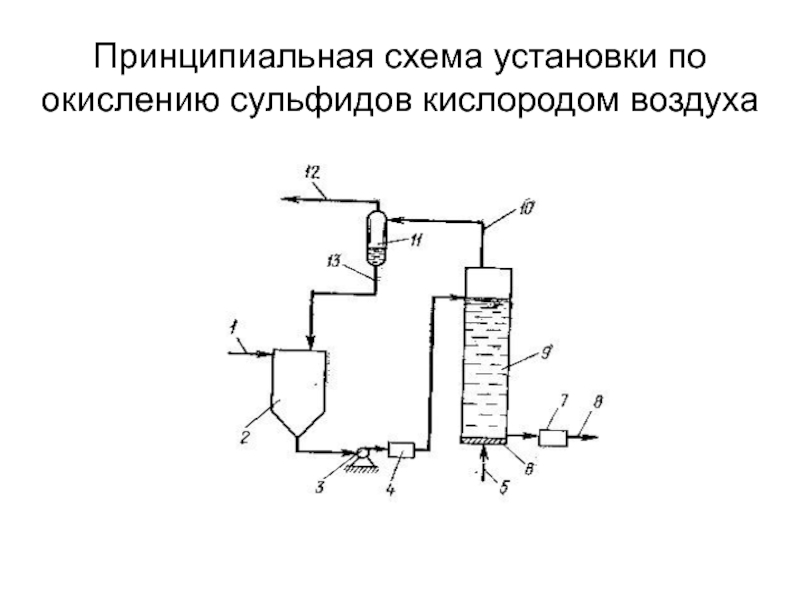
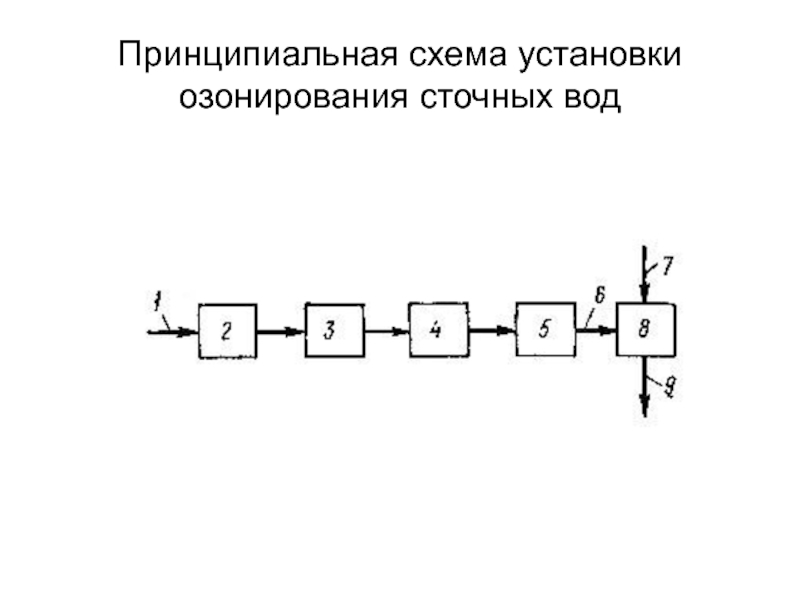
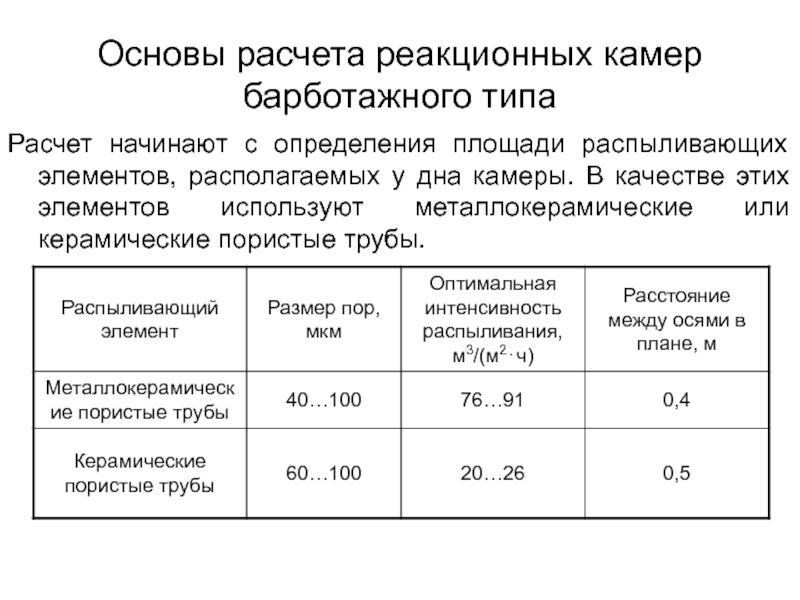
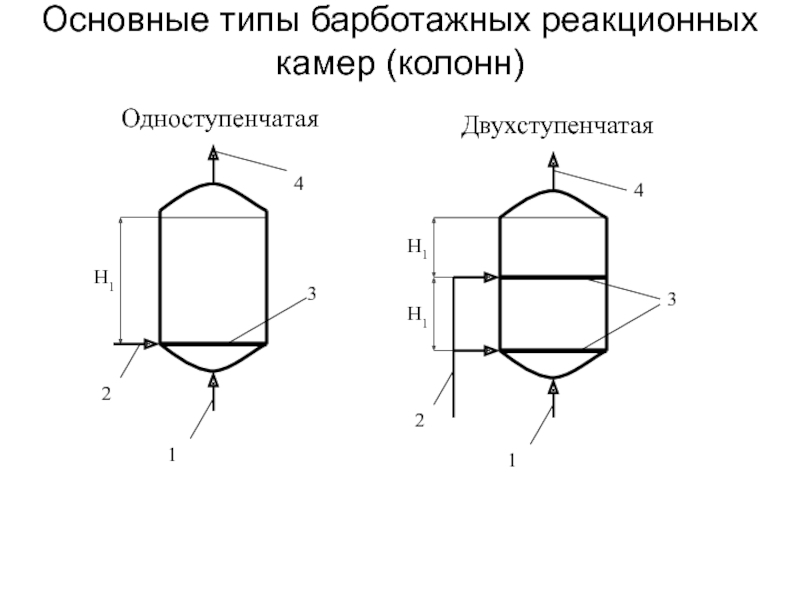
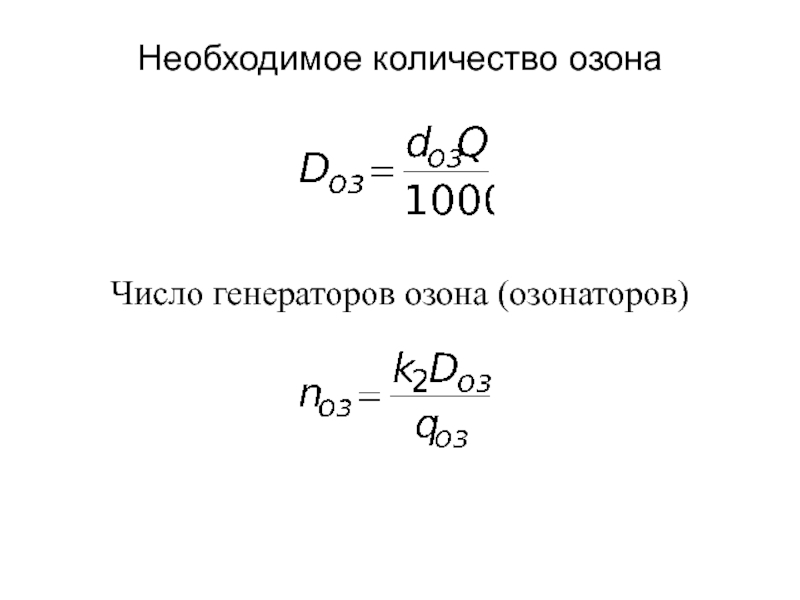
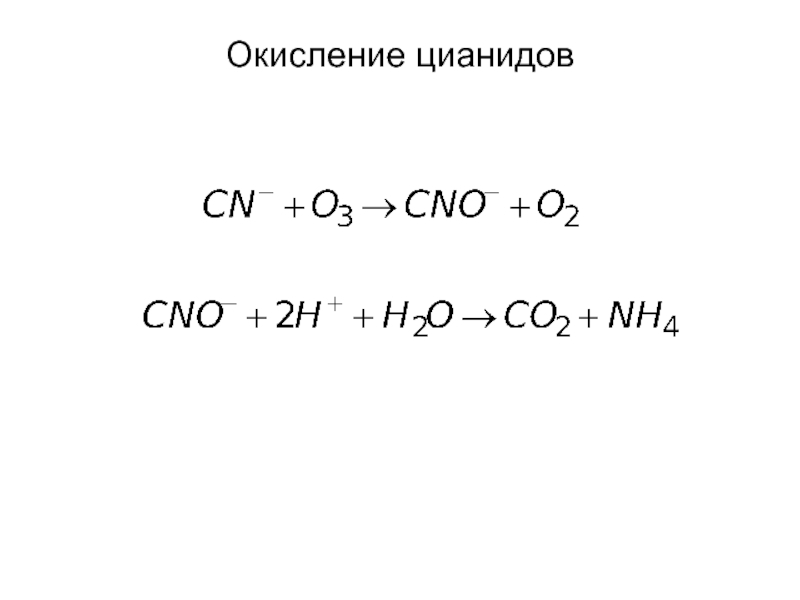
от атомов или ионов.
Область применения:
обработка вод, содержащих токсичные примеси
или соединения, которые нецелесообразно извлекать из воды;обработка вод, которые нецелесообразно очищать другими методами.