Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
3lipidy_membran_2_chast.ppt
Содержание
- 1. 3lipidy_membran_2_chast.ppt
- 2. ПОДВИЖНОСТЬ ЛИПИДОВ В МЕМБРАНЕ
- 3. ИЗМЕНЕНИЕ ОРИЕНТАЦИИ ПОЛЯРНЫХ ГОЛОВЛАТЕРАЛЬНОЕ ДВИЖЕНИЕКОЛЕБАНИЯ АЦИЛЬНЫХ ЦЕПЕЙОБРАЗОВАНИЕ
- 4. I – изменение ориентации полярных головII –
- 5. ДИНАМИКА ЛИПИДОВ В МЕМБРАНЕабва) ротационная подвижность(10-9 с)б)
- 6. УПАКОВКА ЛИПИДОВ В МЕМБРАНЕ, ПОДВИЖНОСТЬ ЖИРНОКИСЛОТНЫХ ХВОСТОВ, ОБРАЗОВАНИЕ КИНКОВ
- 7. ПРОСТРАНСТВЕННАЯ КОНФОРМАЦИЯ ЖИРНЫХ КИСЛОТ1 – насыщенная углеводородная
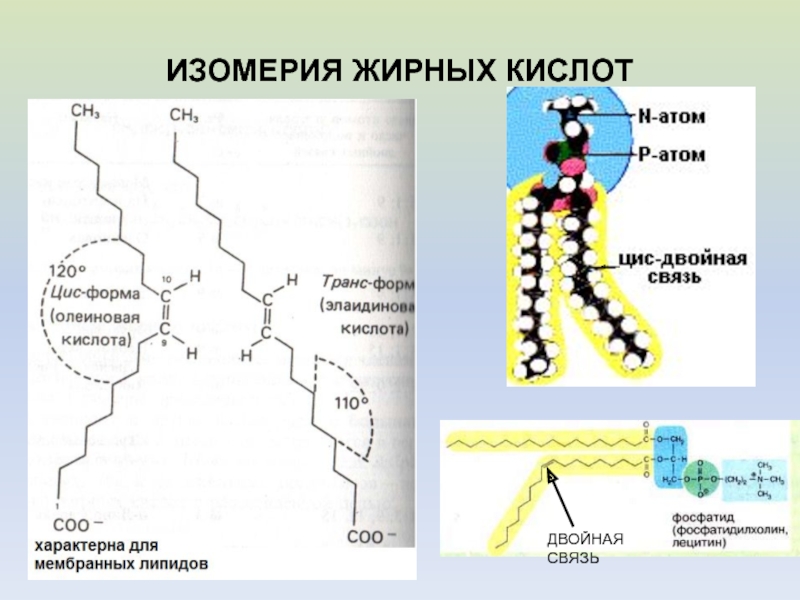
- 8. ИЗОМЕРИЯ ЖИРНЫХ КИСЛОТДВОЙНАЯ СВЯЗЬ
- 9. ОБРАЗОВАНИЕ ДЕФЕКТОВ В МЕМБРАННОМ БИСЛОЕ
- 10. ГЕОМЕТРИЯ БИСЛОЯРАЗМЕРЫ МОЛЕКУЛЫ ЛИПИДА: ХВОСТ 2 НМ,
- 11. вращение вокруг С-С связей ничем не ограничено
- 12. I – кинки отсутствуютII – один кинк
- 13. ТРАНС-ГОШ-ИЗОМЕРИЗАЦИЯ – ИЗМЕНЕНИЕ КОНФОРМАЦИИ МОЛЕКУЛ ЗА СЧЕТ
- 14. Слайд 14
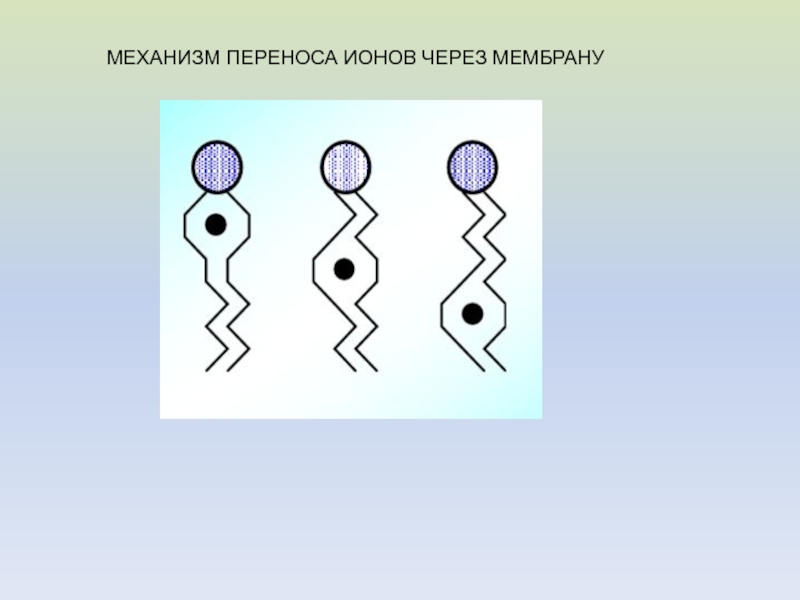
- 15. МЕХАНИЗМ ПЕРЕНОСА ИОНОВ ЧЕРЕЗ МЕМБРАНУ
- 16. ПЕРЕНОС ЧАСТИЦЫ ЧЕРЕЗ МЕМБРАНУ БЛАГОДАРЯ КИНКАМНа рисунке
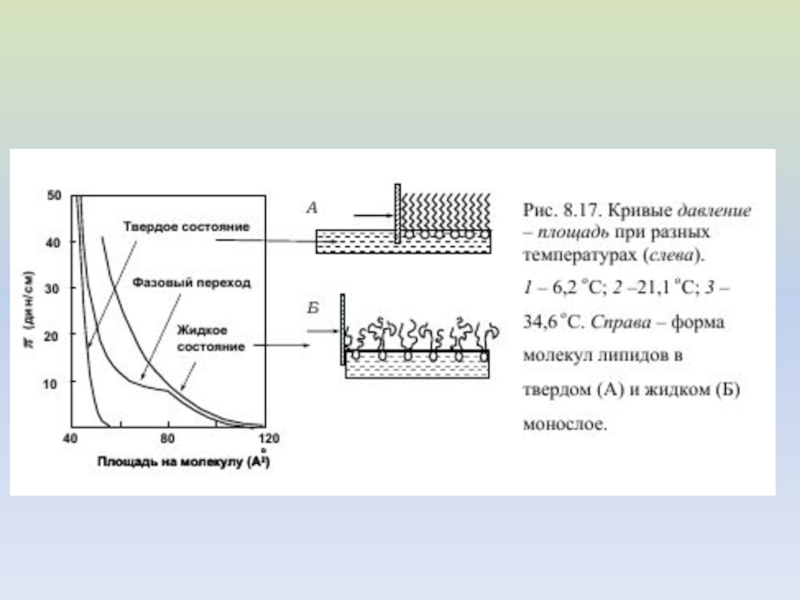
- 17. ФАЗОВЫЕ ПЕРЕХОДЫ В ЛИПИДНОМ БИСЛОЕ
- 18. Структуры, образуемые в водных суспензиях липидами, склонными
- 19. Слайд 19
- 20. Слайд 20
- 21. Схематическое изображение четырех фазовых состояний ламеллярного бислоя,
- 22. РАЗДЕЛЕНИЕ ФАЗ В ГЕТЕРОГЕННОМ БИСЛОЕ (А) С
- 23. Слайд 23
- 24. МЕТОД ДИФФЕРЕНЦИАЛЬНОЙ СКАНИРУЮЩЕЙ МИКРОКАЛОРИМЕТРИИМетод, основанный на измерении
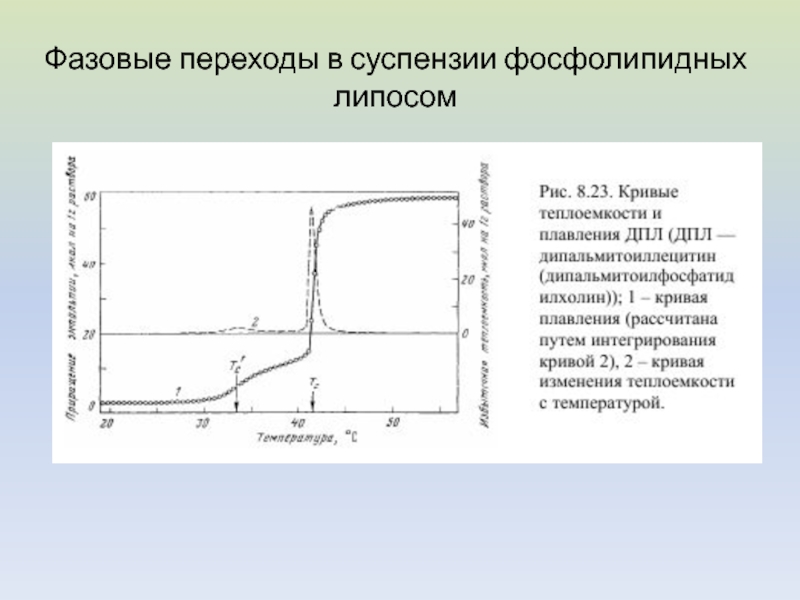
- 25. Фазовые переходы в суспензии фосфолипидных липосом
- 26. Слайд 26
- 27. Анализ кривых ДСК Пусть удельная теплота плавления
- 28. В интервале температур от T1 до текущей
- 29. Слайд 29
- 30. Слайд 30
- 31. Перед приготовлением липосом к фосфолипидам было добавлено
- 32. ИЗМЕНЕНИЕ УПАКОВКИ БИСЛОЯ ПРИ ТЕРМОИНДУЦИРОВАННОМ ФАЗОВОМ ПЕРЕХОДЕ
- 33. Гигантские везикулы, состоящих из насыщенного (ДПФХ) и
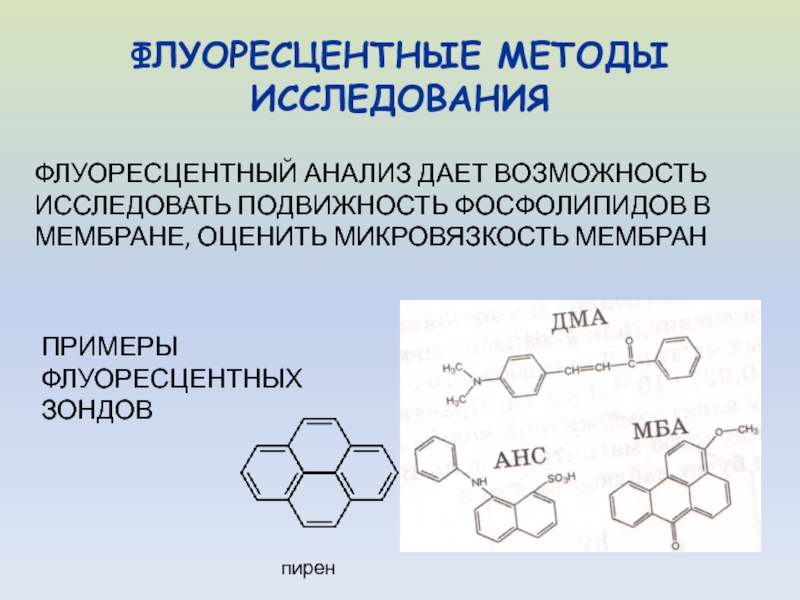
- 34. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯФЛУОРЕСЦЕНТНЫЙ АНАЛИЗ ДАЕТ ВОЗМОЖНОСТЬ ИССЛЕДОВАТЬ
- 35. Измерение флуоресценции зондов
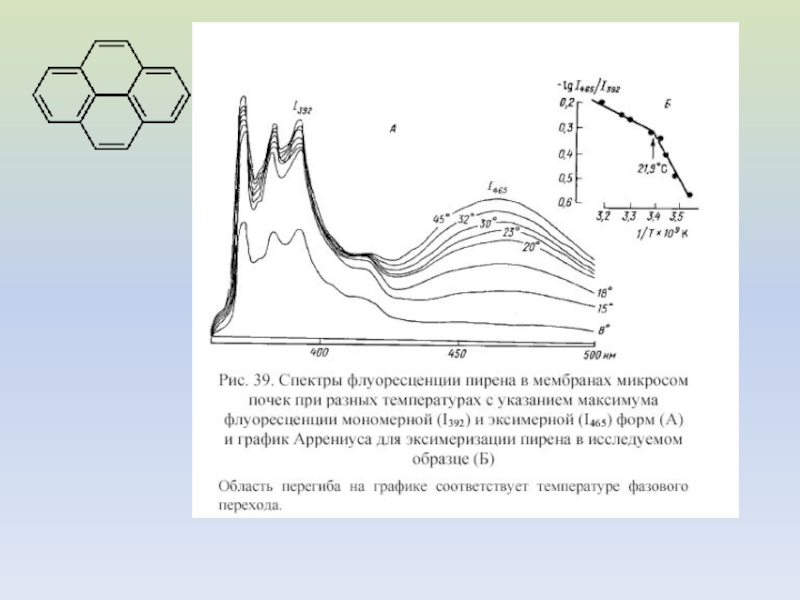
- 36. Слайд 36
- 37. Слайд 37
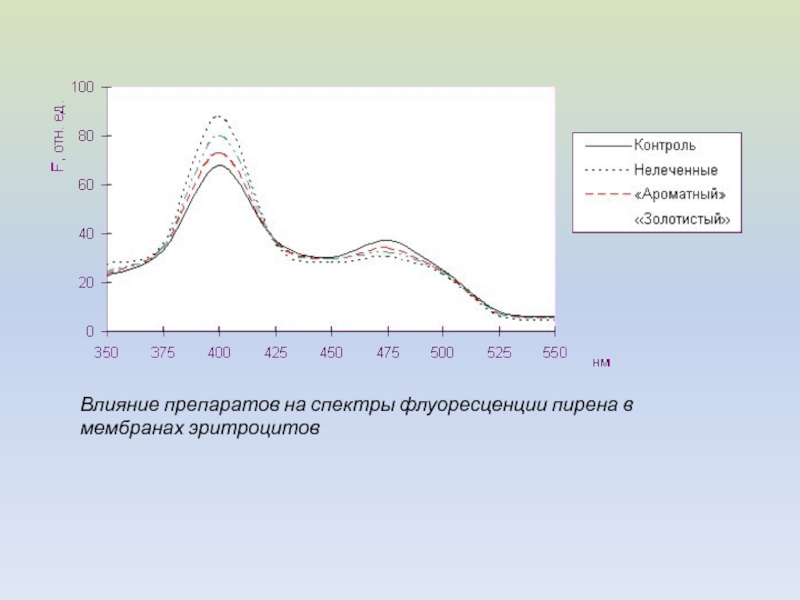
- 38. Влияние препаратов на спектры флуоресценции пирена в мембранах эритроцитов
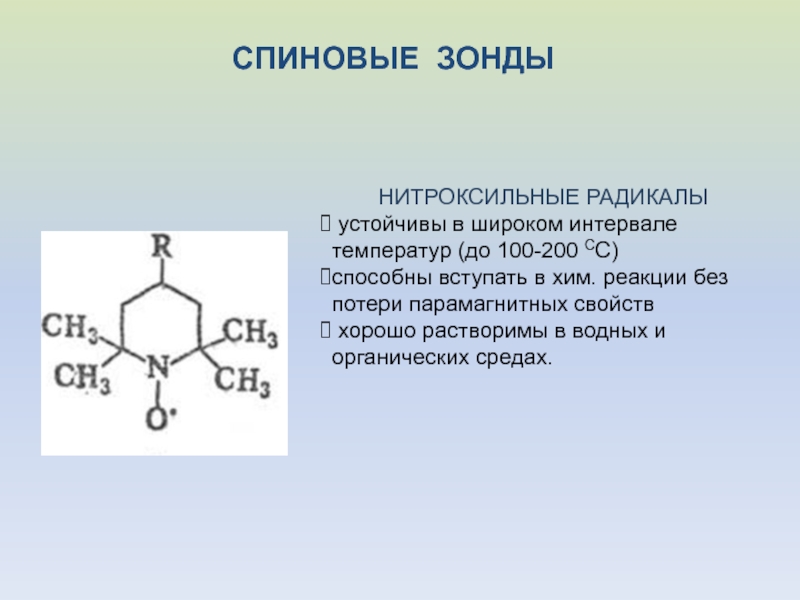
- 39. СПИНОВЫЕ ЗОНДЫНИТРОКСИЛЬНЫЕ РАДИКАЛЫ устойчивы в широком интервале
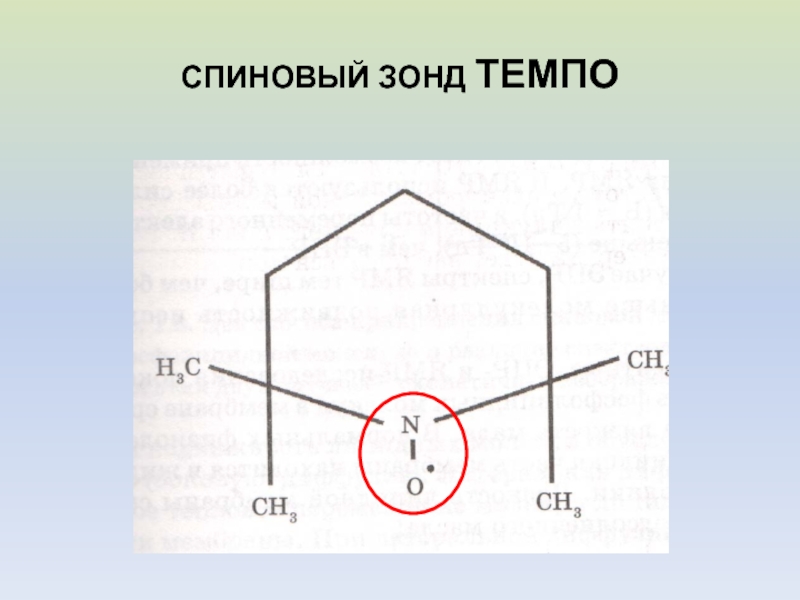
- 40. СПИНОВЫЙ ЗОНД ТЕМПО
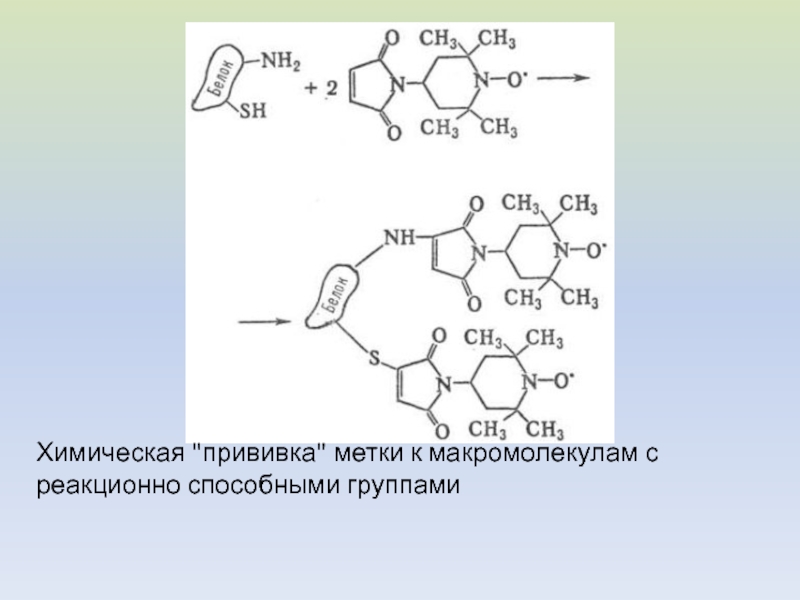
- 41. Химическая "прививка" метки к макромолекулам с реакционно способными группами
- 42. Реакции макромолекул с бирадикалами и спиновыми ловушками.
- 43. Спектры ЭПРСпектры ЭПР нитроксильных радикалов в вязких
- 44. Слайд 44
- 45. ИЗМЕНЕНИЕ СПЕКТРА ЭПР ПРИ УМЕНЬШЕНИИ МИКРОВЯЗКОСТИ ηННI
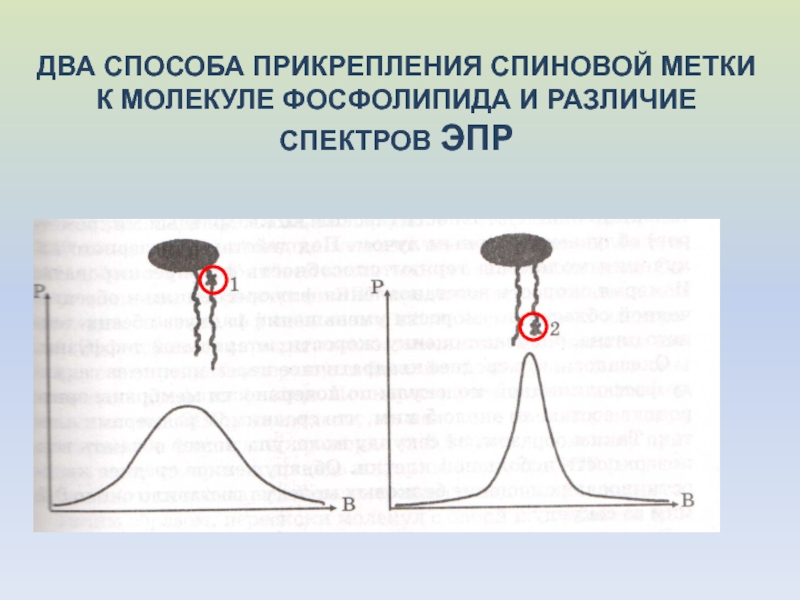
- 46. ДВА СПОСОБА ПРИКРЕПЛЕНИЯ СПИНОВОЙ МЕТКИ К МОЛЕКУЛЕ ФОСФОЛИПИДА И РАЗЛИЧИЕ СПЕКТРОВ ЭПР
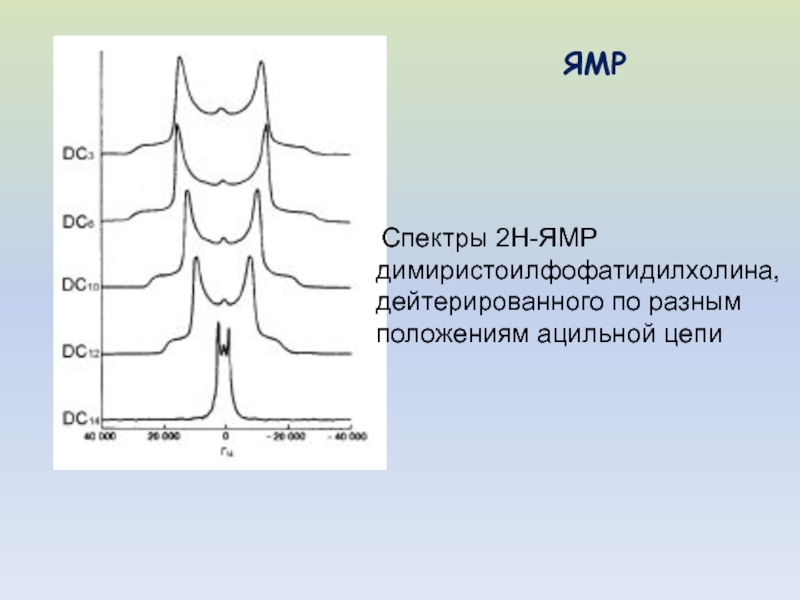
- 47. Спектры 2Н-ЯМР димиристоилфофатидилхолина, дейтерированного по разным положениям ацильной цепи ЯМР
- 48. Величины подвижности Т1 для различных атомов углерода
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3
ИЗМЕНЕНИЕ ОРИЕНТАЦИИ ПОЛЯРНЫХ ГОЛОВ
ЛАТЕРАЛЬНОЕ ДВИЖЕНИЕ
КОЛЕБАНИЯ АЦИЛЬНЫХ ЦЕПЕЙ
ОБРАЗОВАНИЕ КИНКОВ И ПЕРЕМЕЩЕНИЕ
ИХ ВДОЛЬ АЦИЛЬНЫХ ЦЕПЕЙ
Слайд 4I – изменение ориентации полярных голов
II – латеральная диффузия
III –
колебания жирнокислотных цепей
IV – образование кинков
V – ротационная подвижность
VI –
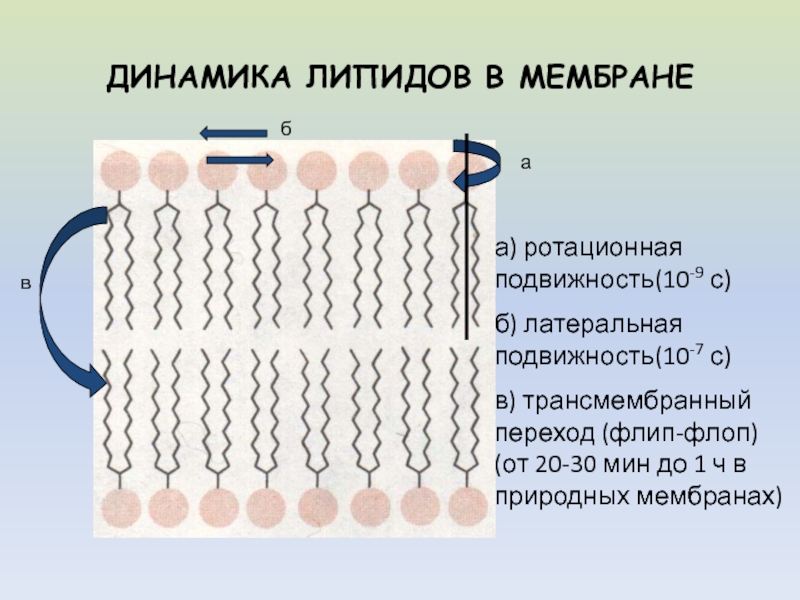
флип-флопСлайд 5ДИНАМИКА ЛИПИДОВ В МЕМБРАНЕ
а
б
в
а) ротационная подвижность(10-9 с)
б) латеральная подвижность(10-7 с)
в)
трансмембранный переход (флип-флоп) (от 20-30 мин до 1 ч в
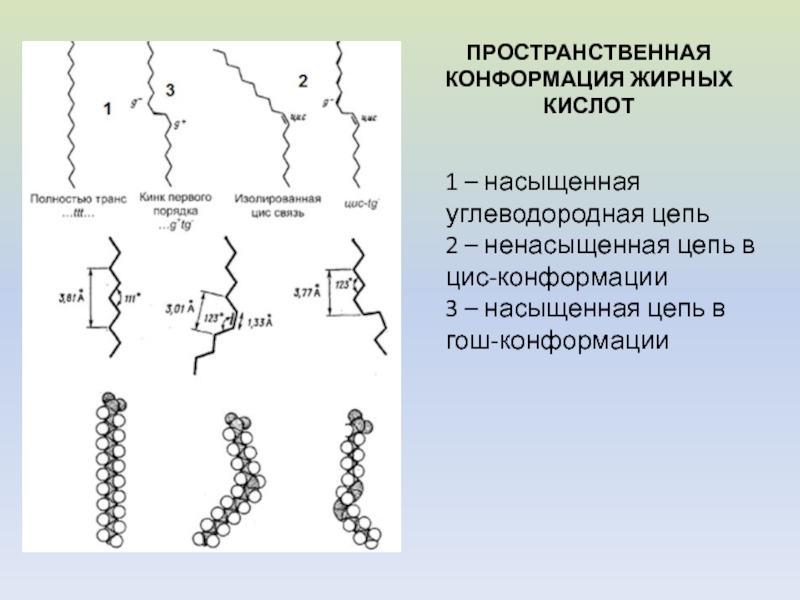
природных мембранах)Слайд 7ПРОСТРАНСТВЕННАЯ КОНФОРМАЦИЯ ЖИРНЫХ КИСЛОТ
1 – насыщенная углеводородная цепь
2 – ненасыщенная
цепь в цис-конформации
3 – насыщенная цепь в гош-конформации
Слайд 10ГЕОМЕТРИЯ БИСЛОЯ
РАЗМЕРЫ МОЛЕКУЛЫ ЛИПИДА: ХВОСТ 2 НМ, ГОЛОВКА 0,5 –
0,7 НМ,
РАССЧИТАННАЯ ТОЛЩИНА БИСЛОЯ 5,0 – 5,4 НМ
В ДЕЙСТВИТЕЛЬНОСТИ:ТОЛЩИНА
БИСЛОЯ ЛИПИДОВ В МЕМБРАНЕ 3,5 – 4 НМСЛЕДОВАТЕЛЬНО, ЖИРНЫЕ КИСЛОТЫ РАСПОЛОЖЕНЫ В БИСЛОЕ РЫХЛО
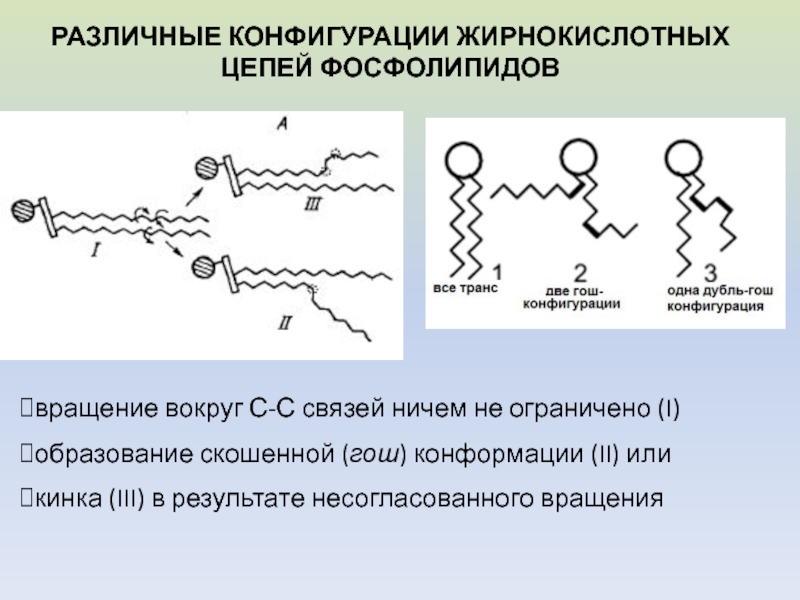
Слайд 11вращение вокруг С-С связей ничем не ограничено (I)
образование скошенной (гош)
конформации (II) или
кинка (III) в результате несогласованного вращения
РАЗЛИЧНЫЕ КОНФИГУРАЦИИ
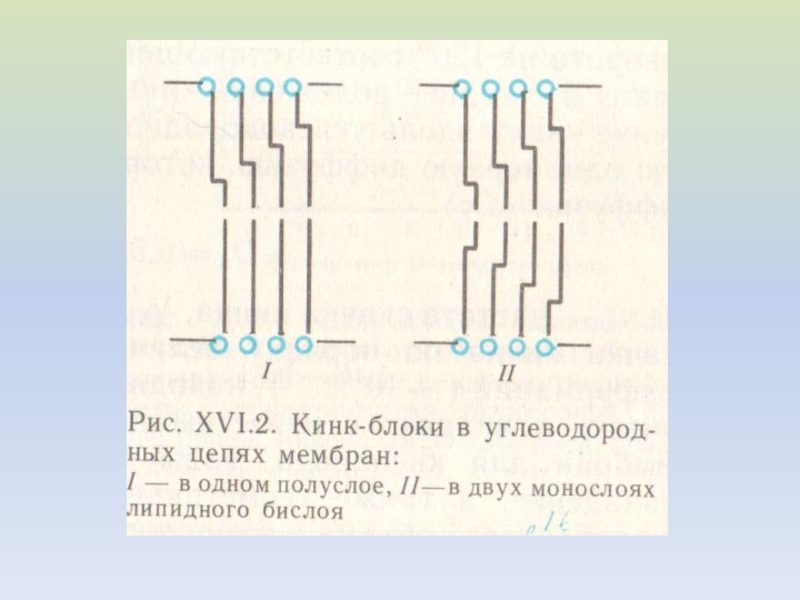
ЖИРНОКИСЛОТНЫХ ЦЕПЕЙ ФОСФОЛИПИДОВСлайд 12I – кинки отсутствуют
II – один кинк на жирнокислотную цепь
III
– два кинка на жирнокислотную цепь
Влияние кинков на упаковку бислоя
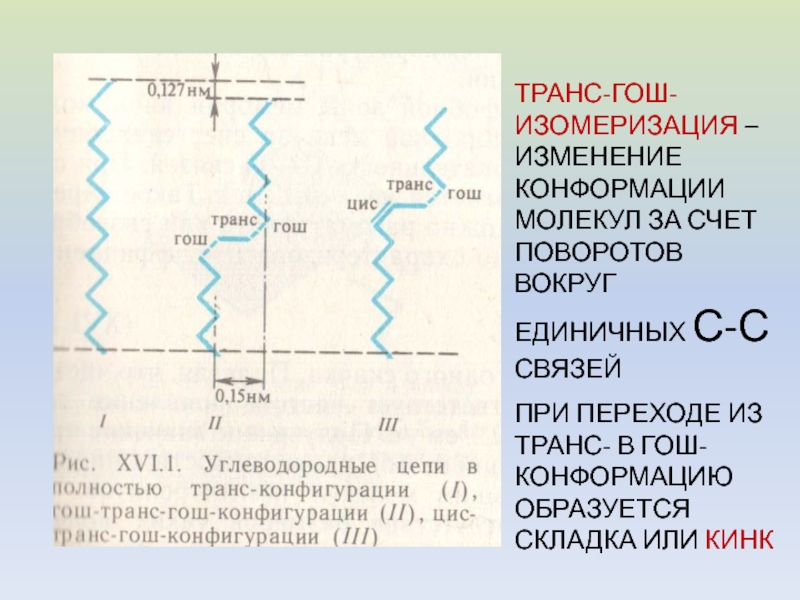
Слайд 13ТРАНС-ГОШ-ИЗОМЕРИЗАЦИЯ – ИЗМЕНЕНИЕ КОНФОРМАЦИИ МОЛЕКУЛ ЗА СЧЕТ ПОВОРОТОВ ВОКРУГ ЕДИНИЧНЫХ
С-С СВЯЗЕЙ
ПРИ ПЕРЕХОДЕ ИЗ ТРАНС- В ГОШ-КОНФОРМАЦИЮ ОБРАЗУЕТСЯ СКЛАДКА ИЛИ
КИНКСлайд 16
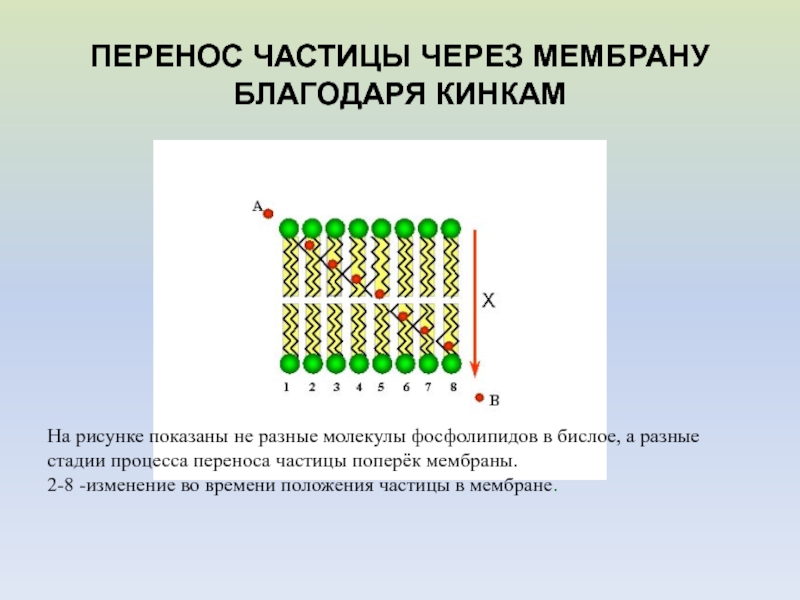
ПЕРЕНОС ЧАСТИЦЫ ЧЕРЕЗ МЕМБРАНУ БЛАГОДАРЯ КИНКАМ
На рисунке показаны не разные
молекулы фосфолипидов в бислое, а разные стадии процесса переноса частицы
поперёк мембраны.2-8 -изменение во времени положения частицы в мембране.
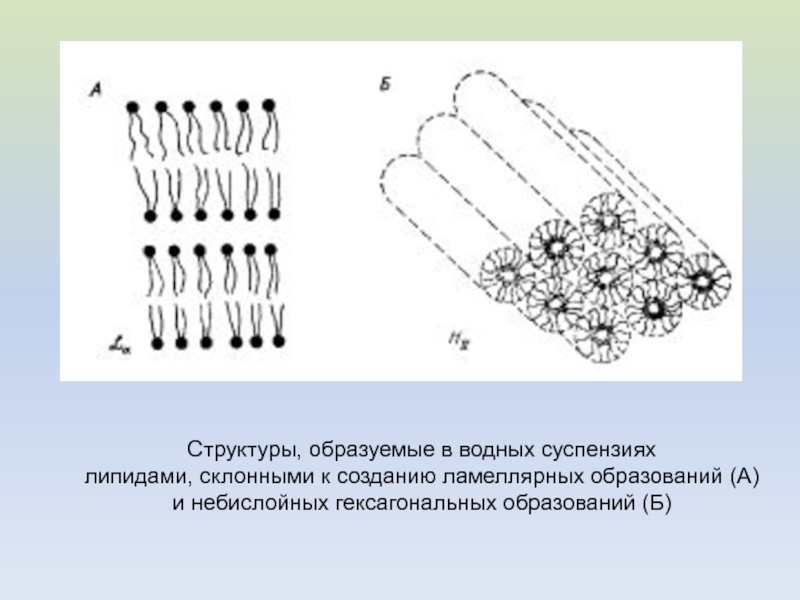
Слайд 18Структуры, образуемые в водных суспензиях
липидами, склонными к созданию ламеллярных
образований (А)
и небислойных гексагональных образований (Б)
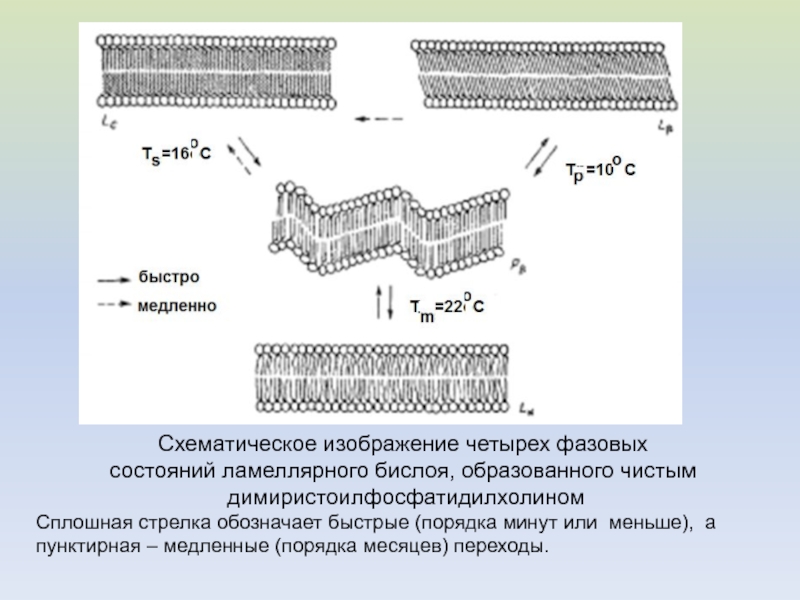
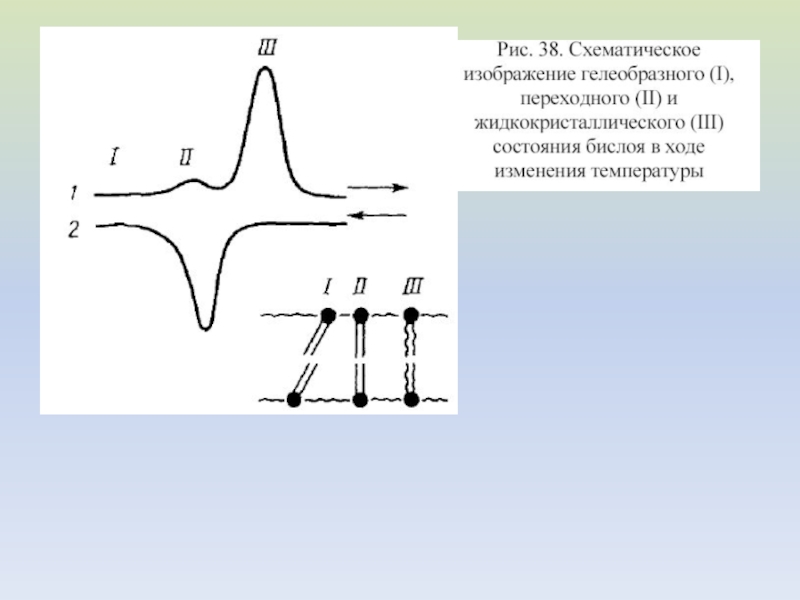
Слайд 21Схематическое изображение четырех фазовых
состояний ламеллярного бислоя, образованного чистым
димиристоилфосфатидилхолином
Сплошная стрелка обозначает быстрые (порядка минут или меньше), а
пунктирная – медленные (порядка месяцев) переходы.
Слайд 22РАЗДЕЛЕНИЕ ФАЗ В ГЕТЕРОГЕННОМ БИСЛОЕ (А) С ОДНОВРЕМЕННЫМ ФАЗОВЫМ ПЕРЕХОДОМ
ЧАСТИ БИСЛОЯ (Б) ПОД ВЛИЯНИЕМ ТЕМПЕРАТУРЫ
Кооперативность фазовых переходов
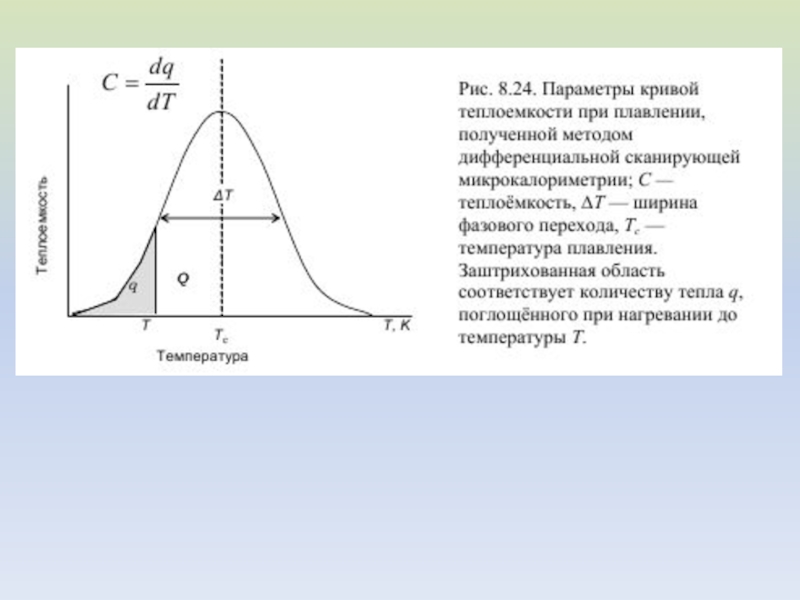
Слайд 24МЕТОД ДИФФЕРЕНЦИАЛЬНОЙ СКАНИРУЮЩЕЙ МИКРОКАЛОРИМЕТРИИ
Метод, основанный на измерении разницы тепловых потоков,
идущих от испытуемого образца и образца сравнения.
Слайд 27Анализ кривых ДСК
Пусть удельная теплота плавления липида равна Qm,
количество липидов в образце - m кмоль.
Общее количество
энергии, поглощённой образцом во всем интервале температур плавления T1–T2 равно площади под кривой C = f(T)
Слайд 28В интервале температур от T1 до текущей температуры T расплавится
количество молей
липида ml, и при этом поглотится количество тепла,
равное При температуре T мольная доля липидов, находящихся в жидкой фазе равна
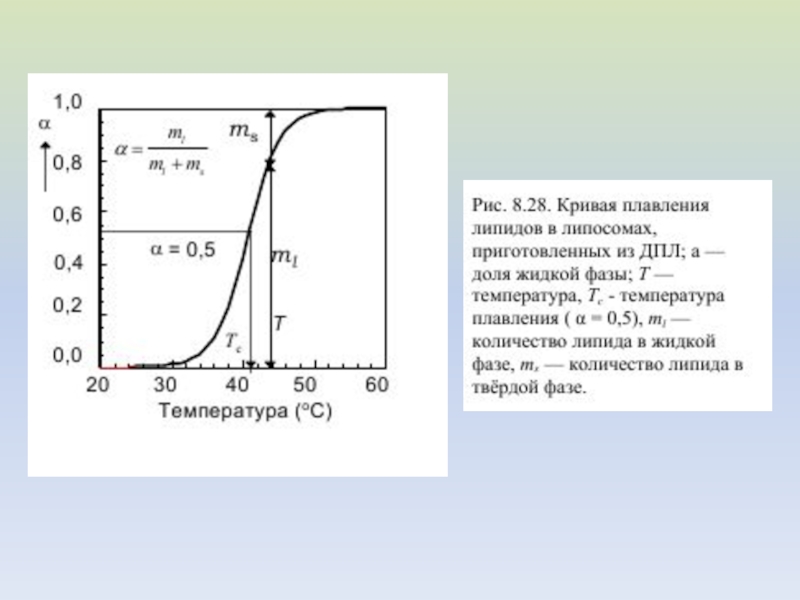
Измеряя отношение площадей под кривой C=f(T) при разных температурах можно построить кривую плавления α = f(T)
Слайд 31
Перед приготовлением липосом к фосфолипидам было добавлено разное количество холестерина;
его содержание в молярных процентах указано у кривых. По оси ординат
отложена теплоемкость, по оси абсцисс - температура, K.С
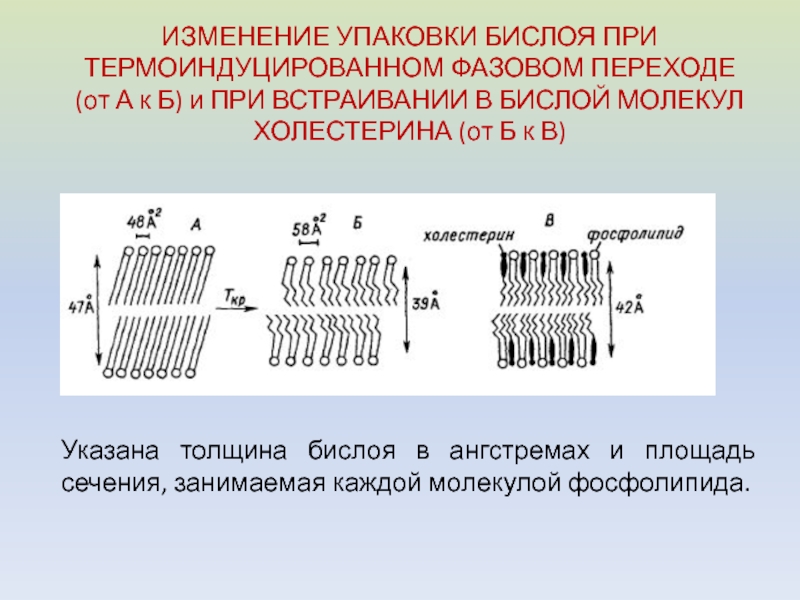
Слайд 32ИЗМЕНЕНИЕ УПАКОВКИ БИСЛОЯ ПРИ ТЕРМОИНДУЦИРОВАННОМ ФАЗОВОМ ПЕРЕХОДЕ (от А к
Б) и ПРИ ВСТРАИВАНИИ В БИСЛОЙ МОЛЕКУЛ ХОЛЕСТЕРИНА (от Б
к В)Указана толщина бислоя в ангстремах и площадь сечения, занимаемая каждой молекулой фосфолипида.