Слайд 1Комплексные соединения. Комплексообразующая способность
s, p, d элементов.
Слайд 2Соединения первого порядка (валентно-ненасыщенные)
Соединения высшего порядка (валентно-насыщенные)
Fe (CN)3
+
3KCN
K3[Fe(CN)6]
CoCl6
+
3NH3
[Co(NH3)6]Cl3
BF3
+
HF
Ni
+
4CO
H[BF4]
[Ni(CO)4]
Слайд 3Комплексные соединения – …
… молекулярные соединения, не показывающие в растворе
всех свойств исходных для них, соединений первого порядка, т.е. соединения
определённого состава, образованные в результате координации ионов или нейтральных молекул вокруг центрального атома или иона.
[MLn]Xm
M – центральный атом
L – лиганд
X – внешняя сферическая частица
MLn – комплексный ион
Слайд 4Теория А. Вернера (1893г.)
Основные положения:
Катионы могут проявлять не только основную
валентность, но и дополнительную. Основные валентности насыщаются только анионами, дополнительные
– и анионами, и нейтральными молекулами.
Каждый комплекс имеет центральный ион (комплексообразователь).
Каждый комплекс характеризуется координационным числом, которое показывает количество ионов или молекул, находящихся вокруг центрального атома.
Слайд 5Теория А. Вернера (1893г.)
Координированные ионы и молекулы называются лигандами, они
образуют внутреннюю сферу координационного соединения.
Ядро комплекса составляет центральный ион и
внутренняя сфера. Ядро может быть заряженным и нейтральным.
Если ядро заряжено, то комплекс имеет внешнюю сферу, т.к. ядро способно притягивать противоположно заряженный ион.
K3[Fe(CN)6] ↔ 3K+ + [Fe(CN)6]3–
ионная связь
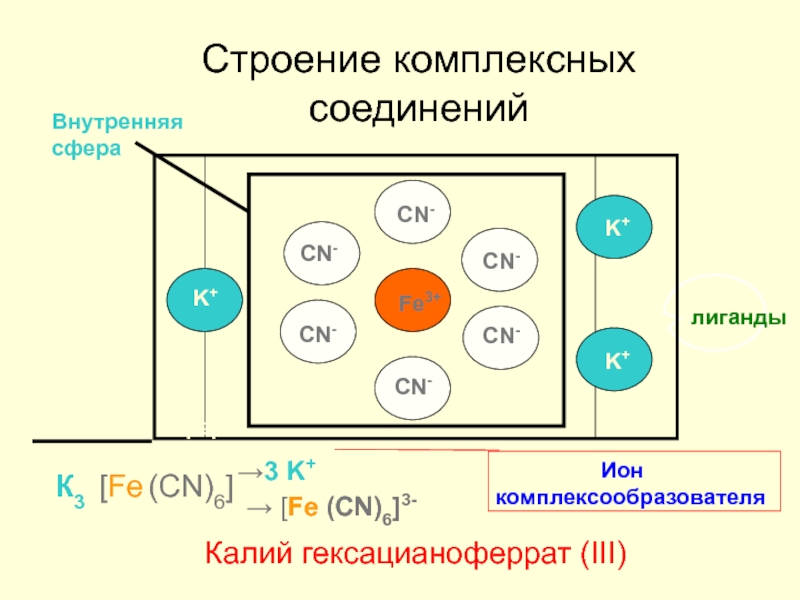
Слайд 6
Строение комплексных соединений
Калий гексацианоферрат (III)
Fe3+
CN-
CN-
CN-
CN-
CN-
CN-
K+
K+
K+
Ион комплексообразователя
лиганды
Внутренняя сфера
Внешняя сфера
[ (CN)6]
К3
[Fe
→3
K+
→ [Fe (CN)6]3-
Слайд 7Номенклатура комплексных соединений
Первым называют анион, вторым – катион.
В комплексном ионе
или молекуле первым указывают лиганды (сначала анион, затем – нейтральные,
в алфавитном порядке).
Комплексным катионам пристраивается окончание «о»; нейтральные лиганды называются, как соответствующие молекулы. Например, Н2О – аква, NH3 – амин.
Слайд 8Номенклатура комплексных соединений
Комплексообразователь (указывается его степень окисления римскими цифрами). В
комплексном катионе названия русские, в анионе – латинские с суффиксами
«ат».
Число лигандов каждого вида указывают приставками (ди-, три-, тетра- и т.д.).
[Cr(NH3)6]3+Cl3 – гексаамминхрома (III)
[CoF6]3–Na3 – гексафторокобальтат (III) натрия
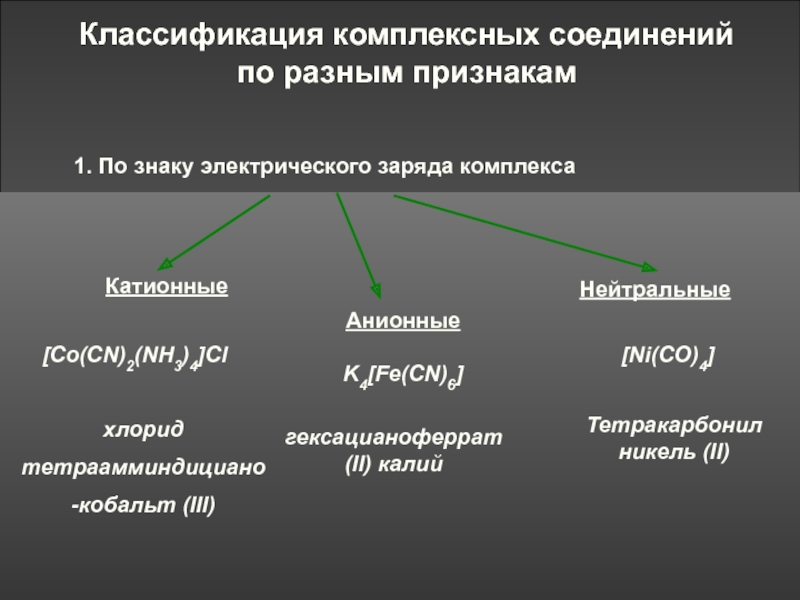
Слайд 9
Классификация комплексных соединений
по разным признакам
1. По знаку электрического заряда комплекса
2.
Принадлежности к определённому классу соединений
3. Природе лигандов
4. Внутренней структуре комплексного
соединения
(число ядер; наличие циклов).
[Co(CN)2(NH3)4]Cl
хлорид
тетраамминдициано
-кобальт (III)
Анионные
K4[Fe(CN)6]
гексацианоферрат (II) калий
Нейтральные
[Ni(CO)4]
Тетракарбонил никель (II)
Катионные
Слайд 10
2. По принадлежности к определённому классу соединений
комплексные
гидрооксид
диамминсеребра (I)
кислоты
основания
соли
H[AuCl4]
[Ag(NH3)2]OH
K2[HgI4]
водород
тетрахлороаурат (III)
тетраиодомеркурат (II)
калия
Классификация комплексных соединений
по разным признакам
Слайд 113. По природе лигандов
Аммиакаты
[Ni(NH3)6]Cl2
Аквакомплексы
[Co(H2O)6]SO4
Ацидокомплексы
K[Cu(CN)2]
Карбонилы [Fe(CO)5]
Гидроксокомплексы K3[Al(OH)6 ]
Цианидные
K4[Со(CN)6]
Карбонатные
[Fe(CO3)(NH3)]Cl
Разнолигандные
[CoI(NH3)5]Cl2
NH4[Cr(SCN)4(NH3)2]
Классификация комплексных
соединений
по разным признакам
Слайд 12
Классификация комплексных соединений
по разным признакам
4. По наличию или отсутствию циклов
Простые
Fe4[Fe(CN)6]3
Циклические
2+
Внутрикомплексные
соединения
диметилглиоксимат никеля (II)
Хелаты
Хлорид
[(бис-этилендиамин)медь (II)]
берлинская лазурь
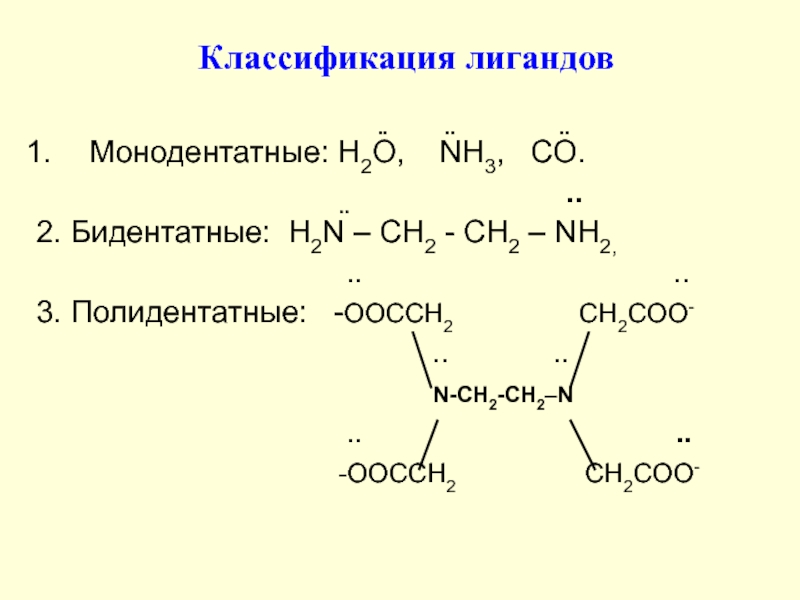
Слайд 13Классификация лигандов
.. .. ..
Монодентатные: Н2О, NH3, CO.
.. ..
2. Бидентатные: H2N – CH2 - CH2 – NH2,
.. ..
3. Полидентатные: -OOCCH2 CH2COO-
.. ..
N-CH2-CH2–N
.. ..
-OOCCH2 CH2COO-
Слайд 14Гибридизация – …
… смешение и выравнивание по форме и энергии
орбитали, принадлежащих разным уровням и подуровням.
Слайд 15Типы гибридизации орбиталей центрального иона
Атом Fe:
Fe0 1s22s22p63s23p6 4s23d6
Fe3+ 1s22s22p63s23p6
4s03d5
Ион Fe3+:
Слайд 16Внутрисферный комплекс [FeCN6]3–
С 1s22s22р2
Ион СN−:
CN 2s22p5
N 1s22s22p3
s
p
d
3
4
d2sp3
под действием силы
поля лигандов происходит спаривание электронов на d-подуровне.
Слайд 17
Ион F−:
F 1s22s22p5
[FeF6]3-
Внешнесферный комплекс [FeF6]3–
d2sp3
Слайд 18Спектрохимический ряд
СO > CN– > NH3 > NO2– > H2O
> OH− > F− > NО3−> SCN−
≈ Cl− > Br−
> I−
Сильные обладают способностью спаривать электроны центрального иона. Слабые – никогда.
Слайд 19
[Co(H2O)6]2+ розовый
[Co(CH3COO)2] ярко-розовый
[Co(NO2)6]4- оранжевый
[Co(NH3)6]2+
буро-розовый
Усиление поля лигандов
Влияние поля лигандов на окраску комплексов
Слайд 20K3[Fe(CN)6] 3K+ + [Fe(CN)6]3-
[Ag(NH3)2]Cl
[Ag(NH3)2]+ + Cl-
Диссоциация КС
по внешней сфере
(первичная диссоциация)
Слайд 21[Ag(NH3)2]+ [Ag(NH3)]+ + NH3
[Ag(NH3)2]+
Ag+ + 2 NH3
Диссоциация КС по внутренней
сфере
(вторичная диссоциация)
[
]
[
]
[
]
)2
(NH3
Ag
NH3
]
[Ag
KH
2
=
=
+
+
Слайд 22Реакции комплексных соединений
по внешней сфере
2K3[Fe(CN)6] + 3FeSO4 =
Fe3[Fe(CN)6]2↓ + 3K2SO4
[CoCl2(NH3)4]Cl + AgNO3 =
[CoCl2(NH3)4]NO3 + AgCl↓
K4[Fe(CN)6] + 4HCl = H4[Fe(CN)6] + 4KCl
H2[PtCl6] + 2CsOH = Cs2[PtCl6] + 2H2O
Fe4[Fe(CN)6]3 + 12 KOH =
4Fе(OH)3↓ + 3K4[Fe(CN)6]
Слайд 23Реакции комплексных соединений
с разрушением комплекса
1.Образование более прочного комплекса
Fe3+ +
6 SCN- = [Fe(SCN)6]3-
красная окраска
[Fe(SCN)6]3- + 6 F- = 6 SCN- + [FeF6]3-
отсутствие окраски
[FeF6]3- + Al3+ = Fe3+ + [AlF6]3-;
отсутствие окраски
Слайд 243. Разбавление
K[AgCl2] = KCl + AgCl↓
5. Окислительно-восстановительные реакции
2K3[Cr(ОH)6] + 3Сl2 +
4KOH =
2K2CrO4 + 6KCl + 8H2O
4. Нагревание
K3[Cr(ОH)6] = 3KOH + Cr(OH)3↓
2. Образование малорастворимого соединения
[Ag(NH3)2]NO3 + KI = AgI↓ + 2NH3 + KNO3
Слайд 25Комплексообразующая способность s, p, d элементов
Типичные комплексообразователи – d элементы.
Mn
– комплексы с белками, нуклеиновыми кислотами. Эти комплексы – составная
часть металлоферментов (аргиназа, холинэстераза)
Слайд 26Комплексообразующая способность s,p,d элементов
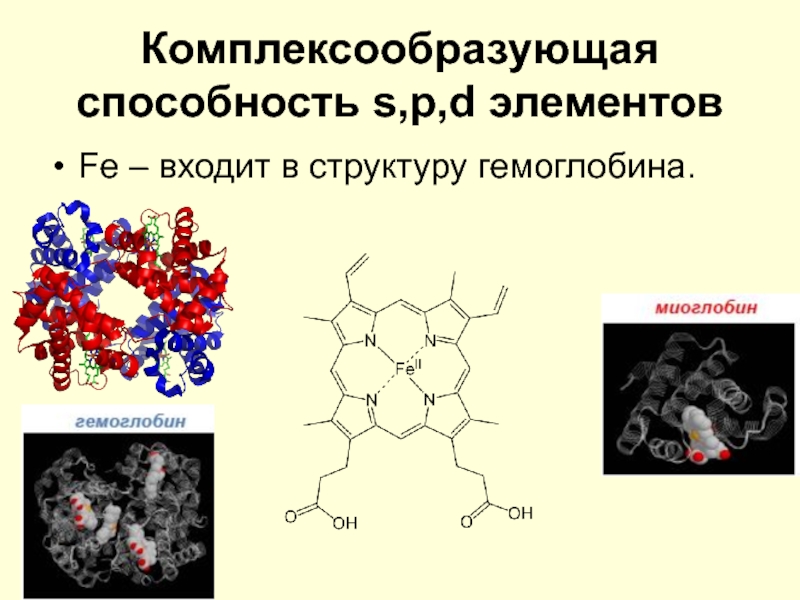
Fe – входит в структуру гемоглобина.
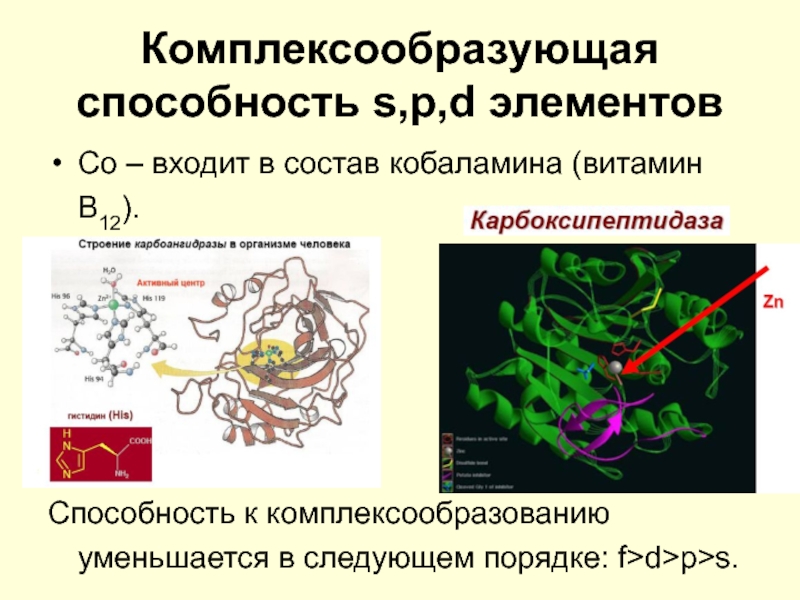
Слайд 28Комплексообразующая способность s,p,d элементов
Со – входит в состав кобаламина (витамин
В12).
Способность к комплексообразованию уменьшается в следующем порядке: f>d>p>s.
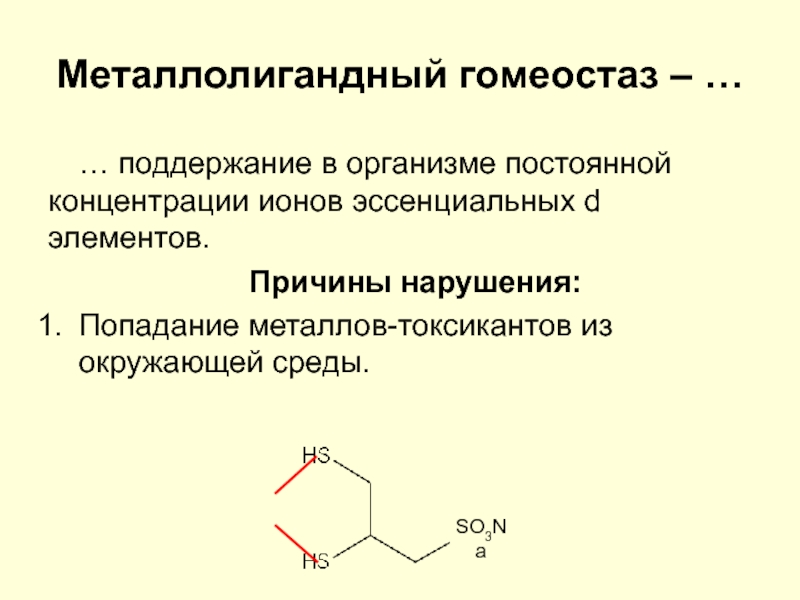
Слайд 29Металлолигандный гомеостаз – …
… поддержание в организме постоянной концентрации ионов
эссенциальных d элементов.
Причины нарушения:
Попадание металлов-токсикантов из окружающей среды.
Hg2+
SO3Na
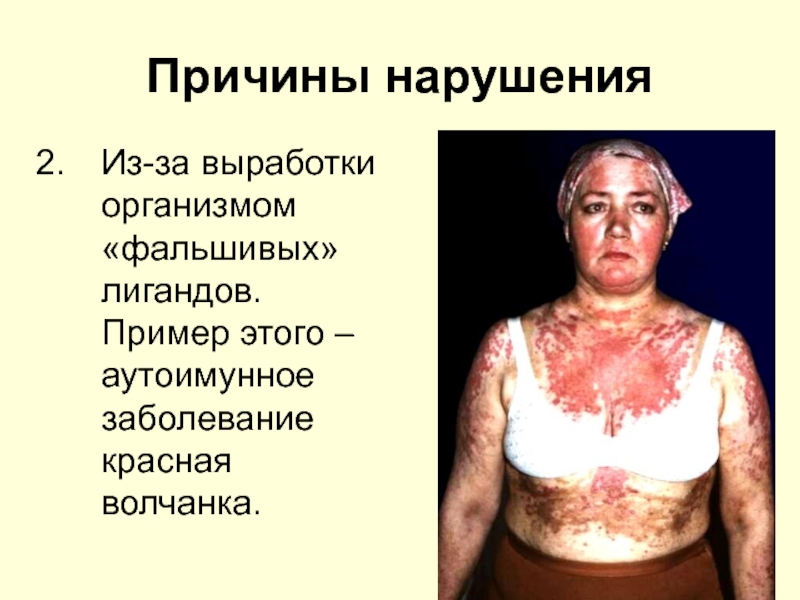
Слайд 30Причины нарушения
Из-за выработки организмом «фальшивых» лигандов. Пример этого – аутоимунное
заболевание красная волчанка.
Слайд 31Причины нарушения
В состав чая, кофе и соевого белка входят полифенольные
соединения, выполняющие роль лигандов и образующие прочный комплекс с ионами
железа, тормозя его всасывание ⇒ анемия.
Слайд 32Причины нарушения
Высокая или низкая концентрация микроэлементов в продуктах питания. «Болезнь
любителей пива».
Слайд 33Термодинамические принципы хелатотерапии
I − биоКО, необходимый организму;
Е − биоЛ, необходимый
организму;
Т − КО-токсикант из окружающей среды;
D − Л-детоксикант.
Основные принципы использования
лекарств для лечения больных:
1. связать токсикант: принцип выполняется, если Кн(ТD) < Кн(ТЕ);
2. не навредить организму: принцип выполняется, если Кн(ID) > Кн(IЕ)
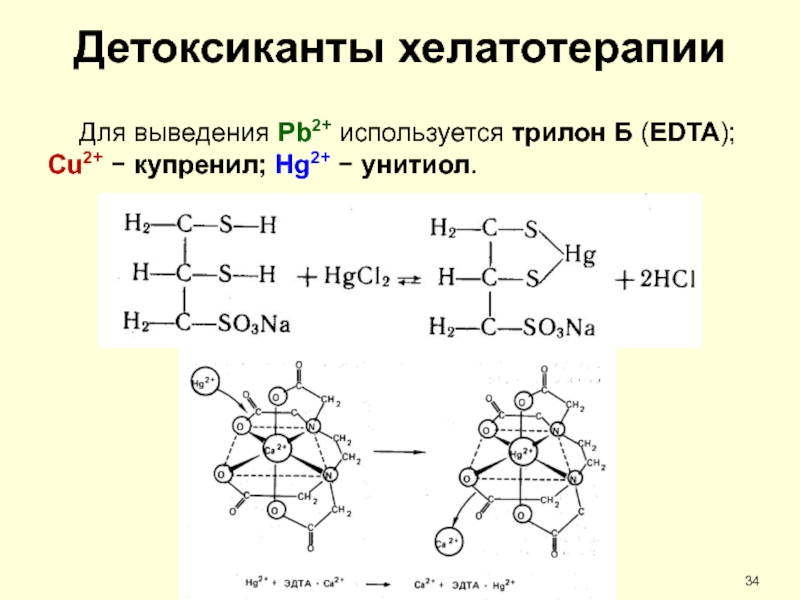
Слайд 34Детоксиканты хелатотерапии
Для выведения Pb2+ используется трилон Б (EDTA); Cu2+ −
купренил; Hg2+ − унитиол.
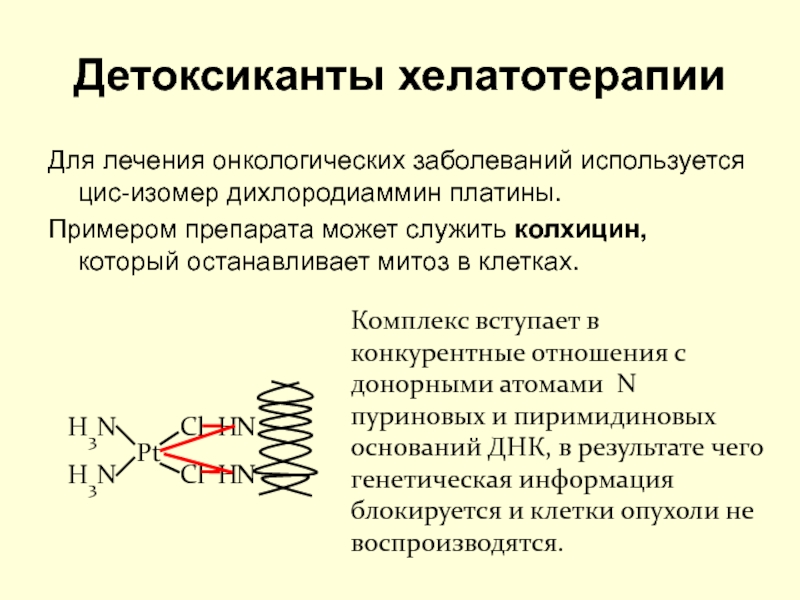
Слайд 35Детоксиканты хелатотерапии
Для лечения онкологических заболеваний используется цис-изомер дихлородиаммин платины.
Примером препарата
может служить колхицин, который останавливает митоз в клетках.
Комплекс вступает в
конкурентные отношения с донорными атомами N пуриновых и пиримидиновых оснований ДНК, в результате чего генетическая информация блокируется и клетки опухоли не воспроизводятся.
Н3N
Н3N
Pt
Cl
Cl
N
Н
N
Н

![Комплексные соединения Соединения первого порядка (валентно-ненасыщенные)Соединения высшего порядка (валентно-насыщенные)Fe (CN)3+3KCNK3[Fe(CN)6]CoCl6+3NH3[Co(NH3)6]Cl3BF3+HFNi+4COH[BF4][Ni(CO)4] Соединения первого порядка (валентно-ненасыщенные)Соединения высшего порядка (валентно-насыщенные)Fe (CN)3+3KCNK3[Fe(CN)6]CoCl6+3NH3[Co(NH3)6]Cl3BF3+HFNi+4COH[BF4][Ni(CO)4]](/img/thumbs/7a7c683cb9bf3b0b7f35d053d09464ff-800x.jpg)





![Комплексные соединения 2. По принадлежности к определённому классу соединенийкомплексныегидрооксиддиамминсеребра (I) кислотыоснования солиH[AuCl4][Ag(NH3)2]OHK2[HgI4] водород тетрахлороаурат 2. По принадлежности к определённому классу соединенийкомплексныегидрооксиддиамминсеребра (I) кислотыоснования солиH[AuCl4][Ag(NH3)2]OHK2[HgI4] водород тетрахлороаурат (III) тетраиодомеркурат (II) калия Классификация комплексных](/img/thumbs/60339a91e0494a9949316ce5815f16d6-800x.jpg)
![Комплексные соединения 3. По природе лигандовАммиакаты[Ni(NH3)6]Cl2 Аквакомплексы[Co(H2O)6]SO4 АцидокомплексыK[Cu(CN)2]Карбонилы [Fe(CO)5]Гидроксокомплексы K3[Al(OH)6 ]ЦианидныеK4[Со(CN)6]Карбонатные[Fe(CO3)(NH3)]ClРазнолигандные[CoI(NH3)5]Cl2NH4[Cr(SCN)4(NH3)2]Классификация комплексных соединений по разным признакам 3. По природе лигандовАммиакаты[Ni(NH3)6]Cl2 Аквакомплексы[Co(H2O)6]SO4 АцидокомплексыK[Cu(CN)2]Карбонилы [Fe(CO)5]Гидроксокомплексы K3[Al(OH)6 ]ЦианидныеK4[Со(CN)6]Карбонатные[Fe(CO3)(NH3)]ClРазнолигандные[CoI(NH3)5]Cl2NH4[Cr(SCN)4(NH3)2]Классификация комплексных соединений по разным признакам](/img/thumbs/412460506c566a4f4a1d6cb4706d4d04-800x.jpg)
![Комплексные соединения Классификация комплексных соединений по разным признакам4. По наличию или отсутствию цикловПростыеFe4[Fe(CN)6]3Циклические2+Внутрикомплексные Классификация комплексных соединений по разным признакам4. По наличию или отсутствию цикловПростыеFe4[Fe(CN)6]3Циклические2+Внутрикомплексные соединениядиметилглиоксимат никеля (II) ХелатыХлорид [(бис-этилендиамин)медь (II)]берлинская](/img/thumbs/ce46362cbad7a1884ae932c134d12e59-800x.jpg)


![Комплексные соединения Внутрисферный комплекс [FeCN6]3–С 1s22s22р2Ион СN−: CN 2s22p5N 1s22s22p3spd34d2sp3под действием силы поля Внутрисферный комплекс [FeCN6]3–С 1s22s22р2Ион СN−: CN 2s22p5N 1s22s22p3spd34d2sp3под действием силы поля лигандов происходит спаривание электронов на d-подуровне.](/img/thumbs/752cc401252c573b2cee5a9281ca1f66-800x.jpg)
![Комплексные соединения Ион F−: F 1s22s22p5[FeF6]3-Внешнесферный комплекс [FeF6]3–d2sp3 Ион F−: F 1s22s22p5[FeF6]3-Внешнесферный комплекс [FeF6]3–d2sp3](/img/thumbs/669479581d978bb2f3d46f0632c71254-800x.jpg)

![Комплексные соединения [Co(H2O)6]2+ розовый[Co(CH3COO)2] ярко-розовый [Co(NO2)6]4- оранжевый[Co(NH3)6]2+ [Co(H2O)6]2+ розовый[Co(CH3COO)2] ярко-розовый [Co(NO2)6]4- оранжевый[Co(NH3)6]2+](/img/thumbs/5bb18a3eb952397c889af6e11a544115-800x.jpg)
![Комплексные соединения K3[Fe(CN)6] 3K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl K3[Fe(CN)6] 3K+ + [Fe(CN)6]3-](/img/thumbs/958f594af4e63ed1f5da9d77078788d7-800x.jpg)
![Комплексные соединения [Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)2]+ Ag+ + 2 [Ag(NH3)2]+ [Ag(NH3)]+ + NH3[Ag(NH3)2]+ Ag+ + 2 NH3Диссоциация](/img/thumbs/8a59c176c306364154cfd139422f197c-800x.jpg)
![Комплексные соединения Реакции комплексных соединенийпо внешней сфере2K3[Fe(CN)6] + 3FeSO4 = Реакции комплексных соединенийпо внешней сфере2K3[Fe(CN)6] + 3FeSO4 =](/img/thumbs/202482bf2ed518f3f0494b4f2a47e927-800x.jpg)

![Комплексные соединения 3. Разбавление K[AgCl2] = KCl + AgCl↓ 5. Окислительно-восстановительные реакции 3. Разбавление K[AgCl2] = KCl + AgCl↓ 5. Окислительно-восстановительные реакции 2K3[Cr(ОH)6]](/img/thumbs/a3b80503a4c03048f585999e8efb0c96-800x.jpg)