Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энзимопатии
Содержание
- 1. Энзимопатии
- 2. Активная регуляция- регуляция на геномном уровне (
- 3. Гормональная регуляция активности ферментовОсуществляется при: -функционировании АЦ
- 4. Аденилатциклазный механизм
- 5. Некоторые клеточные ответы на действие гормонов, опосредуемое циклическим АМФ
- 6. ИФ3 обеспечивает повышение уровня кальция
- 7. Слайд 7
- 8. Сигнальные роли ДАГ Если ИФ3 повышает концентрацию
- 9. Роль ПКС в регуляции транскрипции
- 10. Известны два внутриклеточных пути, через которые активированная
- 11. Взаимосвязь цАМФ и ИФ3 зависимых путей
- 12. Аллостерическая регуляцияAllos- иной. Аллостерическая регуляция имеет два
- 13. Аллостерические ферментыЭто олигомеры с четным числом протомеровИмеют
- 14. Изоферменты
- 15. Это генетически детерминированные множественные формы ферментов.Тетрамерный фермент,
- 16. Метаболизм ферментовПревращение ферментов сходно с обменом других
- 17. Слайд 17
- 18. Имея высокую молекулярную массу, большая часть ферментов
- 19. Активность фермента. Активность - это изменение количества
- 20. В практике лабораторий широко пользуются понятием удельная
- 21. Пример для вычисления активности ферментаИсходные данные:25.0 x
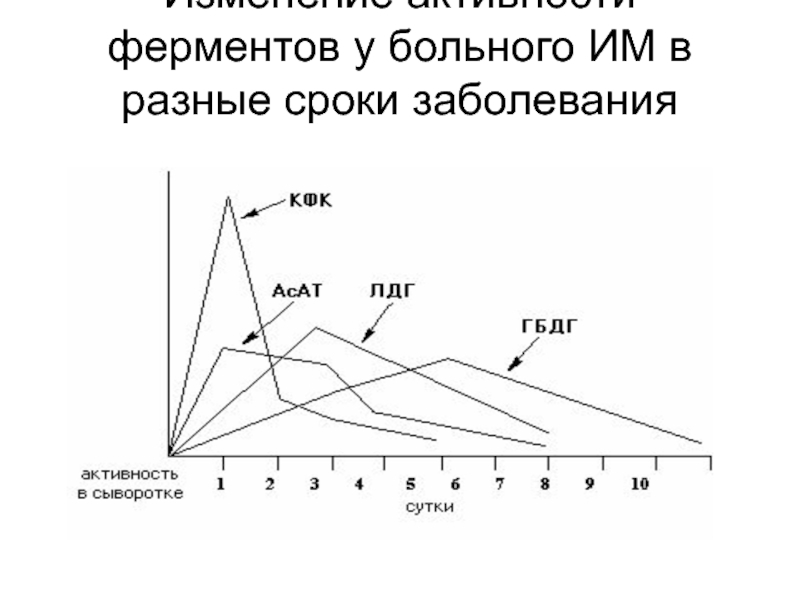
- 22. Изменение активности ферментов у больного ИМ в разные сроки заболевания
- 23. Номенклатура и классификация ферментов
- 24. ОксидоредуктазыОксидоредуктазы (1.0.0.0.)1.1.0.0. Действуют на СН-ОН группы доноров
- 25. ТрансферазыТрансферазы (2.0.0.0.)2.1.0.0.Переносят одноуглеродные группы
- 26. Гидролазы (3.0.0.0.)3.1.0.0.Действуют на эфирные связи
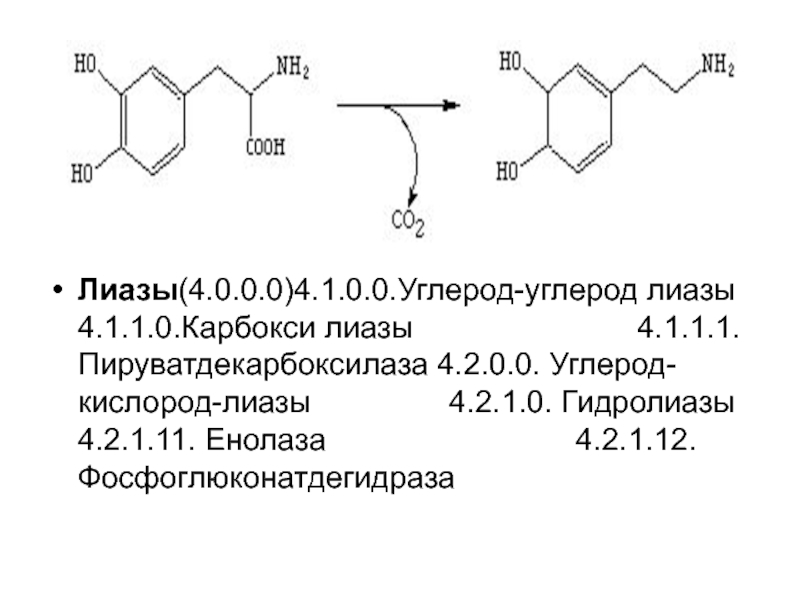
- 27. Лиазы(4.0.0.0)4.1.0.0.Углерод-углерод лиазы
- 28. Лигазы (6.0.0.0)6.1.0.0. Образуют С-О связи
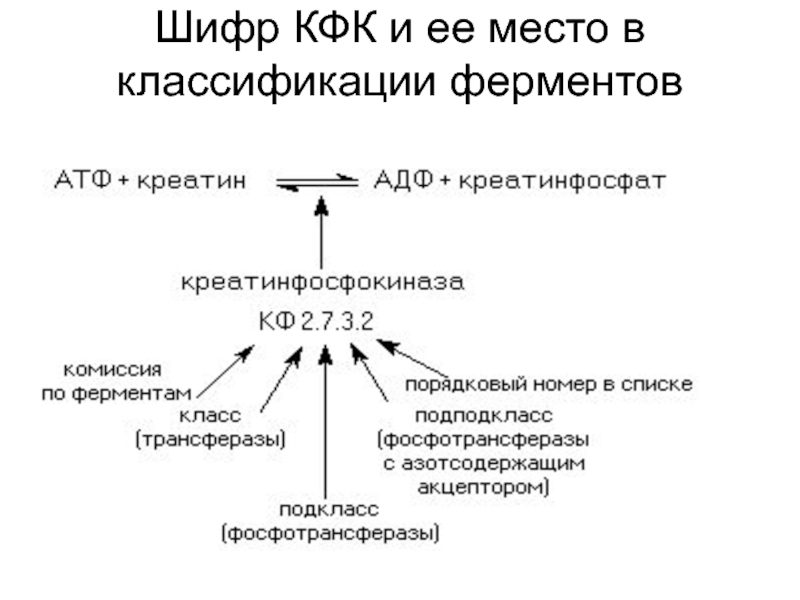
- 29. Каждый фермент получает специфический кодовый номер-шифр
- 30. Шифр КФК и ее место в классификации ферментов
- 31. Скачать презентанцию
Активная регуляция- регуляция на геномном уровне ( лактозный оперон);Регуляция конститутивными и индуцибельными ферментами. Синтез первых не зависит от индуктора, т.к. есть определенный уровень фермента, даже при отсутствии индуктора- это базовый уровень.Индуцибельные
Слайды и текст этой презентации
Слайд 1Механизмы регуляции активности ферментов
Изостерическая регуляция ( изос- равный), осуществляется количеством
субстрата и продукта
ионной силы раствора на активность ферментаСлайд 2Активная регуляция- регуляция на геномном уровне ( лактозный оперон);
Регуляция конститутивными
и индуцибельными ферментами. Синтез первых не зависит от индуктора, т.к.
есть определенный уровень фермента, даже при отсутствии индуктора- это базовый уровень.Индуцибельные ферменты это ферменты ЦСМ, цитохром Р-450, бета-ГОМГ-КоА-редуктаза.
Биосинтез аргиназы увеличивается при повышенном потреблении белков и ускорении ЦСМ.
Биосинтез липазы возрастает при голодании, обеспечивая мышцы, в том числе и миокард жирными кислотами.
Слайд 3Гормональная регуляция активности ферментов
Осуществляется при:
-функционировании АЦ комплекса,
- с помощью
вторичных посредников-
цАМФ, цГМФ, Са-Кальмодулина, ИТФ,
ДАГ, NO, олигоаденилатами.
Слайд 8Сигнальные роли ДАГ
Если ИФ3 повышает концентрацию ионов Са2+ в
цитозоле, другой продукт расщепления фосфатидилинозитол -4,5- дифосфата – ДАГ –
остается в плазматической мембране и вызывает совершенно иные молекулярные эффекты. У него есть две "сигнальные" роли: он может гидролизоваться дальше с образованием арахидоновой кислоты, необходимой для синтеза простагландинов и родственных им медиаторов липидной природы, или способен активировать специфическую протеинкиназу, которая затем фосфорилирует ряд белков с различными функциями в клетке-мишени.Фермент, активируемый ДАГ, называется протеинкиназой С (ПКС) или С–киназой, так как активность его зависит от уровня Са2+ в цитозоле клетки. Полипептидная цепь этого фермента содержит четыре консервативных домена и пять вариабельных областей. Консервативные области включают АТФ-, Са2+ - , диацилглицерол- и субстрат-связывающий домены. При низком внутриклеточном уровне Са2+ и отсутствии диацилглицерола протеинкиназа С находится в цитоплазме в неактивном состоянии. Связывание диацилглицерола изменяет конформацию протеинкиназы С, что сопровождается повышением ее сродства к ионам Са2+ и липидам. Это приводит к связыванию протеинкиназы С с цитоплазматической поверхностью плазматической мембраны и переводу фермента в активное состояние. Активация С-киназы кратковременна, так как через несколько секунд диацилглицерол фосфорилируется до фосфатидной кислоты или расщепляется с высвобождением арахидоновой кислоты.
С-киназа, активированная диацилглицеролом и Са2+, переносит концевую фосфатную группу с АТФ на специфические сериновые или треониновые остатки белков-мишеней, которые в разных клетках различны. Например, во многих животных клетках С-киназа фосфорилирует и тем самым активирует Na+/H+ обменный насос плазматической мембраны, контролирующий внутриклеточный рН. Концентрация С-киназы выше всего в нейронах головного мозга, где, помимо, прочего она фосфорилирует ионные каналы нейронов и, изменяя их проницаемость, может влиять на возбудимость этих клеток.
В некоторых клетках активация С - киназы усиливает транскрипцию определенных генов.
Слайд 10Известны два внутриклеточных пути, через которые активированная С-киназа усиливает транскрипцию
генов. В одном, С-киназа активирует протеинкиназный каскад, приводяций к фосфорилированию
митоген-активируемой протеинкиназы (МАП – киназы), которая фосфорилирует и активирует ген-регуляторный белок Elk-1. Elk-1 связан с короткой последовательностью ДНК (обозначаемой serum response element – SRE) и ассоциирован с другим ДНК - связывающим белком (обозначаемым serum response factor – SRF).В другом пути, активация С-киназы приводит к фосфорилированию ингибиторного белка Ik-B, что сопровождадется высвобождением из комплекса ген-регуляторного белка NF – kB, который мигрирует из цитозоля в ядро и активирует транскрипцию соответствующего гена.
Существует группа соединений, среди которых наиболее хорошо изучены форболовые эфиры, которые являются мощными активаторами ПкС. Они действуют подобно ДАГ как вторичные посредники, но в отличие от естественного ДАГ, они разрушаются медленно. Постоянно активируя ПкС, эти синтетические вещества вмешиваются в нормальную регуляцию клеточного роста и деления и служат факторами, стимулирующими образование опухолей..
Слайд 12Аллостерическая регуляция
Allos- иной. Аллостерическая регуляция имеет два определения.
Регуляция с помощью
другого вещества, не являющегося ни субстратом, ни продуктом данной реакции.
Или
регуляция путем связывания с другим центром, не являющимся активным( субстратным) центромСлайд 13Аллостерические ферменты
Это олигомеры с четным числом протомеров
Имеют ось симметрии
Обычно имеют
два центра связывания
Изменение конформации ограниченно переходами от R к T
Расположены
в «Ключевых» точках метаболизмаРегулируют интенсивность и переключают направление метаболического потока в целом
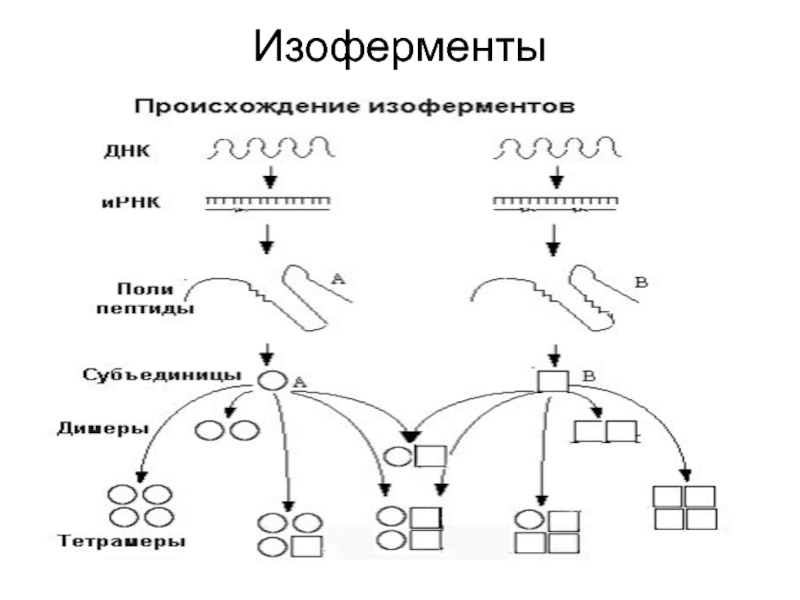
Слайд 15Это генетически детерминированные множественные формы ферментов.
Тетрамерный фермент, состоящий из двух
кодируемых генетически субъединиц А и В может быть представлен пятью
изоферментами А4, АЗВ1, А2В2, А1ВЗ и В4. Каждый из изоферментов может катализировать одинаковую реакцию, но отличается по своим свойствам, что важно при использовании этих ферментов в разных условиях. Таким путем Природа «экономит» генетический материал, создавая многообразие.Слайд 16Метаболизм ферментов
Превращение ферментов сходно с обменом других белков. Определенный уровень
ферментов в тканях поддерживается их постоянным синтезом и распадом. В
результате гибели клеток ферменты попадают в крвь, где при участии протеаз или в клетках РЭС подвергаются деградации.Слайд 18Имея высокую молекулярную массу, большая часть ферментов не экскретируется с
мочой. Ферменты экскретируются с желчью ( ЩФ, ГГТП, 5- нуклеотидаза,
аминотрансферазы).Слайд 19Активность фермента
. Активность - это изменение количества субстрата под влиянием
фермента в единицу времени. Под изменением субстрата понимают снижающееся в
единицу времени количество субстрата или же увеличивающееся количество продукта. Понятие "активность фермента" по сути дела идентична понятию "скорость ферментативной" реакции. Ферментативная активность выражается в единицах активности. В связи с существованием различных систем единиц исчисления введена интернациональная (стандартная) единица активности. Она носит символ "U" (unit-единица) и определяется как 1 мкмоль субстрата/мин. В системе СИ в качестве единицы ферментативной активности используют "катал" (kat). Катал определяется как 1 моль/сек.1kat = 1 моль/сек.
Размерность её слишком велика, на практике пользуются меньшими кратными значениями, начиная с нанокатала (нкат). Это одна миллиардная катала или 10-9 кат. В сравнении с международной единицей следующее уравнение
1 U = 16,67 нкат
Слайд 20В практике лабораторий широко пользуются понятием удельная активность. Для этого
число cтандартных единиц пересчитывают на какую-либо единицу сравнения. Это может
быть мг белка в пробе или объем исследуемой биологической жидкости. Определение активности ферментов широко распространено в любой современной клинической лаборатории.При исследовании кинетики реакций используется и такое понятие как молекулярная активность. Она показывает, сколько молекул субстрата в секунду превращаются в продукт 1 молекулой фермента и используется для сравнительной характеристики активности нескольких ферментов.
Пример вычисления активности фермента:
Слайд 21Пример для вычисления активности фермента
Исходные данные:25.0 x 10-3 моль л--1
пептида-субстрата,
объем реакционной смеси 2.5 мл,
0.50 µг химотрипсина[1]
Слайд 24Оксидоредуктазы
Оксидоредуктазы (1.0.0.0.)
1.1.0.0. Действуют на СН-ОН группы доноров
1.1.1.0. НАД+ или НАДФ+ в качестве акцепторов
1.1.1.1. Алкогольдегидрогеназа 1.14.0.0. Действуют на парные доноры при включении в один из них кислорода
1.14.15.0. Один из доноров восстановленный железо-серный белок и
включение одного атома кислорода
1.14.15.1. Цитохром Р-450
1.14.15.5. Кортикостерон 18-монооксигеназа