Слайд 1Локализация ферментов в клетке
Клеточные компартменты имеют различную локализацию ферментов.
Плазмалемма-Na/К
-АТФ-аза, транспортные белки-пермеазы
Цитоплазма-ферменты гликолиза, синтеза ЖК, ПФП
Митохондрии-ферменты ЦТК, бета-окисления ЖК,
ферменты начальных этапов ЦСМ
Лизосомы-гидролитические ферменты
Ядро-ферменты обмена НК
Гладкий ЭПР-ферменты обмена ксенобиотиков
ШероховатыйЭПР-ферменты биосинтеза белков
Слайд 2Органоспецифические ферменты
АЛТ-печень,
АСТ, КФК, ЛДГ-1,и ЛДГ-2 характерны для миокарда
КФК- мышечная
ткань
ЩФ-костная ткань и желчные протоки
Кислая фосфатаза- простата
Слайд 3Маркерные ферменты
Являются маркерами определенной органеллы.
СДГ-внутренняя мембрана МХ.
Na/К-АТФ-аза плазмалеммы
ГДГ- митохондриальный матрикс
МАО-
наружная сторона внутренней мембрана МХ
Слайд 4Единицы активности фермента
МЕ- количество фермента, который катализирует превращение 1мкМ
S
( или образование 1 мкМ продукта) за 1 мин.
Международная единица-катал.Это
количество фермента(F), который катализирует превращение 1 М S ( или образование 1 М продукта) за 1 сек.
Ввиду ее большой величины, существуют нано и микрокаталы.
Удельная активность-число единиц ферментативной активности на мг белка или число Кат/кг белка-фермента.
Слайд 5Число оборотов фермента или молярная активность- количество молекул субстрата, подвергающихся
превращению одной молекулой фермента в единицу времени. Диапазон молярной активности
для различных ферментов огромен ( за 1 мин).
Карбангидраза- 36 000 000
Фосфоглюкомутаза- 1 240
Слайд 6Медицинская энзимология
МЭ имеет основные направления- энзимопатология,энзимодиагностика, энзимотерапия, применение ферментов в лабораторной диагностике.
Энзимопатии- заболевания причиной которых является нарушение функций ферментов.
Любое заболевание можно рассматривать как нарушение сложной, согласованной и последовательной во времени и пространстве работой фермнтов.
Слайд 7Классификация по А.А. Покровскому.
1. Наследственные энзимопатии:
а. связанные с полным выпадением
синтеза фермента
б. связанные с конституциональной
слабостью отдельных
звеньев
метаболизма
2.Токсические энзимопатии:
а. связанные с избирательным подавлением
биосинтеза отдельных ферментов.
б. Связанные со неспецифическим подавлением
биосинтезом отдельных ферментов
Слайд 83. Пищевые( алиментарные ) энзимопатии, вызванные:
-. дефицитом витаминов
-. дефицитом белков
-.
дефицит микроэлементов
- несбалансированным питанием
Энзимопатии, вызванные нарушением нейрогуморальной регуляции
5.
Энзимопатии, связанные с нарушением внутриклеточной организации
6. Большая группа патологических процессов
Слайд 9Поздняя классификация
1. Первичные или наследственные Э, в
патогенезе которых
основную роль
играет отсутствие, недостаток или
аномальная структура
какого-либо
фермента. Это молекулярные
болезни, связанные с аномалией
фермента.
Слайд 10Вторичные энзимопатии-
Энзимопатии заболевания при которых, ферментативные нарушения развиваются вторично, в
ходе патологического процесса- это приобретенные Э.
Причинами Э являются: 1. А.
Отсутствие, недостаток или аномальная структура Фермента;
- Отсутствие, недостаток или аномальная структура аномальная структура Апофермента
Отсутствие, недостаток или патологическая структура соответствующих матриц ДНК и РНК
- нарушение энергообеспечения, биосинтеза
апофермента( днфицит АТФ, ГТФ и т.д.)
-регуляторное нарушение биосинтеза апоферментов(
усиленное образование репрессоров или снижение синтеза
индукторов).
-недостаток аминокислот- голодание, распад тканей
- тяжелые повреждения клеток ( интоксикация, травмы, инфекции).
Слайд 11Б.Отсутствие или недостаток
коферментов:
- недостаточное поступление
витаминов, микроэлементов, или
незаменимых ЖК;
нарушение всасывания витаминов в ЖКТ
нарушение процесса активации
витаминов в
тканях
другие причины гиповитаминозов
-клеточная деструкция различного
происхождения
-
Слайд 122. Усиленное расщепление или
выведение ферментов
3. Отсутствие активаторов ферментов
4.
Нарушение температурного и рН
оптимумов, оптимальной
концентрации
субстратов и др.
Патогенез энзимопатий связан с развитием метаболических блоков, вызванных недостаточной активностью фермента. В результате содержание S в тканях и биолог. жидкостях возрастает, а концентрация продукта снижается, лимиттируя дальнейшее превращение продукта этой реакции.
Слайд 13Механизм развития вторичных метаболических блоков, связан с увеличением концентрации субстрата
дефектного фермента, активацией минорных( альтернативных) путей метаболизма, приводящих к образованию
нефизиологических метаболитов, которые блокируют по конкурентному механизму, естественные метаболические пути
Слайд 14Степень выраженности энзимопатий
Бессимптомное течение-доброкачественная фруктозурия, пентозурия,почечная глюкозурия, некоторые аминоацидурии
Относительно бессимптомное
течение проявляется при действии провоцирующих факторов( при действии миорелаксантов-скрытый дефицит
холинэстеразы, гемолитические анемии при употреблении лекарств, пищевых продуктов).
Клинически выраженные- основная масса энзимопатий
Слайд 15Цель и задачи энзимодиагностики
1. Ранняя диагностика
2. Дифференциальная диагностика
3.Оценка динамики течения
заболевания
4.Определение эффективности лечения
5.Определение степени выздоровления
6.Определение прогноза заболевания
Объектами
энзимодиагностики являются- плазма( сыворотка) крови, моча, ликвор, слюна, биопсийный материал и т.д.
Слайд 16Ферменты как лекарственные препараты
Ферменты все больше завоевывают
признание как лекарственные препараты в лечении многих заболеваний. Их используют,
прежде всего, при нарушении синтеза ферментов в организме (заместительная терапия), для растворения сгустков крови при тромбозах, при лечении воспалительных процессов и т.д. Не меньшей популярностью пользуются и ингибиторы ферментов, например, при лечении панкреатитов используют ингибиторы протеолитических ферментов.
Большой интерес представляет использование в лечебной практике иммобилизованных ферментов (от лат immobilis- неподвижный). Фермент ковалентно "пришивают" к нерастворимому в воде носителю. Такие ферменты можно использовать в лабораторной практике как реагенты для анализа. При этом в отличие от растворимых форм такие ферменты можно многократно использовать. В промышленности такие ферменты вводятся в технологические процессы получения многих соединений. Такие формы ферментов удобны в лечении поражений кожи (марлевые повязки с иммобилизованными ферментами при лечении ожогов, кожных болезней).

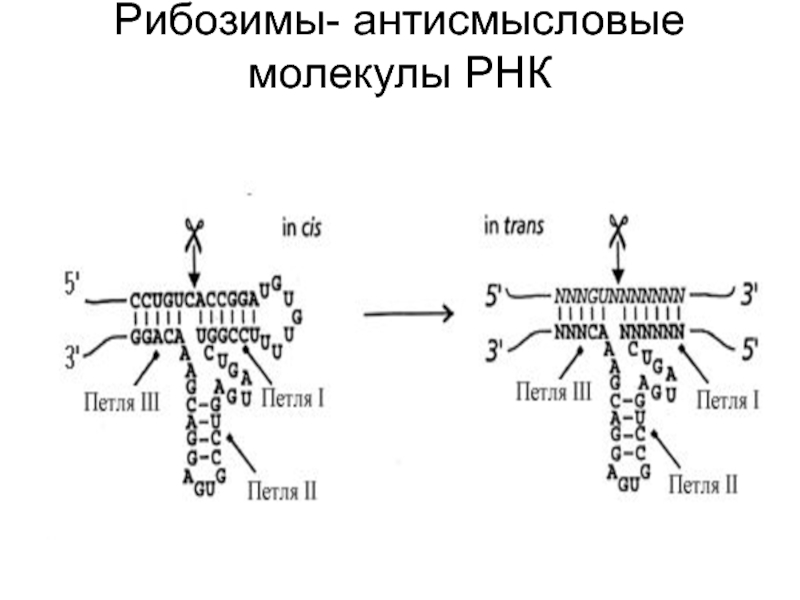
Слайд 17Рибозимы- антисмысловые молекулы РНК
Слайд 18Они функционируют, связываясь с РНК субстратом по принципу комплементарности и
катализируют расщепление фосфодиэфирной связи в специфическом участке субстрата.
Пять классов рибозимов были описаны на основании их уникальных характеристик последовательностей нуклеотидов и их пространственной структуры. Они могут катализировать саморасщепление (внутримолекулярный или "in cis"катализ) и распад внешних субстратов (межмолекулярный или "in trans" катализ).
Основное исследование проведено Томасом Сечом (Thomas Cech) в 1980-ых, который показал, что РНК может участвовать во внутримолекулярном катализе автономного сплайсинга, действуя как белковый фермент. Признание ферментативной функции некоторых молекул РНК расширило определение понятия биологического катализатора
Слайд 19В структуре рибозима обозначены три петли, образованные по принципу комплементарности
отдельных участков одной цепи и место разрыва связи. Автономный сплайсинг
происходит, если последовательность G-U-C попадает между петлями I и III, а G и U становится участком узнавания для катализа. Показанный на рисунке рибозим обладает только способностью к аутосплайсингу. Однако большинство рибозимов способны проводить in trans катализ РНК. У них можно выделить каталитический домен (петля II на рис.2-20 справа ) и распознающий участок, который представляет антисмысловую последовательность, способную специфически узнавать комплементарную последовательность на РНК субстрате и соединяться с этой последовательностью, образуя петли I и III. Рибозимы, обладающие таким механизмом действия, могут быть полезными в исследованиях в молекулярной биологии и технологии лекарственных форм
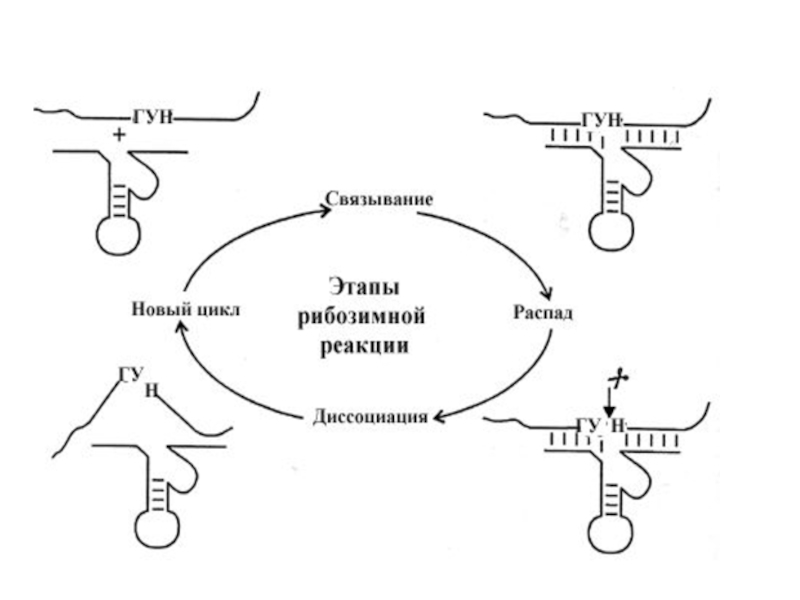
Слайд 21 По сравнению с обычными антисмысловыми РНК, рибозимы обладают способностью
многократно взаимодействовать с РНК субстратами, образуя циклический процесс расщепления РНК.
Другое важное отличительное свойство рибозимов - специфичность. Рибозим способен расщеплять уникальную последовательность нуклеотидов.( на рис 2-21 это последовательность Г-У-N где N – любой нуклеотид). Эти свойства рибозимов обеспечиваются распознающим участком (петли I и III). Важным в обеспечении функции рибозима является длина распознающего участка. Если это очень короткая последовательность, то скорость диссоциации субстрата от рибозима может превысить скорость расщепления связи, что может привести к низкой производительности рибозима. Однако, и стабильные гибриды проявляют низкую каталитическую активность из-за медленной диссоциации расщепленного субстрата. Таким образом, идеальной ситуацией может такая длина узнающей последовательности, которые обеспечивая расщепление тем не менее способствовала быстрой диссоциации расщепленных продуктов.
Слайд 22Молекулярная инженерия
Это раздел молекулярной биологии, занимающийся конструированием молекул с заранее
заданными структурными параметрами. В приложении к ферментам это означает получение
ферментов с измененной структурой с целью исследования механизма действия фермента или обладающих новыми качественными характеристиками
Слайд 23
Точечный направленный мутагенез - В этом случае целенаправлено
изменяется последовательность нуклеотидов в структуре гена, кодирующего данный фермент и
после экспрессии этого гена, проводится тщательное исследование кинетических характеристик полученного фермента. Заменяя аминокислоты в активном центре, можно получить информацию о механизме катализа.
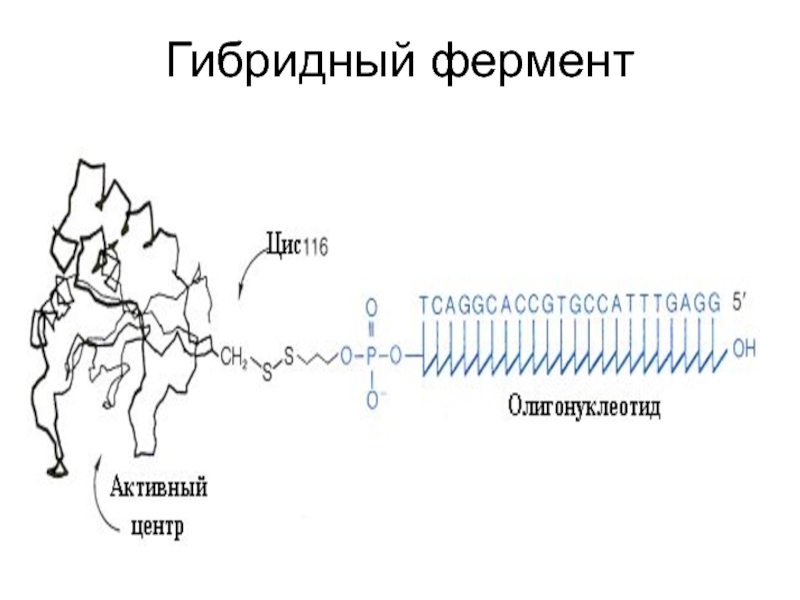
Слайд 25К нуклеазе, выделенной у стафилококка, присоединен олигонуклеотид со специфической последовательностью
нуклеотидов. Этот олигонуклеотид позволяет гибридному ферменту связаться с комплементарной последовательностью
нуклеиновой кислоты -мишени и подействовать специфично в строго определенном месте. Нативный фермент не обладает такой специфичностью.
Каталитические антитела. Эти молекулы являются антителами с очень специфическим центром связывания переходного состояния субстрата ферментативной реакции. Такие антитела получили название абзимы, В них сочетается высокая специфичность антител с возможностью ускорять химические реакции порой до 107 раз по сравнению с не катализируемой реакцией . Высокая стереоспецифичность ферментов (включая абзимы) может оказать огромную помощь в синтезе стереоспецифических соединений в органической химии.