Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
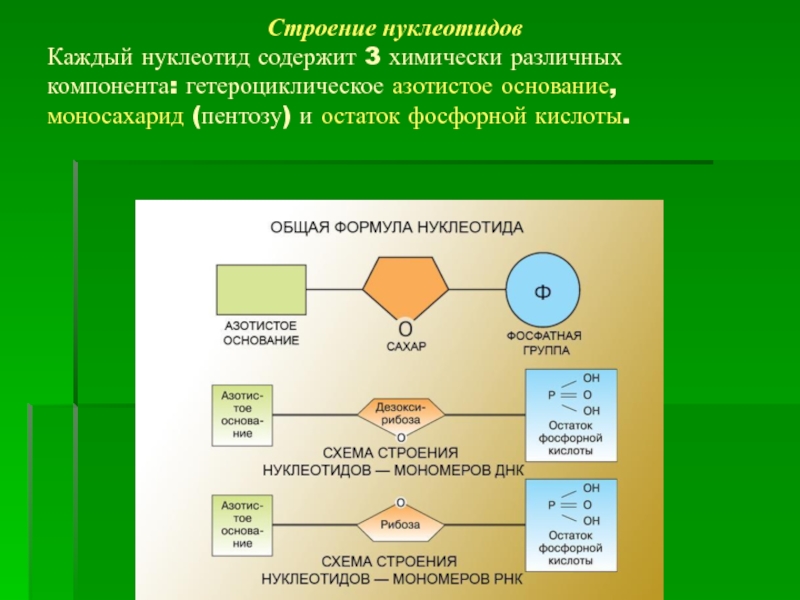
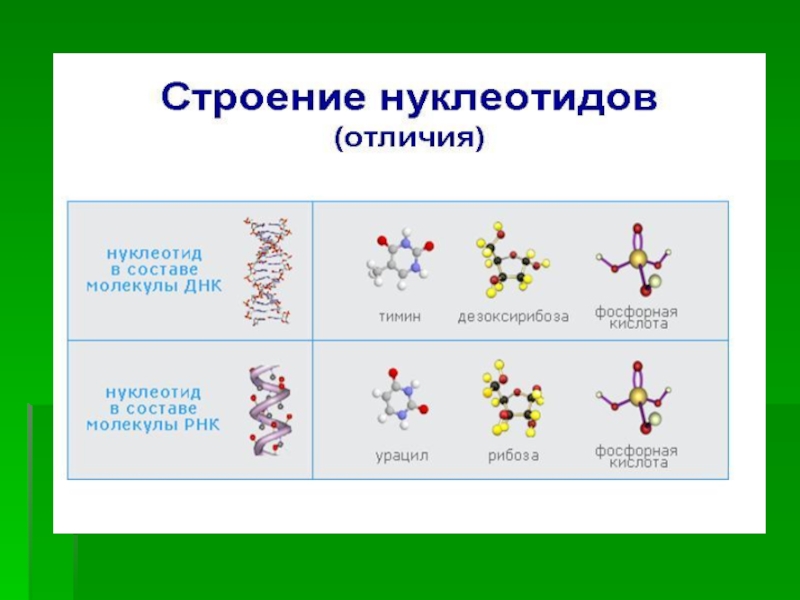
Обмен нуклеотидов
Содержание
- 1. Обмен нуклеотидов
- 2. Слайд 2
- 3. Слайд 3
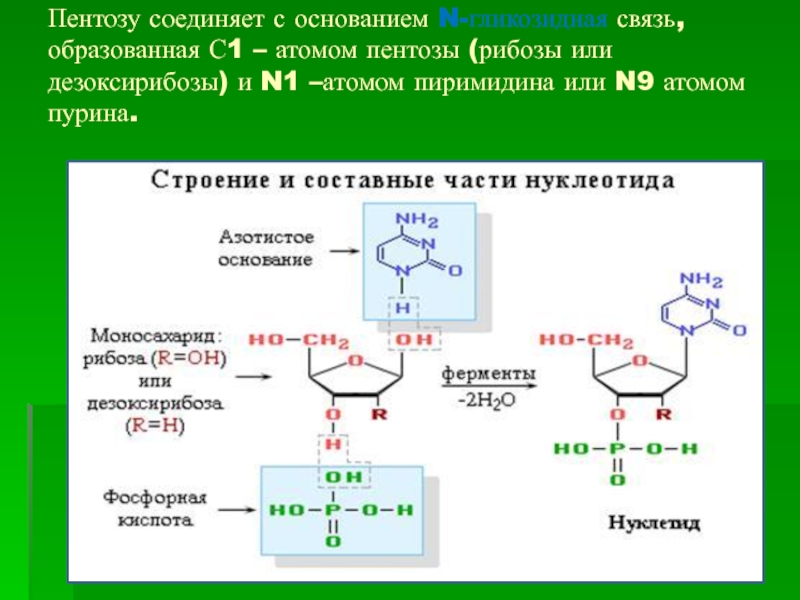
- 4. Пентозу соединяет с основанием N-гликозидная связь, образованная
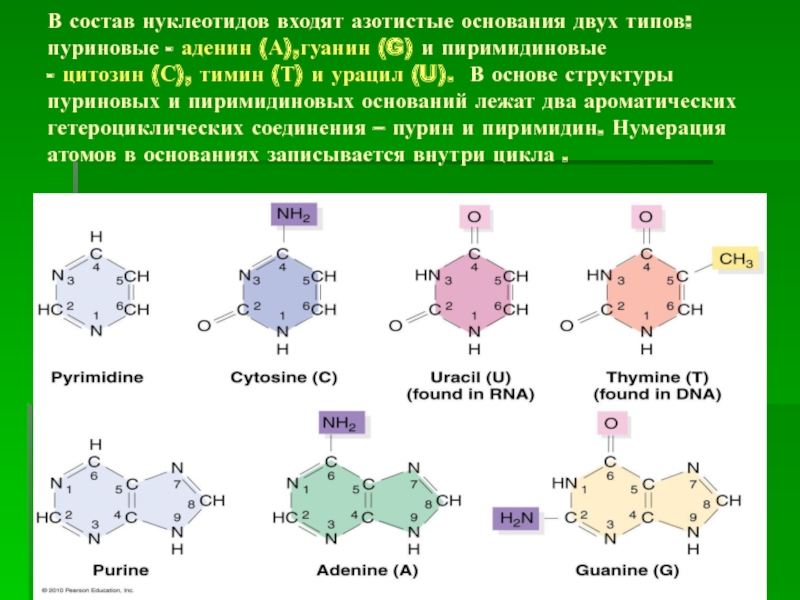
- 5. В состав нуклеотидов входят азотистые основания двух
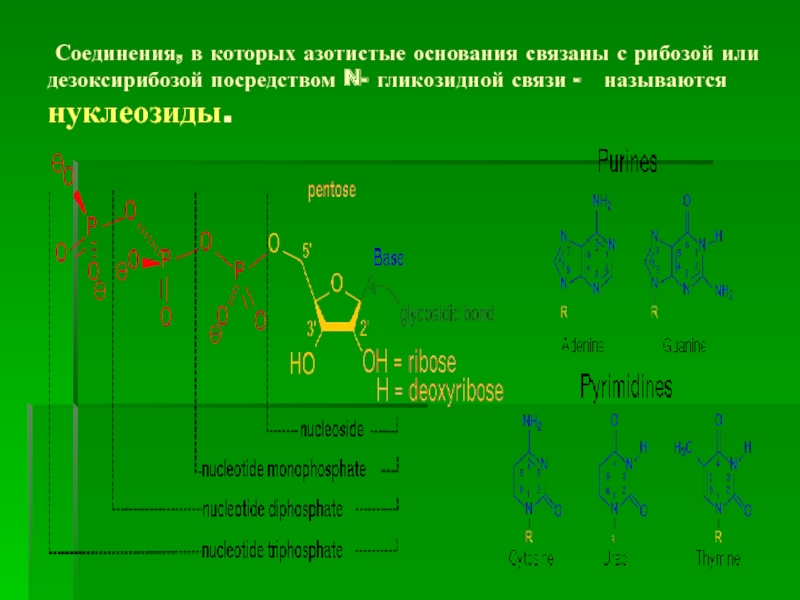
- 6. Соединения, в которых азотистые основания связаны
- 7. Слайд 7
- 8. В организме нуклеотиды и их производные выполняют
- 9. 3. Производные нуклеотидов участвуют в синтезе гомо-
- 10. 4. АМФ входит в состав коферментов дегидрогеназ
- 11. ПЕРЕВАРИВАНИЕ НУКЛЕИНОВЫХ КИСЛОТ ПИЩИ В ЖКТПищевые нуклеопротеины,
- 12. В расщеплении нуклеиновых кислот принимают участие ДНК-азы
- 13. Слайд 13
- 14. В энтероцитах обнаружена высокая активность ксантиноксидазы -
- 15. СИНТЕЗ ПУРИНОВЫХ НУКЛЕОТИДОВВ 40-50-х годах XX столетия
- 16. Центральное место в синтезе пуриновых и пиримидиновых
- 17. Источниками рибозо-5-фосфата могут быть: пентозофосфатный путь превращения
- 18. Биосинтез пуриновых нуклеотидов DE NOVOБиосинтез пуриновых нуклеотидов
- 19. Первая специфическая реакция образования пуриновых нуклеотидов -
- 20. Результатом этой 10 стадийной серии реакций является
- 21. Синтез АМФ и ГМФ из ИМФ АМФ
- 22. Второй пуриновый нуклеотид (ГМФ) образуется также в
- 23. При образовании пуриновых нуклеотидов ГТФ расходуется на
- 24. В образовании нуклеиновых кислот, коферментов и во
- 25. Аденилаткиназа активна в печени и мышцах. Функция
- 26. "Запасные" пути синтеза пуриновых нуклеотидов
- 27. Синтез АМФ и ГМФ из аденина и
- 28. Гипоксантин-гуанинфосфорибозилтрансфераза, катализирующая превращение азотистых оснований гипоксантина и
- 29. Нуклеозидкиназы Нуклеозиды, получающиеся при катаболизме нуклеиновых кислот
- 30. Из всех способов реутилизации пуринов наиболее активна
- 31. Регуляция синтеза пуриновых нуклеотидов осуществляется аллостерически. Регуляторными ферментами являются: ФРДФ-синтаза Амидофосфорибозилтрансфераза ИМФ-дегидрогеназа Аденилосукцинатсинтетаза
- 32. АМФ, ГМФ И ИМФ ингибируют ключевые реакции
- 33. КАТАБОЛИЗМ ПУРИНОВЫХ НУКЛЕОТИДОВ
- 34. У человека основной продукт катаболизма пуриновых нуклеотидов
- 35. От АМФ и аденозина аминогруппа удаляется гидролитически
- 36. Пуриннуклеозидфосфорилаза катализирует расщепление N-гликозидной связи в инозине
- 37. Ксантиноксидаза - аэробная оксидоредуктаза, кофакторы - ион
- 38. Слайд 38
- 39. НАРУШЕНИЯ ОБМЕНА ПУРИНОВЫХ НУКЛЕОТИДОВ
- 40. Когда в плазме крови концентрация мочевой кислоты
- 41. Поскольку лейкоциты фагоцитируют кристаллы уратов, то причиной
- 42. При подагре без образования подагрических узлов, в
- 43. В ряде случаев причиной избыточной экскреции пуринов
- 44. Синдром Лёша-Нихена - тяжёлая форма гиперурикемии, которая
- 45. Лечение
- 46. Аллопуринол ингибирует ксантиноксидазу и останавливает катаболизм пуринов
- 47. БИОСИНТЕЗ ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ
- 48. Образование пиримидиновых нуклеотидов DE NOVOПиримидиновое кольцо синтезируется
- 49. Образование дигидрооротата У млекопитающих ключевой, регуляторной реакцией
- 50. Карбамоилфосфат является продуктом полифункционального фермента, который наряду
- 51. Объединение первых трёх ферментов в единый полифункциональный
- 52. Образование УМФ В цитозоле оротат становится субстратом
- 53. Биосинтез УДФ, УТФ и цитидиловых нуклеотидов УМФ
- 54. ЦТФ синтетаза катализирует амидирование УТФ, осуществляя АТФ-зависимое
- 55. ). "Запасные" пути синтеза пиримидиновых нуклеотидовИспользование пиримидиновых
- 56. ). ). Превращение нуклеозидов в нуклеотиды катализирует
- 57. ). Регуляторным ферментом в синтезе пиримидиновых нуклеотидов
- 58. ). Активность регуляторных ферментов синтеза пиримидиновых нуклеотидов
- 59. ). ). КАД-фермент катализирует реакции 1, 2,
- 60. ). КАТАБОЛИЗМ ПИРИМИДИНОВЫХ НУКЛЕОТИДОВЦитидиловые нуклеотиды могут гидролитически
- 61. ). Оба гетероцикла могут взаимодействовать с водой
- 62. ). ). 1- дигидропиримидин-дегидрогеназа; 2 –дигидропиримидин-циклогидролаза; 3 - уреидопропионаза.
- 63. ). ). β-Аланин обнаруживают в плазме крови
- 64. ). НАРУШЕНИЯ ОБМЕНА ПИРИМИДИНОВЫХ НУКЛЕОТИДОВОротацидурия - вызвано
- 65. ). ). Это единственное нарушение, которое вызвано
- 66. ). Клинически наиболее характерное следствие оротацидурии -
- 67. ). Кроме генетически обусловленных причин, оротацидурия может
- 68. ). БИОСИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВСинтез дезоксирибонуклеотидов идёт с заметной
- 69. ). Биосинтез тимидиловых нуклеотидовТимидин-5'-монофосфат (дТМФ) образуется из
- 70. Спасибо за внимание!
- 71. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Пентозу соединяет с основанием N-гликозидная связь, образованная С1 – атомом
пентозы (рибозы или дезоксирибозы) и N1 –атомом пиримидина или N9
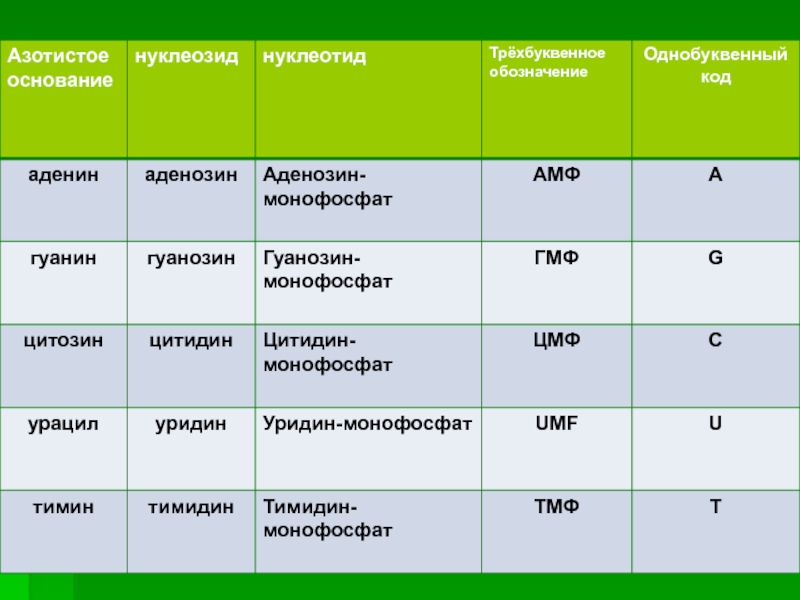
атомом пурина.Слайд 5В состав нуклеотидов входят азотистые основания двух типов: пуриновые - аденин (А),гуанин (G)
и пиримидиновые - цитозин (С), тимин (Т) и урацил (U). В основе структуры пуриновых и пиримидиновых
оснований лежат два ароматических гетероциклических соединения – пурин и пиримидин. Нумерация атомов в основаниях записывается внутри цикла .Слайд 6 Соединения, в которых азотистые основания связаны с рибозой или
дезоксирибозой посредством N- гликозидной связи - называются нуклеозиды.
Слайд 8В организме нуклеотиды и их производные выполняют многообразные функции.
1. Рибонуклеозид-
и дезоксирибонуклеозид-фосфаты являются субстратами в синтезе ДНК и РНК.
2.
Цикл АДФ-АТФ обеспечивает трансформацию энергии окисления в энергию биосинтетических процессов и других видов работы клетки. Слайд 93. Производные нуклеотидов участвуют в синтезе гомо- и гетерополисахаридов, липидов
и белков.
УДФ-глюкоза, УДФ-галактоза, ГДФ-манноза принимают участие в синтезе гликогена.
ЦДФ-холин - в синтезе фосфолипидов.
Производные нуклеотидов (УДФ-глюкуроновая кислота) используются в работе универсальной системы детоксикации, обеспечивающей выведение чужеродных веществ и конечных продуктов метаболизма из организма.
Слайд 104. АМФ входит в состав коферментов дегидрогеназ (NAD+, NADP+, FAD,
FMN) и кофермента (HS-КоА).
5. цАМФ и цГМФ - вторичные
посредники сигнала гормонов, факторов роста и нейромедиаторов.
Почти все клетки организма способны к синтезу нуклеотидов (исключение составляют некоторые клетки крови). Продукты расщепления нуклеиновых кислот тканей и пищи используются повторно лишь в незначительной степени.
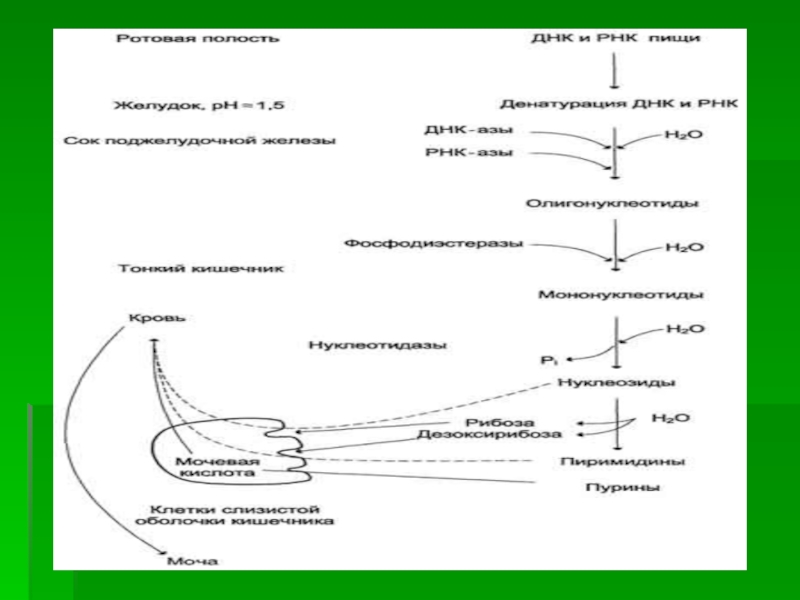
Слайд 11ПЕРЕВАРИВАНИЕ НУКЛЕИНОВЫХ КИСЛОТ ПИЩИ В ЖКТ
Пищевые нуклеопротеины, попадая в организм
человека, в желудке отщепляют белковый компонент и денатурируют под действием
НСl желудочного сока.Далее полинуклеотидная часть этих молекул гидролизуется в кишечнике до мононуклеотидов.
Слайд 12В расщеплении нуклеиновых кислот принимают участие ДНК-азы и РНК-азы панкреатического
сока, которые, будучи эндонуклеазами, гидролизуют макромолекулы до олигонуклеотидов.
Последние под
действием фосфодиэстераз панкреатической железы расщепляются до смеси 3'- и 5'-мононуклеотидов. Нуклеотидазы и неспецифические фосфатазы гидролитически отщепляют фосфатный остаток нуклеотидов и превращают их в нуклеозиды,
которые либо всасываются клетками тонкого кишечника, либо расщепляются нуклеозидфосфорилазами кишечника с образованием рибозо- или дезоксирибозо-1-фосфата, пуриновых и пиримидиновых оснований.
Слайд 14В энтероцитах обнаружена высокая активность ксантиноксидазы - фермента, который большую
часть пуринов, поступающих в клетки, превращает в мочевую кислоту, удаляющуюся
с мочой.Пиримидиновые основания, не успевшие поступить в энтероциты, под действием микрофлоры кишечника расщепляются до NH3, CO2, β-аланина и β-аминоизобутирата.
Слайд 15СИНТЕЗ ПУРИНОВЫХ НУКЛЕОТИДОВ
В 40-50-х годах XX столетия опытами с мечеными
изотопами удалось выяснить происхождение атомов пуринового ядра при синтезе пуринов
de novo.Было установлено, что в формировании кольца принимают участие аминокислоты Асп, Гли, Глн, СО2 и два одноуглеродных производных: метенил-Н4-фолат и формил-Н4-фолат.
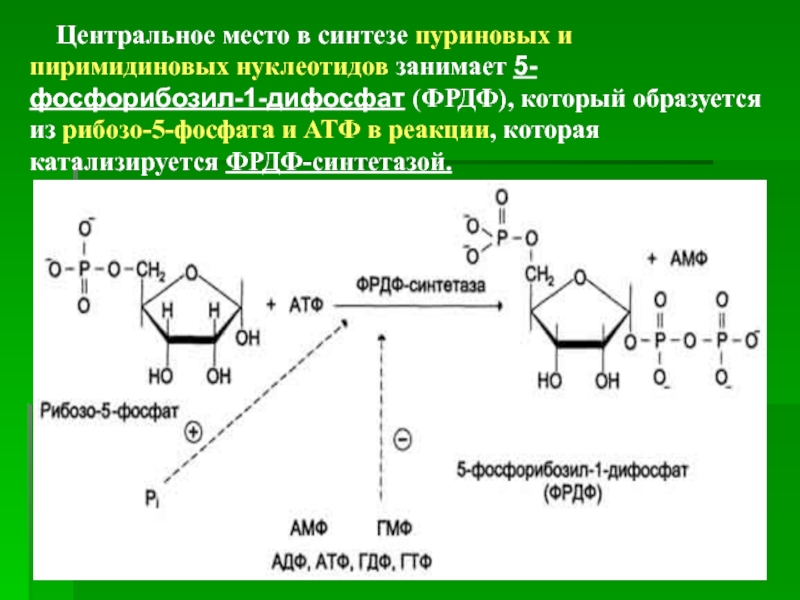
Слайд 16Центральное место в синтезе пуриновых и пиримидиновых нуклеотидов занимает 5-фосфорибозил-1-дифосфат
(ФРДФ), который образуется из рибозо-5-фосфата и АТФ в реакции, которая
катализируется ФРДФ-синтетазой.Слайд 17Источниками рибозо-5-фосфата могут быть: пентозофосфатный путь превращения глюкозы и катаболизм
нуклеозидов, в ходе которого под действием нуклеозидфосфорилазы первоначально образуется рибозо-1-фосфат,
а затем с помощью соответствующей мутазы фосфатный остаток переносится в 5-положение.ФРДФ участвует не только в синтезе пуриновых и пиримидиновых нуклеотидов из простых предшественников, но используется на образование пуриновых нуклеотидов по "запасному" пути.
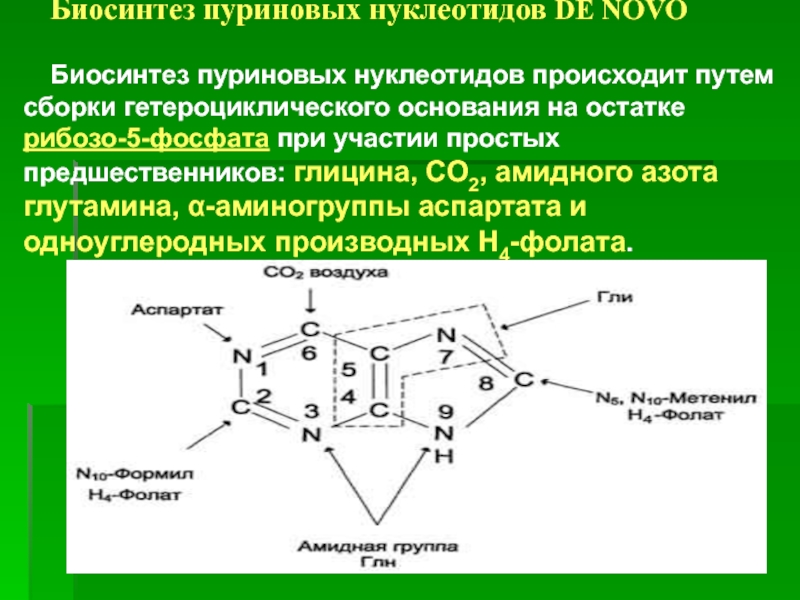
Слайд 18Биосинтез пуриновых нуклеотидов DE NOVO
Биосинтез пуриновых нуклеотидов происходит путем сборки
гетероциклического основания на остатке рибозо-5-фосфата при участии простых предшественников: глицина,
СО2, амидного азота глутамина, α-аминогруппы аспартата и одноуглеродных производных Н4-фолата.Слайд 19Первая специфическая реакция образования пуриновых нуклеотидов - перенос амидной группы
Глн на ФРДФ с образованием 5-фосфорибозил-1 -амина.
Эту реакцию катализирует
фермент амидофосфорибозилтрансфераза. При этом формируется β-N-гликозидная связь. Затем к аминогруппе 5-фосфорибозил-1-амина присоединяются остаток глицина, метенил-Н4-фолат, ещё одна амидная группа глутамина, СО2, аминогруппа аспартата и формил - Н4-фолат.
Слайд 20Результатом этой 10 стадийной серии реакций является образование первого пуринового
нуклеотида - инозин-5'-монофосфата (ИМФ), на синтез которого затрачивается не менее
шести молекул АТФ.Все реакции протекают в цитозоле клетки.
Остальные пуриновые нуклеотиды – АМФ и ГМФ образуются из ИМФ.
Слайд 21Синтез АМФ и ГМФ из ИМФ
АМФ синтезируется при участии
аденилосукцинат-синтетазы и аденилосукциназы, ГМФ - при участии ИМФ-дегидрогеназы и ГМФ-синтетазы.
Аденилосукцинатсинтетаза, используя энергию ГТФ, присоединяет аспартат к ИМФ с образованием аденилосукцината, который в реакции, катализируемой аденилосукциназой, отщепляет фумарат и превращается в АМФ.
Слайд 22Второй пуриновый нуклеотид (ГМФ) образуется также в 2 стадии.
Сначала
ИМФ окисляется NAD+-зависимой ИМФ-дегидрогеназой с образованием ксантозин-5'-монофосфата (КМФ).
Последующее трансамидирование
гидроксильной группы при С2-пуринового кольца КМФ катализирует ГМФ-синтетаза с использованием амидной группы глутамина и энергии АТФ. Слайд 23При образовании пуриновых нуклеотидов ГТФ расходуется на синтез АМФ, а
АТФ - на синтез ГМФ.
!!! Перекрёстное использование пуриновых нуклеозидтрифосфатов
на образование конечных продуктов синтеза помогает поддерживать в клетках баланс адениловых и гуаниловых нуклеотидов. Печень - основное место образования пуриновых нуклеотидов, откуда они могут поступать в ткани, не способные к их синтезу: эритроциты и мозг.
Слайд 24В образовании нуклеиновых кислот, коферментов и во многих синтетических процессах
нуклеотиды используются в виде ди - и трифосфатов, синтез которых
катализируют трансферазы.АМФ и ГМФ превращаются в нуклеозиддифосфаты (НДФ) с помощью специфичных к азотистому основанию нуклеозидмонофосфаткиназ (НМФ-киназ) и АТФ.
Аденилаткиназа катализирует реакцию:
АМФ + АТФ → 2 АДФ
Гуанилаткиназа:
ГМФ + АТФ → ГДФ + АДФ
Слайд 25Аденилаткиназа активна в печени и мышцах. Функция этого фермента заключается
в том, чтобы поддерживать в тканях равновесие фонда адениловых нуклеотидов:
АМФ, АДФ и АТФ.Взаимопревращения нуклеозиддифосфатов и нуклеозидтрифосфатов осуществляет нуклеозиддифосфаткиназа. Этот фермент обладает широкой субстратной специфичностью и может катализировать реакцию:
ГДФ + АТФ → ГТФ + АДФ
Превращение АДФ в АТФ происходит, в основном, за счёт окислительного фосфорилирования или в реакциях субстратного фосфорилирования гликолиза или цитратного цикла.
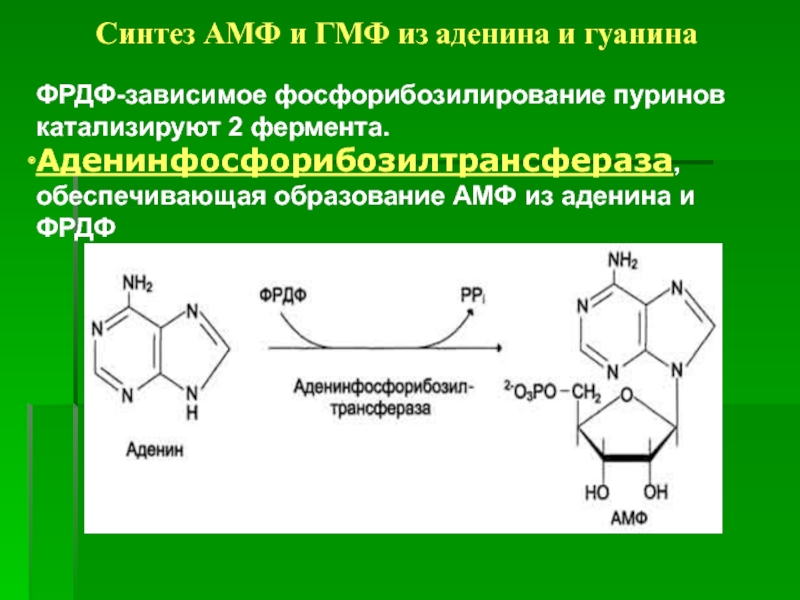
Слайд 27Синтез АМФ и ГМФ из аденина и гуанина
ФРДФ-зависимое фосфорибозилирование
пуринов катализируют 2 фермента.
Аденинфосфорибозилтрансфераза, обеспечивающая образование АМФ из аденина
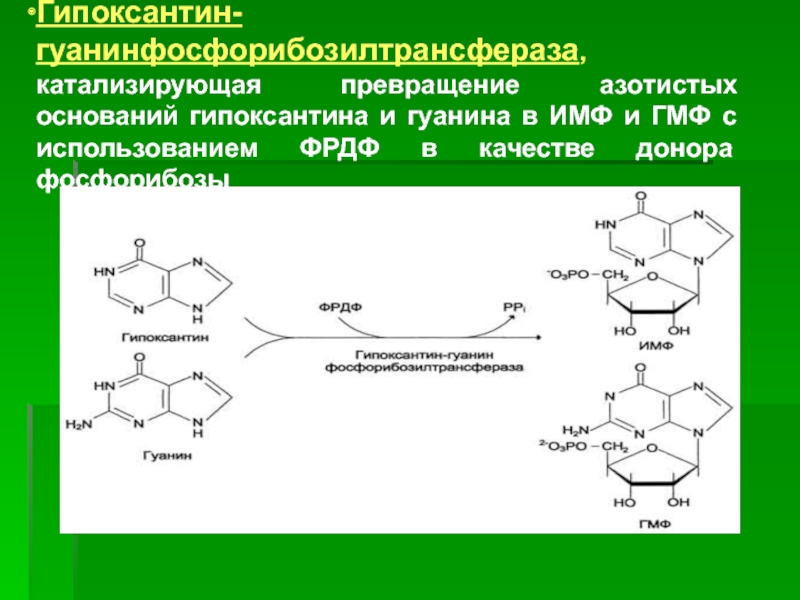
и ФРДФ Слайд 28Гипоксантин-гуанинфосфорибозилтрансфераза, катализирующая превращение азотистых оснований гипоксантина и гуанина в ИМФ
и ГМФ с использованием ФРДФ в качестве донора фосфорибозы
Слайд 29Нуклеозидкиназы
Нуклеозиды, получающиеся при катаболизме нуклеиновых кислот из нуклеотидов под
действием нуклеотидаз, могут повторно фосфорилироваться, образуя нуклеозид-5'-монофосфаты за счёт переноса
фосфатного остатка АТФ на соответствующий субстрат.Основным ферментом этой группы является аденозинкиназа, которая ускоряет реакцию:
Аденозин + АТФ → АМФ + АДФ
Слайд 30Из всех способов реутилизации пуринов наиболее активна гипоксантингуанинфосфорибозилтрансферазная реакция, поскольку
ИМФ, образующийся в этой реакции, вовлекается в синтез АМФ и
ГМФ.Использование гипоксантина и гуанина по запасному пути становится жизненно важным событием в клетках, не способных к синтезу пуриновых нуклеотидов de novo.
По сравнению с аденозином количество аденина в клетках мало, а первый возвращается в фонд нуклеотидов с помощью аденозинкиназы.
Слайд 31Регуляция синтеза пуриновых нуклеотидов осуществляется аллостерически.
Регуляторными ферментами являются:
ФРДФ-синтаза
Амидофосфорибозилтрансфераза
ИМФ-дегидрогеназа
Аденилосукцинатсинтетаза
Слайд 32АМФ, ГМФ И ИМФ ингибируют ключевые реакции своего синтеза. ФРДФ
синтетаза и амидофосфорибозил-трансфераза – ингибируются при повышении АМФ и ГМФ.
Активность регуляторных ферментов на разветвлении метаболического пути, аденилосукцинатсинтетазы и ИМФ- дегидрогеназы – снижается при увеличении количества конечного продукта, образующегося в каждой из ветвей.
АМФ ингибирует превращение ИМФ в аденилосукцинат, а ГМФ – превращение ИМФ в КМФ, обеспечивая, таким образом, сбалансированное содержание адениловых и гуаниловых нуклеотидов.
Слайд 34У человека основной продукт катаболизма пуриновых нуклеотидов - мочевая кислота.
Её образование идёт путём гидролитического отщепления фосфатного остатка от нуклеотидов
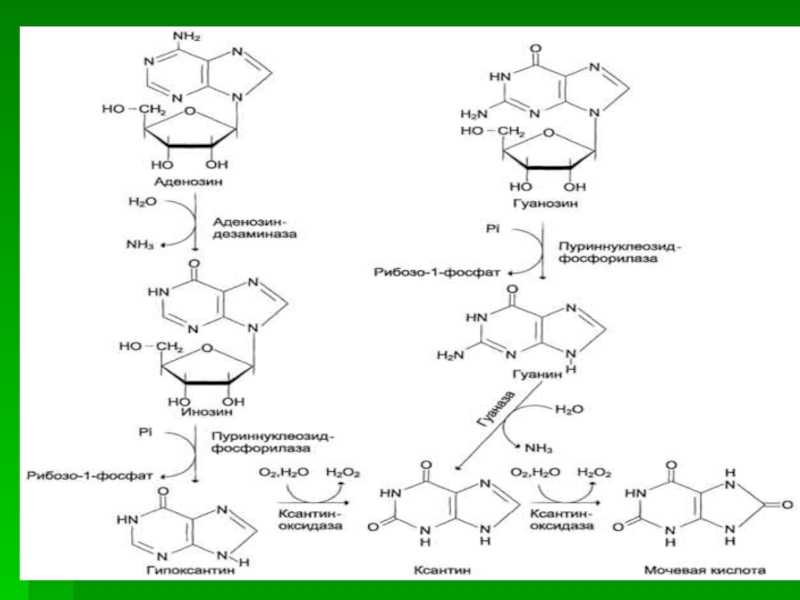
с помощью нуклеотидаз или фосфатаз.Слайд 35От АМФ и аденозина аминогруппа удаляется гидролитически аденозиндезаминазой с образованием
ИМФ или инозина.
ИМФ и ГМФ превращаются в соответствующие нуклеозиды:
инозин и гуанозин под действием 5´-нуклеотидазы. Слайд 36Пуриннуклеозидфосфорилаза катализирует расщепление N-гликозидной связи в инозине и гуанозине с
образованием рибозо-1-фосфата и азотистых оснований: гуанина и гипоксантина.
Гуанин дезаминируется
и превращается в ксантин, а гипоксантин окисляется в ксантин с помощью ксантиноксидазы, которая катализирует и дальнейшее окисление ксантина в мочевую кислоту. Слайд 37Ксантиноксидаза - аэробная оксидоредуктаза, кофакторы - ион молибдена, железа (Fe3+
) и FAD.
Фермент обнаруживается в печени и кишечнике.
Мочевая
кислота удаляется из организма главным образом с мочой. У всех млекопитающих, кроме приматов и человека, имеется фермент уриказа, расщепляющий мочевую кислоту с образованием аллантоина, хорошо растворимого в воде. Мочевая кислота - слабая кислота. Содержание недиссоциированной формы и солей (уратов) зависит от рН раствора.
В сыворотке крови в норме содержание мочевой кислоты составляет 0,15-0,47 ммоль/л.
Ежесуточно из организма выводится от 0,4 до 0,6 г мочевой кислоты и уратов.
Слайд 40Когда в плазме крови концентрация мочевой кислоты превышает норму, то
возникает гиперурикемия.
Вследствие гиперурикемии может развиться подагра - заболевание, при
котором кристаллы мочевой кислоты или ураты откладываются в суставных хрящах, связках и мягких тканях с образованием подагрических узлов, вызывая воспаления суставов и нефропатию (образование уратных камней в мочевыводящих путях). Слайд 41Поскольку лейкоциты фагоцитируют кристаллы уратов, то причиной воспаления является разрушение
лизосомальных мембран лейкоцитов кристаллами мочевой кислоты.
Освободившиеся лизосомальные ферменты выходят
в цитозоль и разрушают клетки, а продукты клеточного катаболизма вызывают воспаление. Слайд 42При подагре без образования подагрических узлов, в которых накапливаются ураты
натрия и мочевая кислота, количество уратов возрастает до 2-4 г
(у пациентов с тяжёлой формой болезни до 30 г).Подагра - распространённое заболевание, в разных странах ею страдают от 0,3 до 1,7% населения. А поскольку сывороточный фонд уратов у мужчин в 2 раза больше, чем у женщин, то они и болеют в 20 раз чаще, чем женщины.
Как правило, подагра генетически детерминирована и носит семейный характер.
Слайд 43В ряде случаев причиной избыточной экскреции пуринов с мочой и
подагры являются нарушения в работе ферментов.
Обнаружены гипоксантин-гуанинфосфорибозил-трансферазы, катализируюшие реакцию
превращения гуанина и гипоксантина в соответствующие нуклеотиды со сниженной ферментативной активностью. Это:
уменьшает повторное использование пуриновых оснований, и они превращаются в мочевую кислоту;
увеличивает синтез пуриновых нуклеотидов de novo из-за слабого использования ФРДФ в реакциях реутилизации и увеличения его концентрации в клетке.
Адениловые и гуаниловые нуклеотиды образуются в количествах, превышающих потребности клеток, а это способствует усилению их катаболизма.
Слайд 44Синдром Лёша-Нихена - тяжёлая форма гиперурикемии, которая наследуется как рецессивный
признак, сцепленный с Х-хромосомой, и проявляется только у мальчиков.
Болезнь
вызвана полным отсутствием активности гипоксантингуанинфоефорибозилтрансферазы и сопровождается гиперурикемией с содержанием мочевой кислоты от 9 до 12 мг/сут, что превышает растворимость уратов при нормальном рН плазмы. Экскреция мочевой кислоты у больных с синдромом Лёша-Нихена превышает 600 мг/сут и требует для выведения этого количества продукта не менее 2700 мл мочи. У детей с данной патологией в раннем возрасте появляются тофусы, уратные камни в мочевыводящих путях и серьёзные неврологические отклонения, сопровождающиеся нарушением речи, церебральными параличами, снижением интеллекта, склонностью к нанесению себе увечий (укусы губ, языка, пальцев).
Слайд 45 Лечение гиперурикемии
Основным препаратом, используемым
для лечения гиперурикемии, является аллопуринол - структурный аналог гипоксантина.
Слайд 46Аллопуринол ингибирует ксантиноксидазу и останавливает катаболизм пуринов на стадии образования
гипоксантина, растворимость которого почти в 10 раз выше, чем мочевой
кислоты.Действие препарата на фермент объясняется тем, что сначала он, подобно гипоксантину, окисляется в гидроксипуринол, но при этом остаётся прочно связанным с активным центром фермента, вызывая его инактивацию;
с другой стороны, будучи псевдосубстратом, аллопуринол может превращаться в нуклеотид по "запасному" пути и ингибировать ФРДФ синтетазу и амидофосфорибозилтрансферазу, вызывая торможение синтеза пуринов de novo.
Слайд 48Образование пиримидиновых нуклеотидов DE NOVO
Пиримидиновое кольцо синтезируется из простых предшественников:
глутамина, СО2 и аспарагиновой кислоты и затем связывается с рибозо-5-фосфатом,
полученным от ФРДФ.Процесс протекает в цитозоле клеток. Синтез ключевого пиримидинового нуклеотида - УМФ идёт с участием 3 ферментов, 2 из которых полифункциональны.
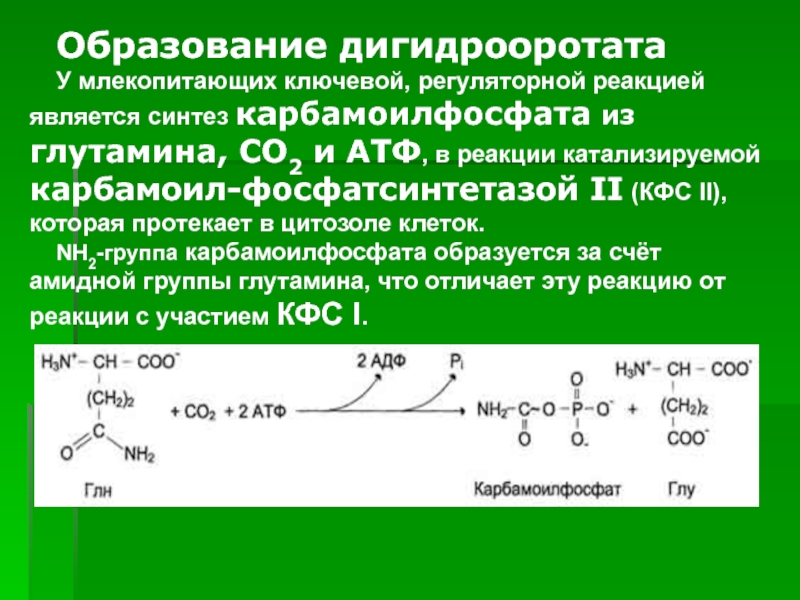
Слайд 49Образование дигидрооротата
У млекопитающих ключевой, регуляторной реакцией является синтез карбамоилфосфата
из глутамина, СО2 и АТФ, в реакции катализируемой карбамоил-фосфатсинтетазой II
(КФС II), которая протекает в цитозоле клеток.NH2-группа карбамоилфосфата образуется за счёт амидной группы глутамина, что отличает эту реакцию от реакции с участием КФС I.
Слайд 50Карбамоилфосфат является продуктом полифункционального фермента, который наряду с активностью КФС
II содержит каталитические центры аспартаттранскарбамоилазы и дигидрооротазы.
Этот фермент назвали
"КАД-фермент" - по начальным буквам ферментативных активностей, которыми обладают отдельные каталитические домены этого белка. Слайд 51
Объединение первых трёх ферментов в единый полифункциональный комплекс позволяет использовать
почти весь синтезированный в первой реакции карбамоилфосфат на взаимодействие с
аспартатом и образование карбамоиласпартата,от которого отщепляется вода и образуется циклический продукт - дигидрооротат.
Слайд 52Образование УМФ
В цитозоле оротат становится субстратом бифункционального фермента -
УМФ-синтазы, которая обнаруживает оротатфосфорибозил-трансферазную и ОМФ-декарбоксилазную активности.
Первоначально фосфорибозильный остаток
от ФРДФ переносится на оротат и образуется нуклеотид - оротидин-5'-монофосфат (ОМФ), декарбоксилирование которого даёт уридин-5-монофосфат (УМФ). Слайд 53Биосинтез УДФ, УТФ и цитидиловых нуклеотидов
УМФ под действием специфических
нуклеозидмонофосфат (НМФ) и нуклеозиддифосфат (НДФ) киназ превращается в УДФ и
УТФ в результате переноса фосфатного остатка АТФ на соответствующий субстрат.НМФ-киназа катализирует следующую реакцию: УМФ + АТФ → УДФ + АДФ
НДФ-киназа: УДФ + АТФ → УТФ + АДФ
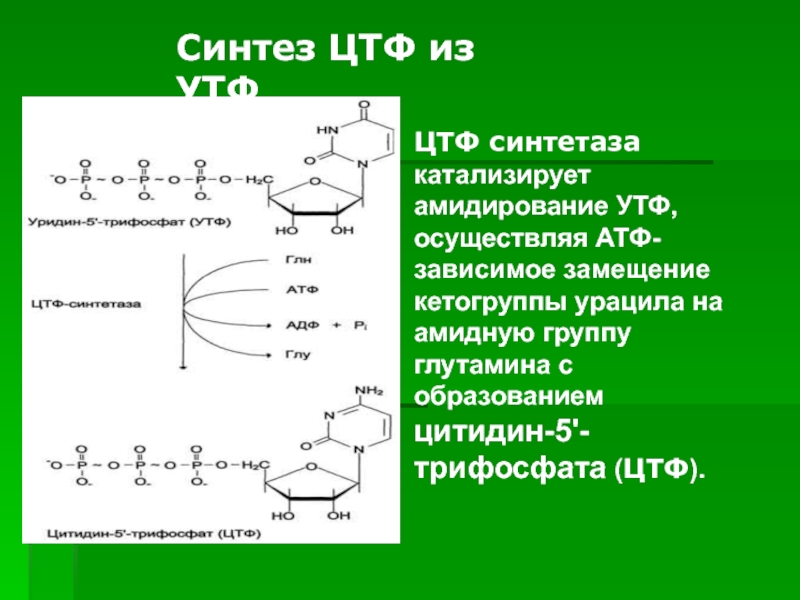
Слайд 54ЦТФ синтетаза катализирует амидирование УТФ, осуществляя АТФ-зависимое замещение кетогруппы урацила
на амидную группу глутамина с образованием цитидин-5'-трифосфата (ЦТФ).
Синтез ЦТФ
из УТФСлайд 55).
"Запасные" пути синтеза пиримидиновых нуклеотидов
Использование пиримидиновых оснований и нуклеозидов
в реакциях реутилизации препятствует катаболизму этих соединений до конечных продуктов
с расщеплением пиримидинового кольца.Так, уридинфосфорилаза в обратимой реакции может рибозилироватъ урацил с образованием уридина.
Урацил + Рибозо-1-фосфат → Уридин + Н3РО4
Слайд 56).
).
Превращение нуклеозидов в нуклеотиды катализирует уридинцитидинкиназа.
Часть ЦМФ
может превращаться в УМФ под действием цитидиндезаминазы и пополнять запасы
уридиловых нуклеотидов.ЦМФ + Н2О → УМФ + NH3
Слайд 57).
Регуляторным ферментом в синтезе пиримидиновых нуклеотидов является КАД-фермент.
УМФ
и пуриновые нуклеотиды аллостерически ингибируют, а ФРДФ активирует его карбамоилсинтетазную
активность, тогда как активность аспартаттранскарбамоилазного домена ингибирует ЦТФ, но активирует АТФ.Этот способ регуляции позволяет обеспечить сбалансированное образование всех четырёх
основных пуриновых и пиримидиновых нуклеотидов, необходимых для синтеза РНК.
Слайд 58).
Активность регуляторных ферментов синтеза пиримидиновых нуклеотидов контролируется аллостерически по
механизму отрицательной обратной связи.
УТФ ингибирует активность КФС II в
составе КАД-фермента. УМФ и ЦМФ подавляют активность УМФ-синтазы. Накопление ЦТФ снижает активность ЦТФ-синтетазы.
Слайд 59).
).
КАД-фермент катализирует реакции 1, 2, 3; дигидрооротатдегидрогеназа -
реакцию 4; УМФ синтетаза - реакции 5 и 6; НМФ
киназа - реакцию 7; НДФ киназа - реакцию 8; ЦТФ синтетаза - реацию 9.Слайд 60).
КАТАБОЛИЗМ ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ
Цитидиловые нуклеотиды могут гидролитически терять аминогруппу и
превращаться в УМФ. От УМФ при участии нуклеотидазы и уридинфосфорилазы
отщепляются неорганический фосфат и рибоза, то остаётся азотистое основание - урацил.Аналогично расщепляются дезоксирибонуклеотиды, и из дЦМФ образуется урацил, а из дTМФ – тимин.
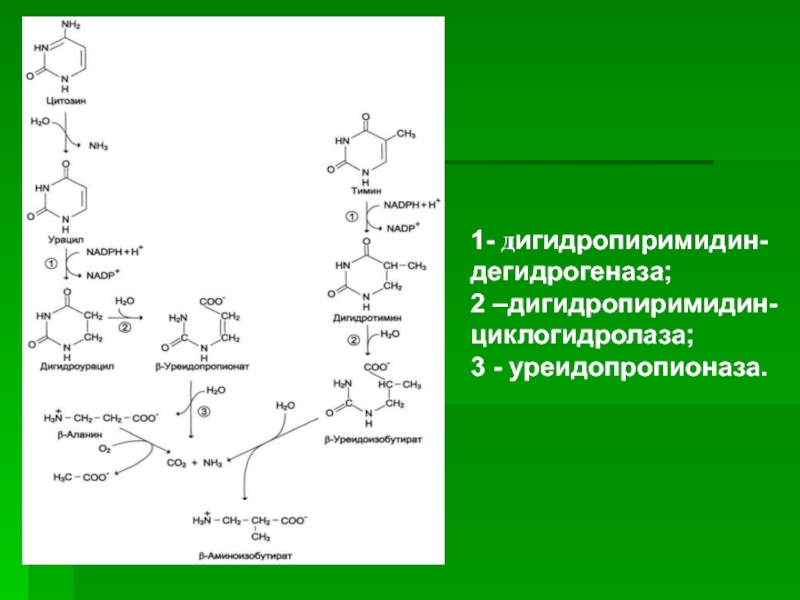
Пиримидиновые основания при участии дигидропиримидиндегидрогеназы присоединяют 2 атома водорода по двойной связи кольца с образованием дигидроурацила или дигидротимина.
Слайд 61).
Оба гетероцикла могут взаимодействовать с водой в реакции, катализируемой
дигидропиримидинциклогидролазой, и дигидроурацил превращается в β-уреидопропионовую кислоту, а дигидротимин -
в β-уреидоизомасляную кислоту.Оба β-уреидопроизводных под действием общего для них фермента уреидопропионазы расщепляются с образованием СО2, NH4+ и β-аланина или β-аминоизомасляной кислоты (β-аминбутирата) соответственно.
Слайд 62).
).
1- дигидропиримидин-дегидрогеназа;
2 –дигидропиримидин-циклогидролаза;
3 - уреидопропионаза.
Слайд 63).
).
β-Аланин обнаруживают в плазме крови и многих тканях.
Он используется в мышцах на образование дипептидов: карнозина и анзерина.
Под действием бактериальной микрофлоры кишечника β-аланин включается в пантотеновую кислоту, которая всасывается и используется на образование КоА.Часть β-аланина и β-аминбутирата трансаминируется с α-кетоглутаратом и даёт малонил полуальдегид или метилмалонил полуальдегид соответственно, которые превращаются в малонил-КоА и сукцинил-КоА и используются в соответствующих метаболических путях, либо окисляются до СО2 и Н2О. Частично β-аминобутират экскретируется с мочой.
Слайд 64).
НАРУШЕНИЯ ОБМЕНА ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ
Оротацидурия - вызвано дефектом в работе
второго бифункционального фермента синтеза нуклеотидов de novo - УМФ-синтазы,
два
других обнаружены в процессе катаболизма пиримидинов. Слайд 65).
).
Это единственное нарушение, которое вызвано снижением активности УМФ-синтазы,
которая катализирует образование и декарбоксилирование ОМФ. Поскольку в эмбриогенезе от
образования пиримидинов de novo зависит обеспечение синтеза ДНК субстратами, то жизнь плода невозможна при полном отсутствии активности этого фермента.Действительно, у всех пациентов с оротацидурией отмечают заметную, хотя и очень низкую активность УМФ-синтазы.
Установлено, что содержание оротовои кислоты в моче пациентов (1 г/сут и более) значительно превосходит количество оротата, которое ежедневно синтезируется в норме (около 600 мг/сут). Снижение синтеза пиримидиновых нуклеотидов, наблюдающееся при этой патологии, нарушает регуляцию КАД-фермента из-за чего возникает гиперпродукция оротата.
Слайд 66).
Клинически наиболее характерное следствие оротацидурии - мегалобластная анемия, вызванная
неспособностью организма обеспечить нормальную скорость деления клеток эритроцитарного ряда.
Недостаточность
синтеза пиримидиновых нуклеотидов сказывается на интеллектуальном развитии, двигательной способности и сопровождается нарушениями работы сердца и ЖКТ. Нарушается формирование иммунной системы, и наблюдается повышенная чувствительность к различным инфекциям. Слайд 67).
Кроме генетически обусловленных причин, оротацидурия может наблюдаться:
при
гипераммониемии, вызванной дефектом любого из ферментов орнитинового цикла,
за
исключением карбамоилфосфат- синтетазы I. В этом случае карбамоилфосфат, синтезированный в митохондриях, выходит в цитозоль клеток и начинает использоваться на образование пиримидиновых нуклеотидов. Концентрация всех метаболитов, в том числе и оротовой кислоты, повышается. Наиболее значительная экскреция оротата отмечается при недостаточности орнитинкарбамоилтрансферазы (второго фермента орнитинового цикла); в процессе лечения подагры аллопуринолом, который превращается в оксипуринолмононуклеотид и становится сильным ингибитором УМФ-синтазы. Это приводит к накоплению оротовой кислоты в тканях и крови.
Слайд 68).
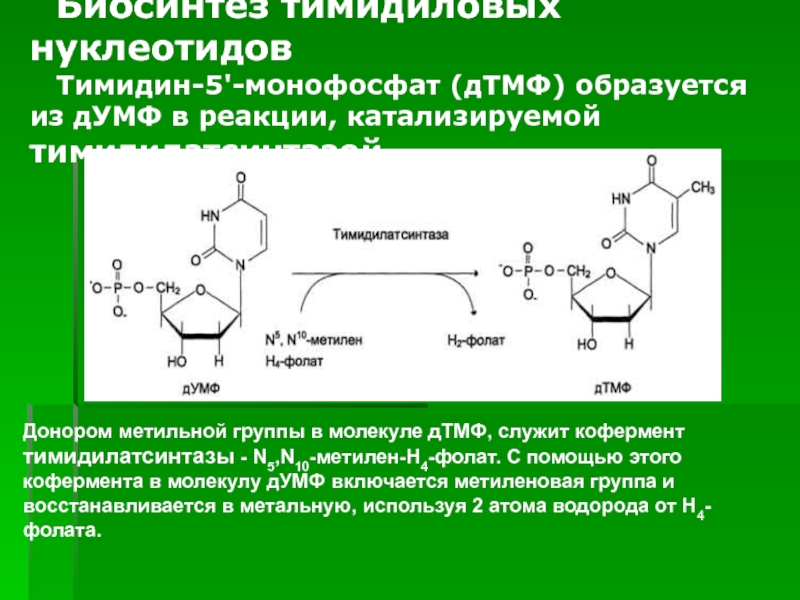
БИОСИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВ
Синтез дезоксирибонуклеотидов идёт с заметной скоростью только в
тех клетках, которые вступают в S-фазу клеточного цикла и готовятся
к синтезу ДНК и делению. В покоящихся клетках дезоксинуклеотиды практически отсутствуют.Все дезоксинуклеотиды, кроме тимидиловых, образуются из рибонуклеотидов путём прямого восстановления ОН-группы у второго углеродного атома рибозы в составе рибонуклеозиддифосфатов до дезоксирибозы.
Тимидиловые нуклеотиды синтезируются из дУМФ особым путём с участием N5,N10-метилен-Н4-фолата.