Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аминокислоты и белки
Содержание
- 1. Аминокислоты и белки
- 2. Аминокислоты Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой
- 3. АминокислотыАминокислоты, в которых первичная аминогруппа находится в
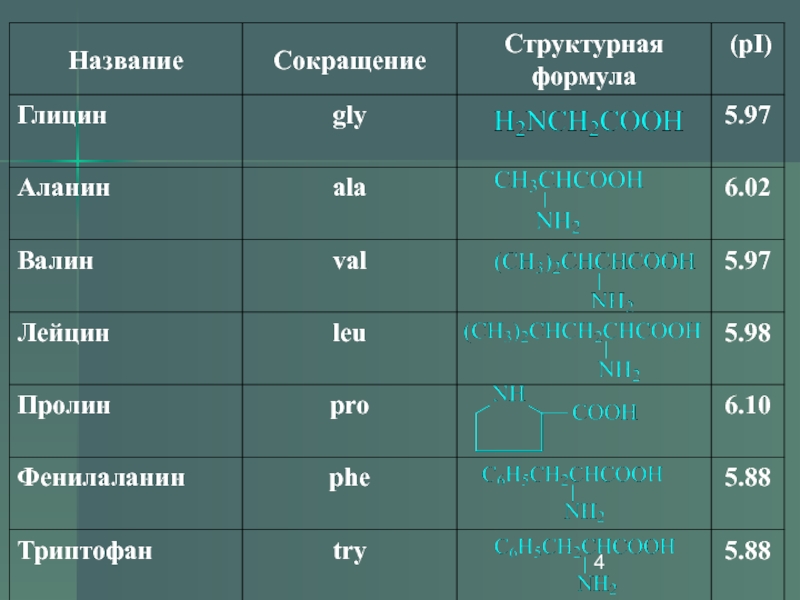
- 4. Слайд 4
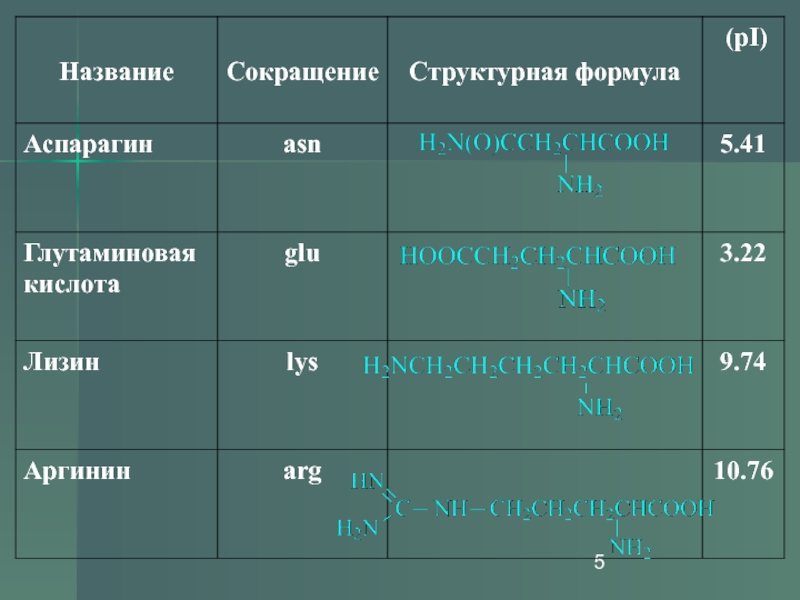
- 5. Слайд 5
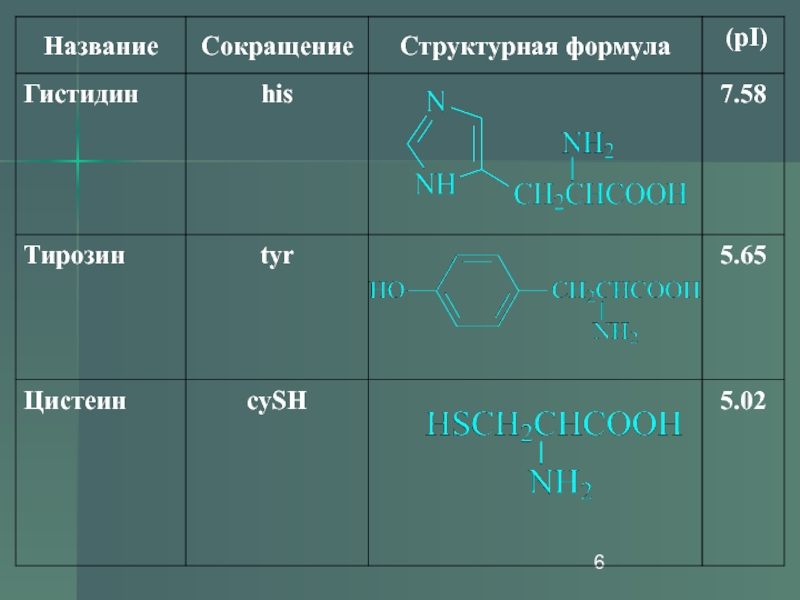
- 6. Слайд 6
- 7. Незаменимые аминокислоты Незаменимыми называются аминокислоты, которые не могут
- 8. Незаменимые аминокислоты Следующие аминокислоты принято считать незаменимыми для
- 9. . Кофигурация аминокислотКаждая α-аминокислота за исключением глицина,
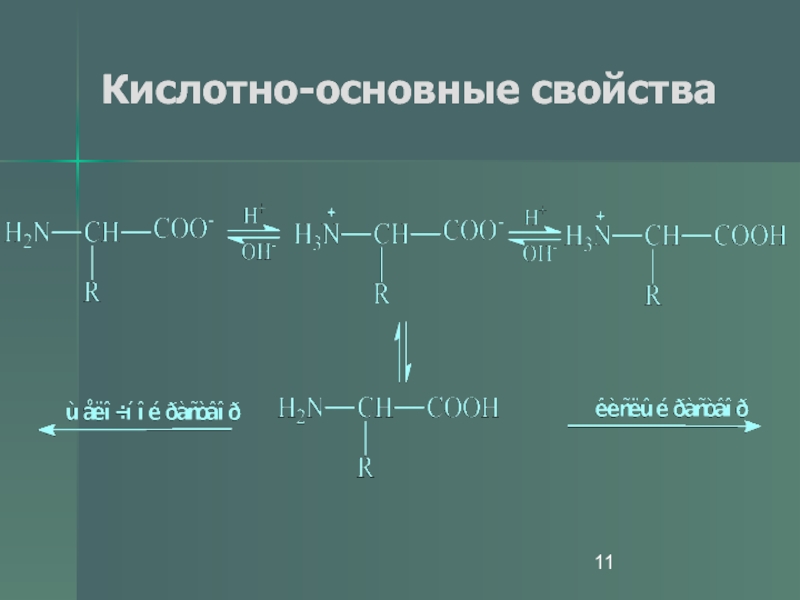
- 10. Кислотно-основные свойства Константы кислотности и основности для
- 11. Кислотно-основные свойства
- 12. Кислотно-основные свойства не ионная форма; идеализированная аминокислота цвиттер-ион; аминокислота в твердом состоянии
- 13. Изоэлектрическая точка (рI) Изоэлектрической точкой называется такое
- 14. Способы получения аминокислот Аминирование α-галогензамещенных кислот
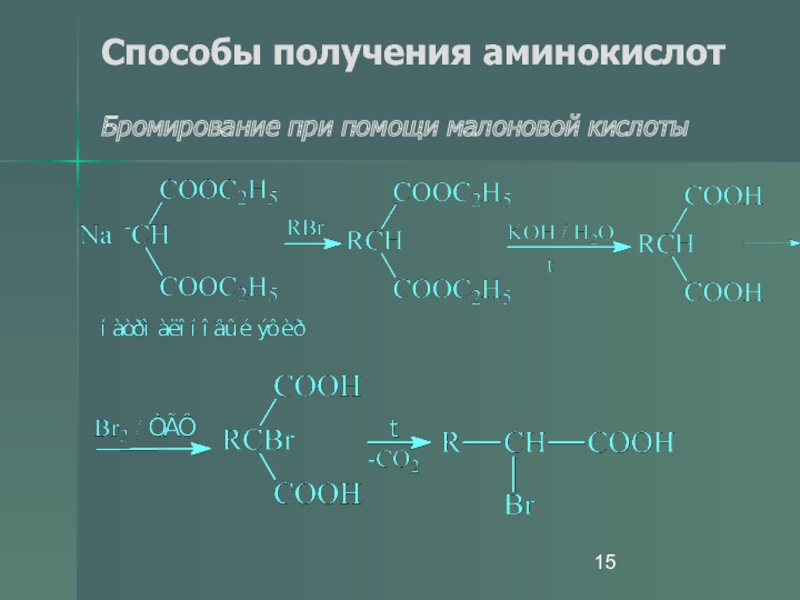
- 15. Способы получения аминокислот Бромирование при помощи малоновой кислоты
- 16. Способы получения аминокислот Синтез Штреккера–Зелинского
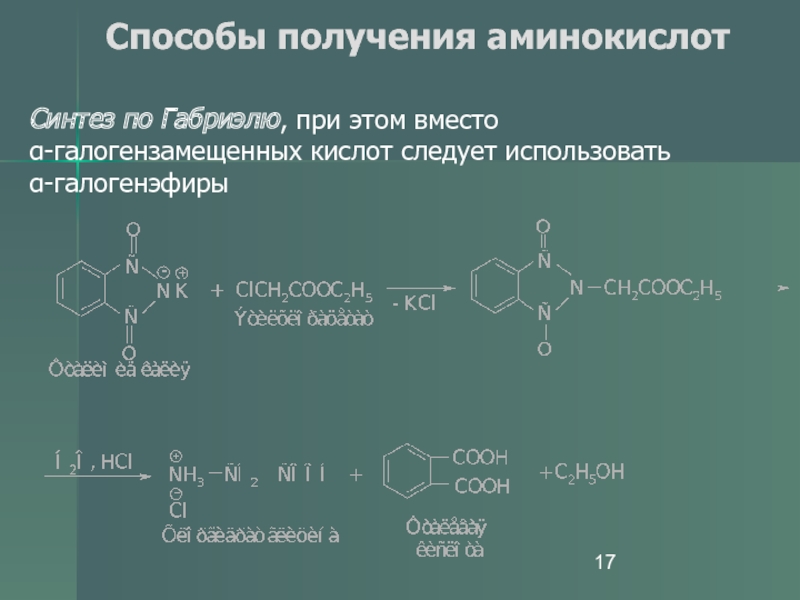
- 17. Способы получения аминокислот Синтез по Габриэлю, при этом вместо α-галогензамещенных кислот следует использовать α-галогенэфиры
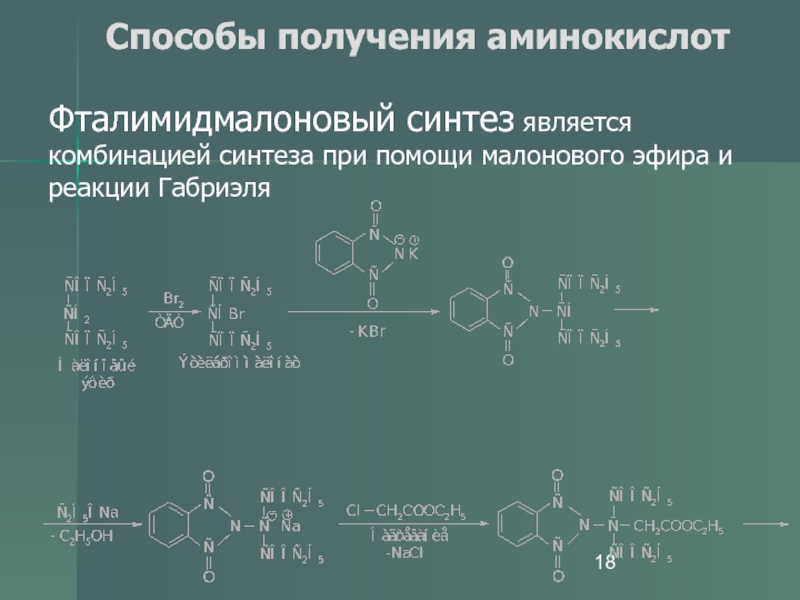
- 18. Способы получения аминокислот Фталимидмалоновый синтез
- 19. Способы получения аминокислот Фталимидмалоновый синтезВсе
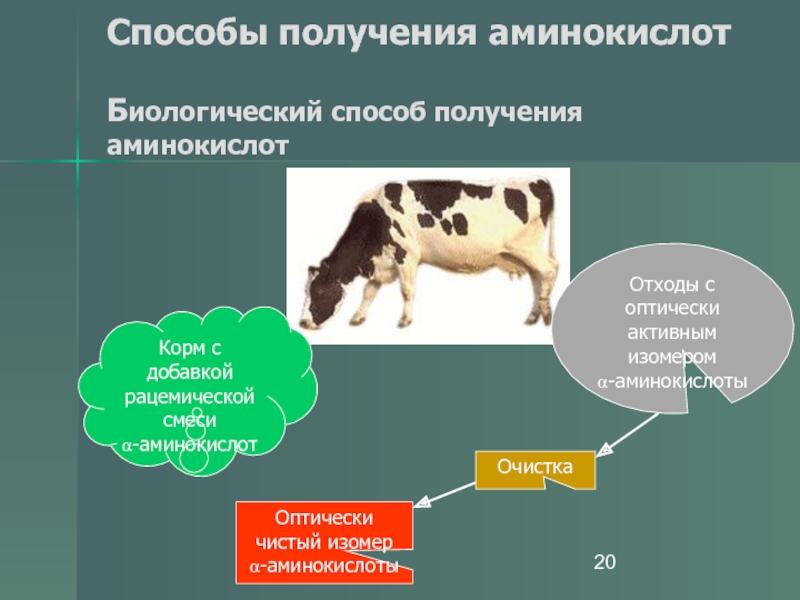
- 20. Способы получения аминокислот Биологический способ получения
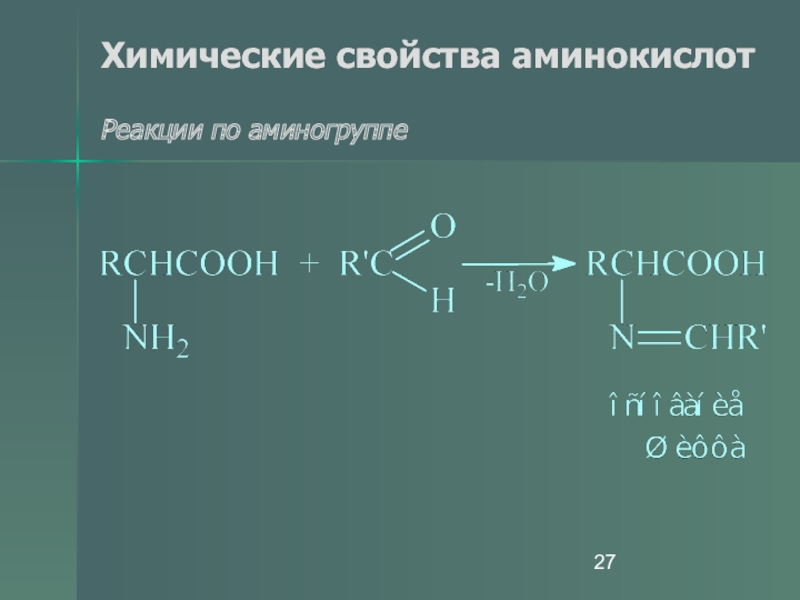
- 21. Химические свойства аминокислот Реакции по аминогруппе Метод Ван-Слайка
- 22. Химические свойства аминокислот Реакции по аминогруппе Аминокислоты могут быть проалкилированы по аминогруппе
- 23. Химические свойства аминокислот Реакции по аминогруппе Ацилирование аминокислот по аминогруппе протекает достаточно легко
- 24. Химические свойства аминокислот Реакции по аминогруппе
- 25. Химические свойства аминокислот Реакции по аминогруппе
- 26. Химические свойства аминокислот Реакции по аминогруппе
- 27. Химические свойства аминокислот Реакции по аминогруппе
- 28. Химические свойства аминокислот Реакции карбоксильной группы
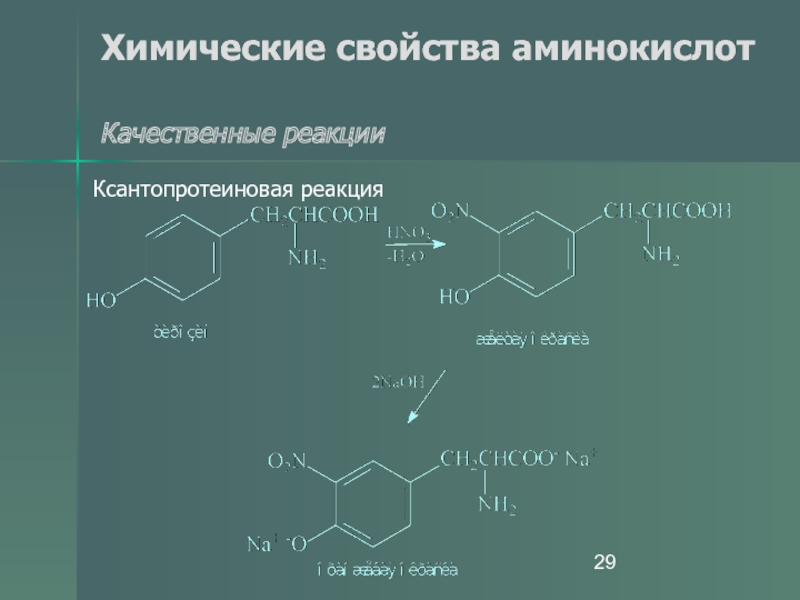
- 29. Химические свойства аминокислот Качественные реакции Ксантопротеиновая реакция
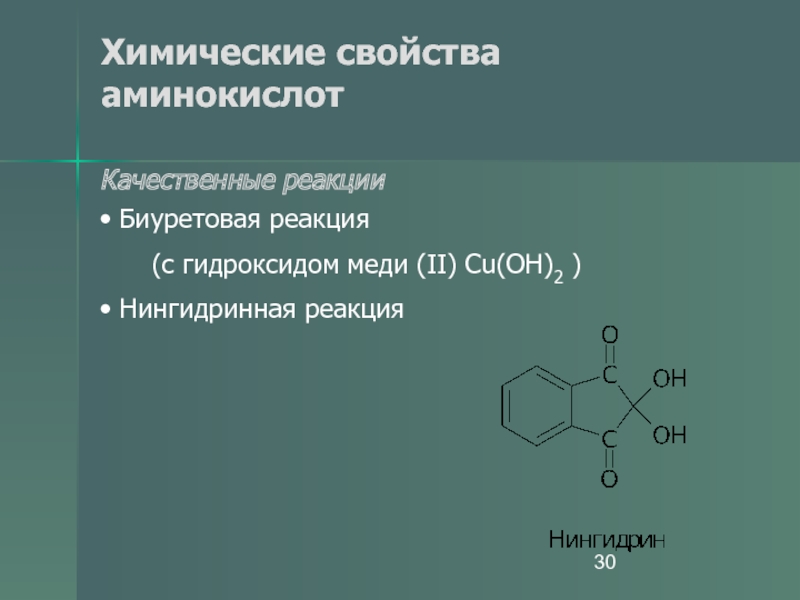
- 30. Химические свойства аминокислот Качественные реакции Биуретовая реакция (с гидроксидом меди (II) Cu(OH)2 ) Нингидринная реакция
- 31. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот
- 32. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции β-аминокислот
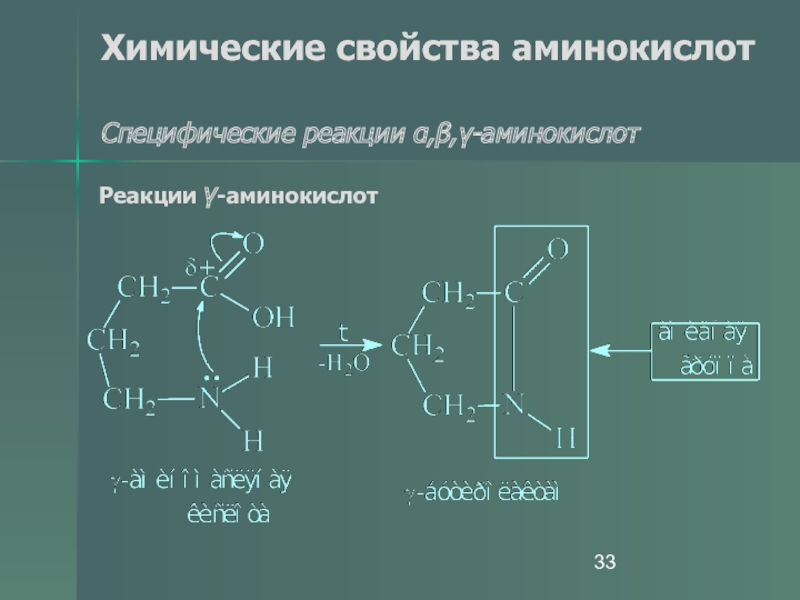
- 33. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции γ-аминокислот
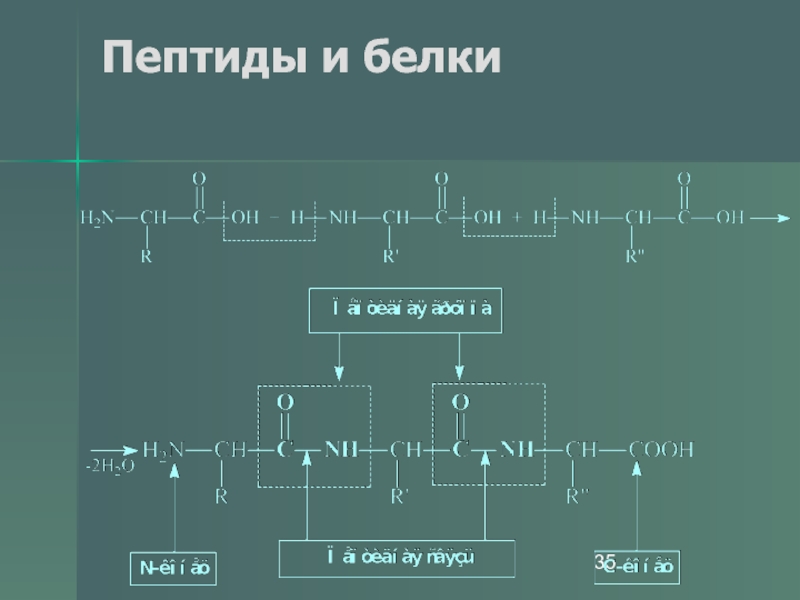
- 34. Пептиды и белки Пептиды — соединения, построенные из нескольких остатков α-аминокислот, связанных амидной (пептидной) связью.
- 35. Пептиды и белки
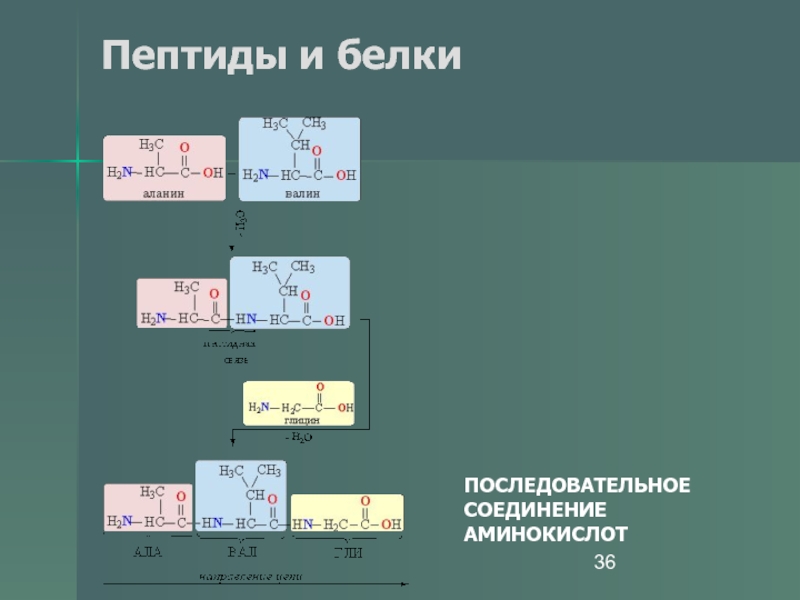
- 36. Пептиды и белки ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ
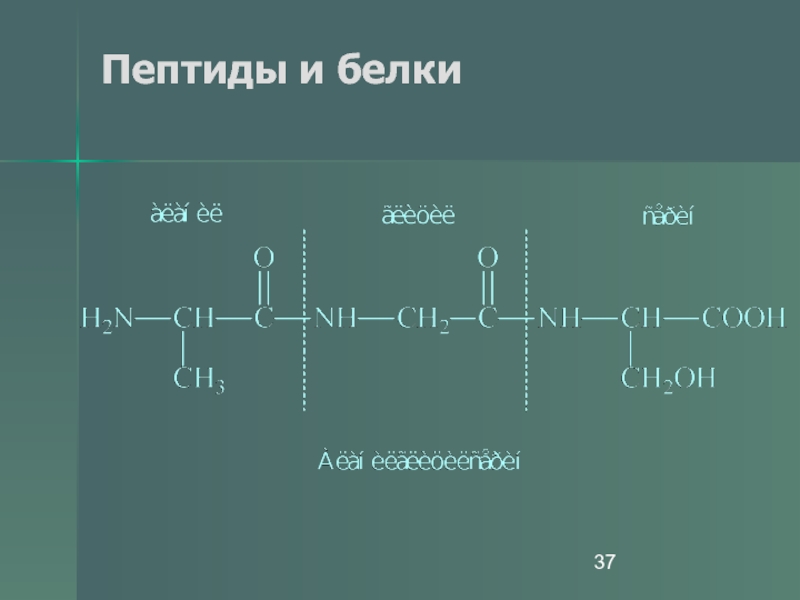
- 37. Пептиды и белки
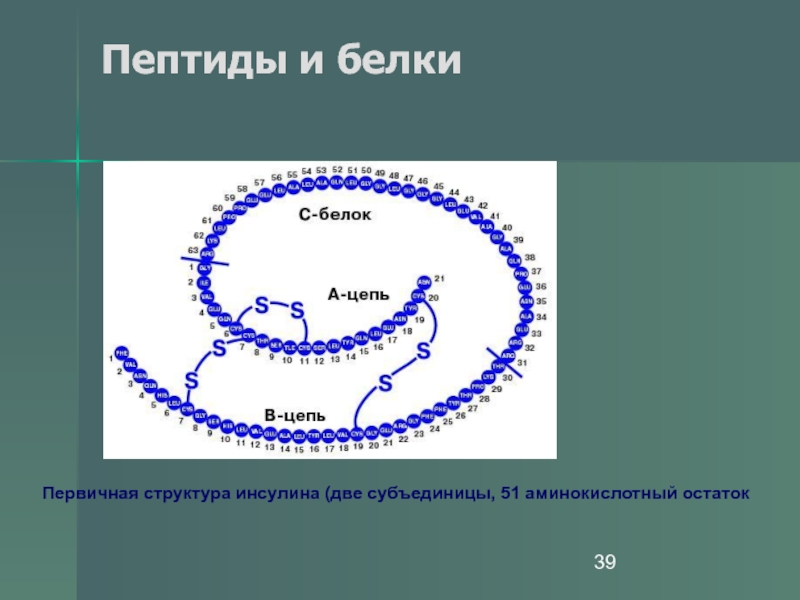
- 38. Пептиды и белки Первичная структура белка инсулина.
- 39. Пептиды и белки
- 40. Пептиды и белки Структура белков
- 41. Пептиды и белки Вторичная структура
- 42. Пептиды и белки Вторичная структура белков α-спираль молекулы белка
- 43. Пептиды и белки Вторичная
- 44. Пептиды и белки Третичная структура
- 45. Пептиды и белки Третичная структура белков
- 46. Пептиды и белки Глобулярные белкиГЛОБУЛЯРНАЯ
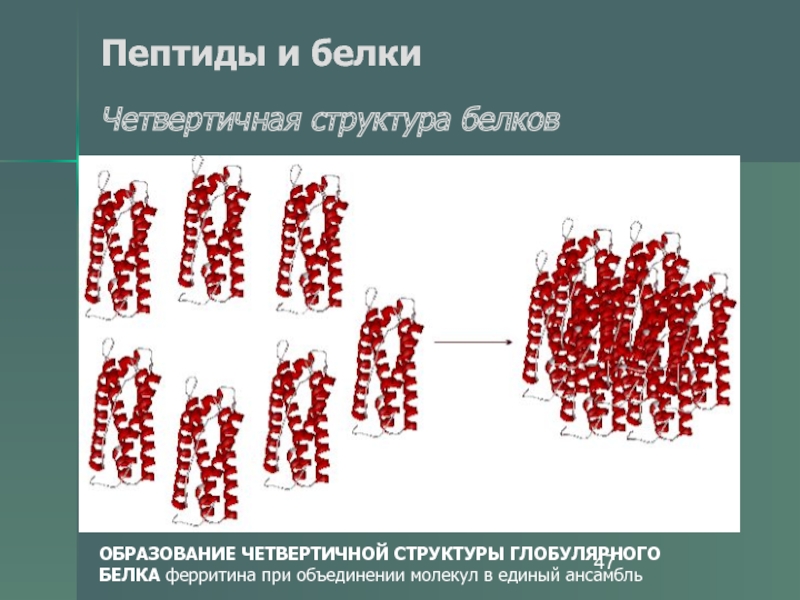
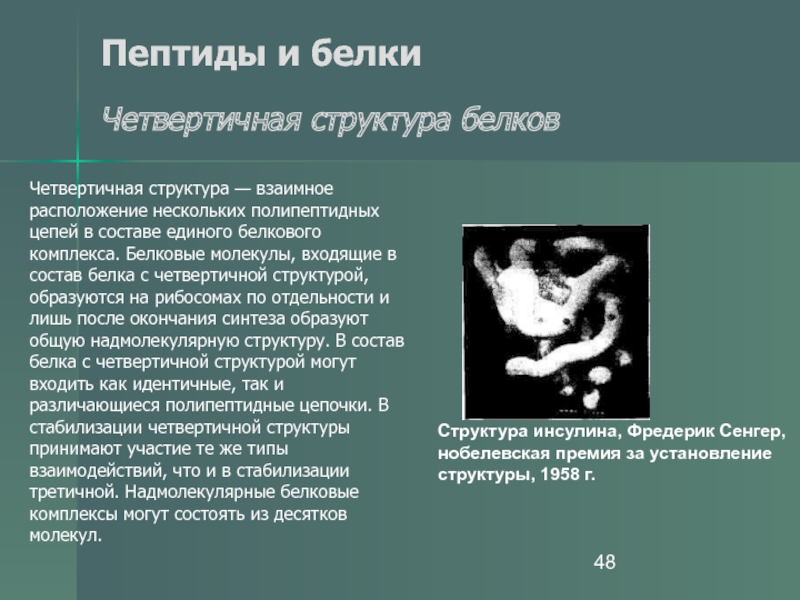
- 47. Пептиды и белки Четвертичная структура
- 48. Пептиды и белки Четвертичная структура
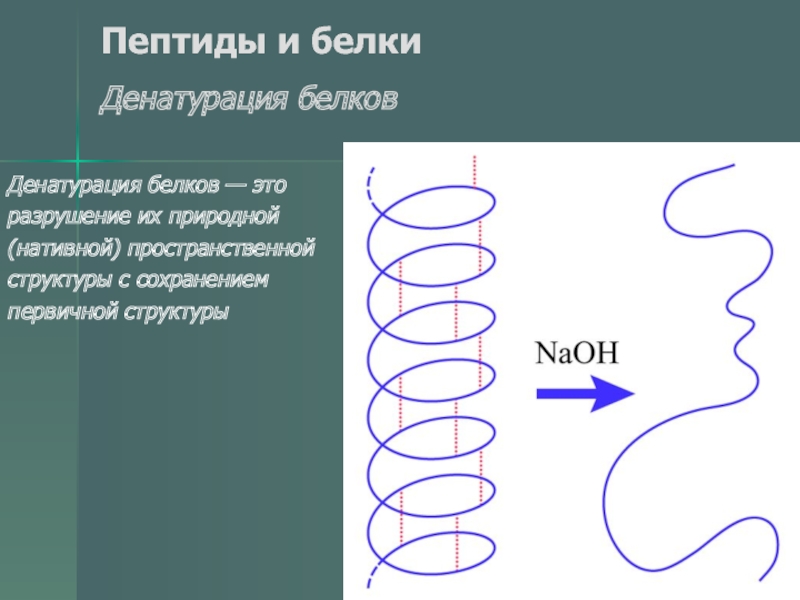
- 49. Пептиды и белки Денатурация белковДенатурация
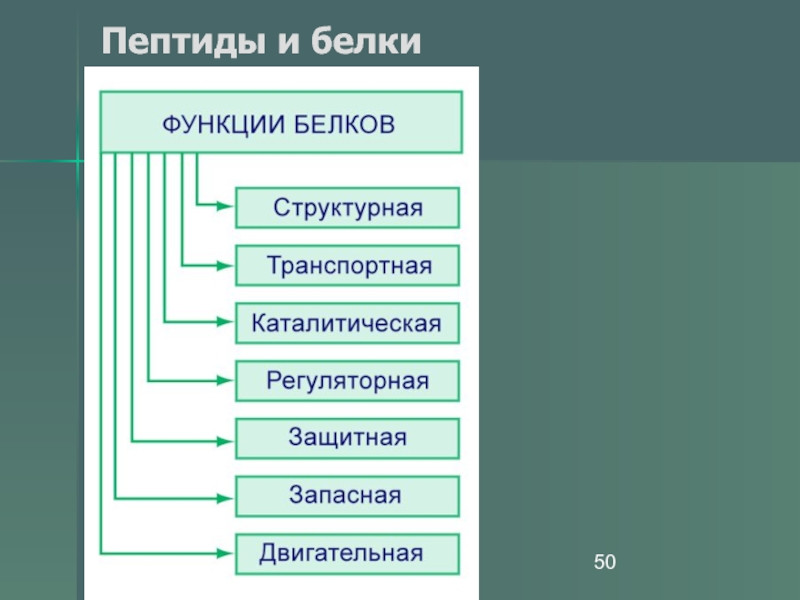
- 50. Пептиды и белки Функции белков
- 51. Скачать презентанцию
Аминокислоты Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой
Слайды и текст этой презентации
Слайд 2Аминокислоты
Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу,
является аминокислотой
Слайд 3Аминокислоты
Аминокислоты, в которых первичная аминогруппа находится в α-положении по отношению
к карбоксильной, называются α-аминокислотами. Они играют важную роль в жизни
живых организмов, так как белки с химической точки зрения являются полимерами, образованными из нескольких сотен или даже тысяч остатков α-аминокислотСлайд 7Незаменимые аминокислоты
Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом
из веществ, поступающих с пищей, в количествах, достаточных для того,
чтобы удовлетворить физиологические потребности организма.Слайд 8Незаменимые аминокислоты
Следующие аминокислоты принято считать незаменимыми для организма человека:
изолейцин,
лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Слайд 9. Кофигурация аминокислот
Каждая α-аминокислота за исключением глицина, содержит асимметрический α-углеродный
атом. Аминокислоты, получающиеся в результате гидролиза белков, являются оптически активными,
и все они имеют одинаковую конфигурацию по α-углеродному атому
Слайд 10
Кислотно-основные свойства
Константы кислотности и основности для групп –СООН и
–NH2 очень малы. Для большинства карбоновых кислот Ка~10-5, для алифатических
аминов Кb~104, в тоже время для глицина Ка=1,6·10–10, а Кb=2,5·10–12. Их водные растворы ведут себя как растворы веществ с высоким дипольным моментом.Слайд 12Кислотно-основные свойства
не ионная форма;
идеализированная аминокислота
цвиттер-ион;
аминокислота в твердом состоянии
Слайд 13Изоэлектрическая точка (рI)
Изоэлектрической точкой называется такое значение pH, имеющее
определенное значение для каждой аминокислоты, при котором содержание диполярного иона
(цвиттер-иона) максимальноСлайд 17
Способы получения аминокислот
Синтез по Габриэлю, при этом вместо
α-галогензамещенных кислот
следует использовать
α-галогенэфиры
Слайд 18
Способы получения аминокислот
Фталимидмалоновый синтез является комбинацией синтеза при помощи малонового
эфира и реакции Габриэля
Слайд 19
Способы получения аминокислот
Фталимидмалоновый синтез
Все эти методы синтеза приводят к получению
рацемической смеси энантиомеров α-аминокислот
Слайд 20Способы получения аминокислот
Биологический способ получения аминокислот
Корм с добавкой рацемической смеси
α-аминокислот
Отходы с оптически активным изомером
α-аминокислоты
Очистка
Оптически чистый изомер
α-аминокислоты
Слайд 22Химические свойства аминокислот
Реакции по аминогруппе
Аминокислоты могут быть проалкилированы по
аминогруппе
Слайд 23Химические свойства аминокислот
Реакции по аминогруппе
Ацилирование аминокислот по аминогруппе протекает
достаточно легко
Слайд 24Химические свойства аминокислот
Реакции по аминогруппе
Получение N-ацильных производных используют как
метод защиты аминогруппы при проведении реакций по карбоксильной группе. При
этом следует принимать во внимание легкость снятия защиты – отщепления защищающей группыСлайд 25Химические свойства аминокислот
Реакции по аминогруппе
После проведения реакции по карбоксильной
группе блокирующую группу удаляют гидрированием
Слайд 30Химические свойства аминокислот
Качественные реакции
Биуретовая реакция
(с гидроксидом меди (II)
Cu(OH)2 )
Нингидринная реакция
Слайд 31Химические свойства аминокислот
Специфические реакции α,β,γ-аминокислот
Реакции α-аминокислот
Поведение α-, β-аминокислот также
аналогично поведению
α-, β-оксикислот. При нагревании этил-α-аминобутирата образуется димерный диэтилдикетопиперазин
Слайд 32Химические свойства аминокислот
Специфические реакции α,β,γ-аминокислот
Реакции β-аминокислот
Слайд 33Химические свойства аминокислот
Специфические реакции α,β,γ-аминокислот
Реакции γ-аминокислот
Слайд 34Пептиды и белки
Пептиды — соединения, построенные из нескольких остатков
α-аминокислот, связанных амидной (пептидной) связью.
Слайд 40Пептиды и белки
Структура белков
Первичная структура пептидов и белков
— это последовательность аминокислотных остатков в полипептидной цепи.
Слайд 41Пептиды и белки
Вторичная структура белков
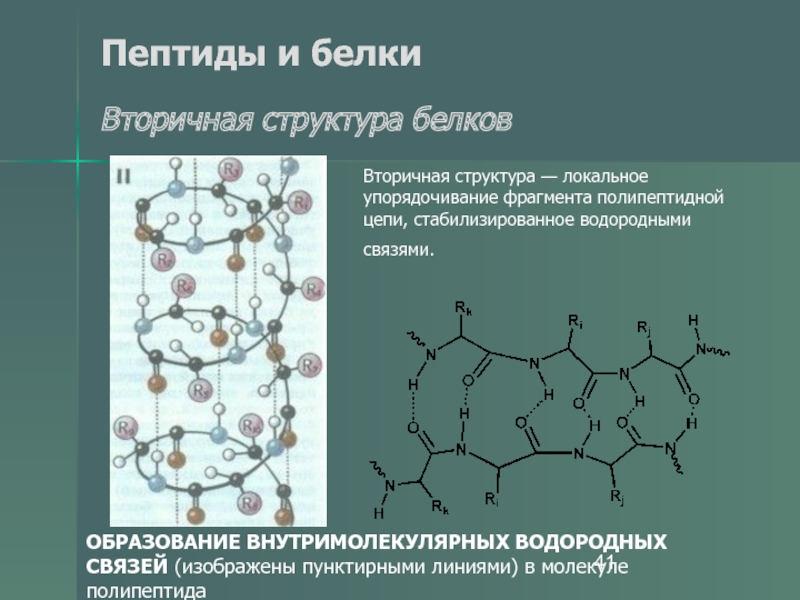
ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ ВОДОРОДНЫХ СВЯЗЕЙ
(изображены пунктирными линиями) в молекуле полипептида
Вторичная структура — локальное упорядочивание
фрагмента полипептидной цепи, стабилизированное водородными связями. Слайд 43Пептиды и белки
Вторичная структура белков
Вторичная структура белка
— это более высокий уровень структурной организации, в котором закрепление
конформации происходит за счет водородных связей между пептидными группами.Слайд 44Пептиды и белки
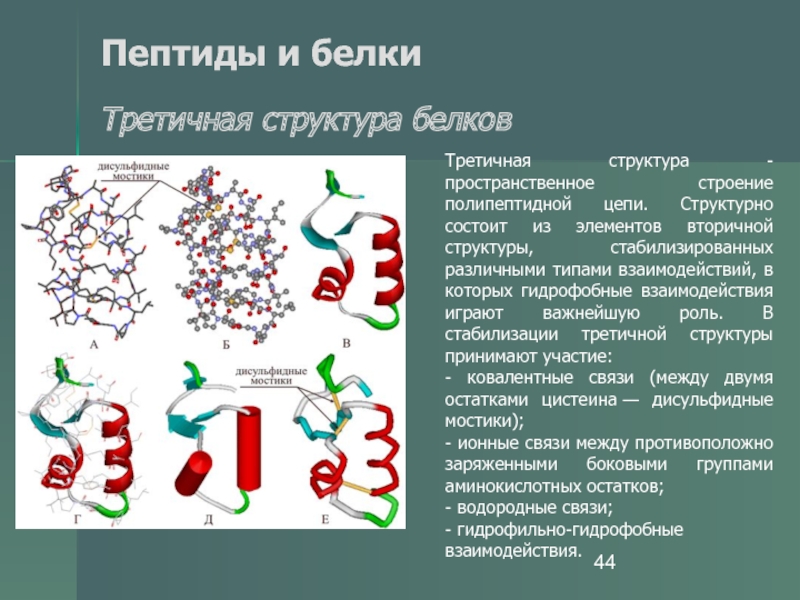
Третичная структура белков
Третичная структура - пространственное
строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных
различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:- ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
- ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
- водородные связи;
- гидрофильно-гидрофобные взаимодействия.