Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ФЕНОЛЫ
Содержание
- 1. ФЕНОЛЫ
- 2. ФЕНОЛЫСледует выделить особенности строения и свойства фенолов,
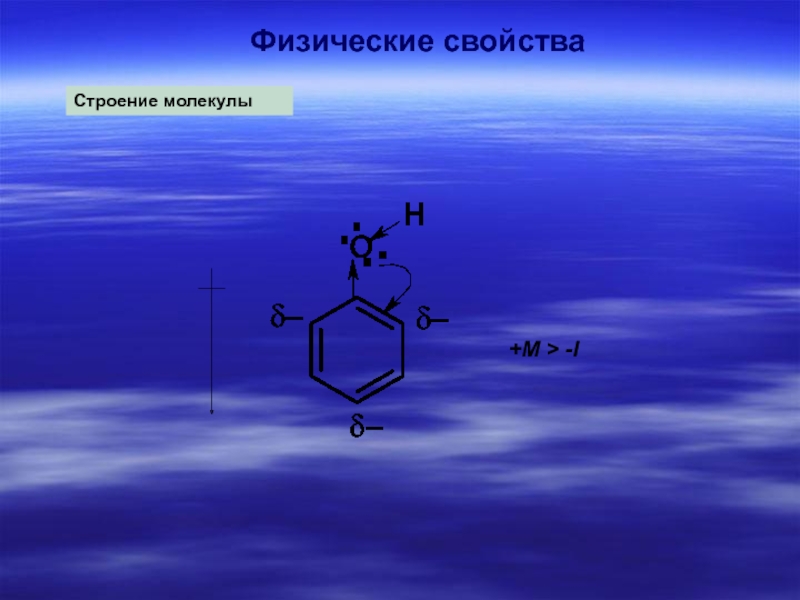
- 3. Физические свойства
- 4. Физические свойстваСтроение молекулы+M > -I
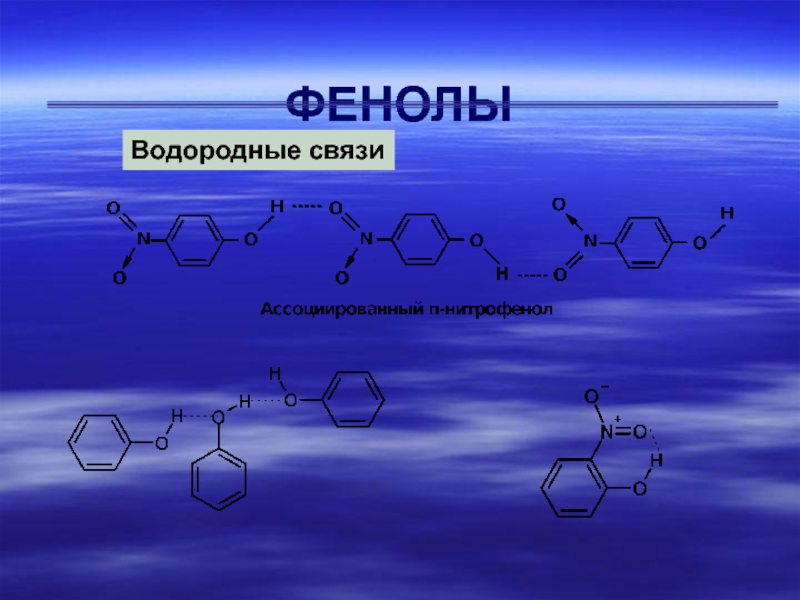
- 5. ФЕНОЛЫВодородные связи
- 6. ФЕНОЛЫФенолы более сильные кислоты чем вода (рКа=15,70)
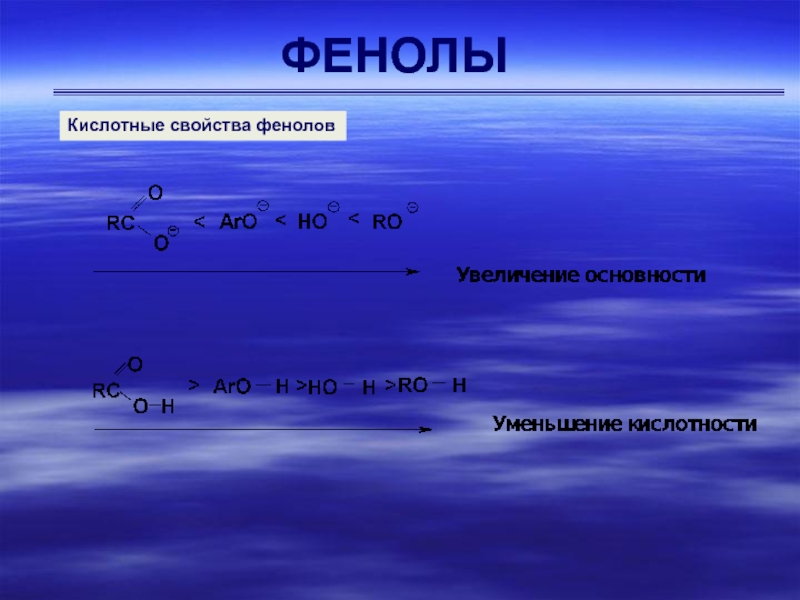
- 7. ФЕНОЛЫКислотные свойства фенолов
- 8. ФЕНОЛЫКислотные свойства фенолов
- 9. ФЕНОЛЫОбразование солей
- 10. ФЕНОЛЫЭлектроноакцепторные заместители в ароматическом ядре рассредоточивают отрицательный
- 11. ФЕНОЛЫКачественная реакция на фенолы.Образование окрашенных комплексных соединений
- 12. ФЕНОЛЫФенолы и феноксид-ионы – нуклеофильные реагенты Химические
- 13. ФЕНОЛЫО-ацилирование фенолов SNКак и спирты, фенолы можно
- 14. ФЕНОЛЫО-ацилирование фенолов SN
- 15. ФЕНОЛЫО-ацилирование фенолов SNПерегруппировка ФрисаПерегруппировка может протекать как
- 16. ФЕНОЛЫЭлектрофильное замещение SEArБлагодаря электронодонорному эффекту сопряжения группа
- 17. ФЕНОЛЫЭлектрофильное замещение SEArВ том случае, если атаке
- 18. ФЕНОЛЫГалогенирование Реакции фенолов с галогенами проводят без
- 19. ФЕНОЛЫГалогенирование Слабополярный растворитель, фенол не диссоциирует.
- 20. ФЕНОЛЫНитрование, SEArо-Изомер отделяется при перегонке с водянымпаром.
- 21. ФЕНОЛЫНитрование, SEAr
- 22. ФЕНОЛЫСульфирование Сульфирование фенола при комнатной температуре приводит
- 23. ФЕНОЛЫС-алкилирование Фенолы легко подвергаются алкилированию в ядро.
- 24. ФЕНОЛЫС-алкилирование
- 25. ФЕНОЛЫС-ацилирование Реакции Фриделя-Крафтса в присутствии хлорида алюминия
- 26. ФЕНОЛЫС-ацилирование Конденсация фенола с фталевым ангидридом, SEArРазновидность реакции ацилирования по Фриделю-Крафтсу (А.Байер).
- 27. ФЕНОЛЫ
- 28. ФЕНОЛЫРеакция с формальдегидом. Фенолформальдегидные смолы К числу
- 29. ФЕНОЛЫРеакция с формальдегидом. Фенолформальдегидные смолы Образование полимера
- 30. ФЕНОЛЫФенолформальдегидные смолы Первое синтетическое высокомолекулярное вещество.Л.Бакелунд, 1909 г
- 31. ФЕНОЛЫЭлектрофильное замещение в феноксид-ионеРеакция Кольбе Двуокись углерода
- 32. ФЕНОЛЫКольбе Адольф Вильгельм Герман1818 - 1884
- 33. ФЕНОЛЫСочетание с солями диазония. Образование диазосоединений
- 34. ФЕНОЛЫРеакция Реймера-Тимана Обработка фенола хлороформом и водной
- 35. ФЕНОЛЫРеакция Реймера-Тимана Реакция Реймера-Тимана включает стадию электрофильного
- 36. ФЕНОЛЫОкисление Фенолы чувствительны к действию окислителей. Под
- 37. ФЕНОЛЫОкисление Фенолы, содержащие разветвленные алкильные группы в
- 38. ФЕНОЛЫВосстановление Фенолы гидрируются водородом над никелевым катализатором
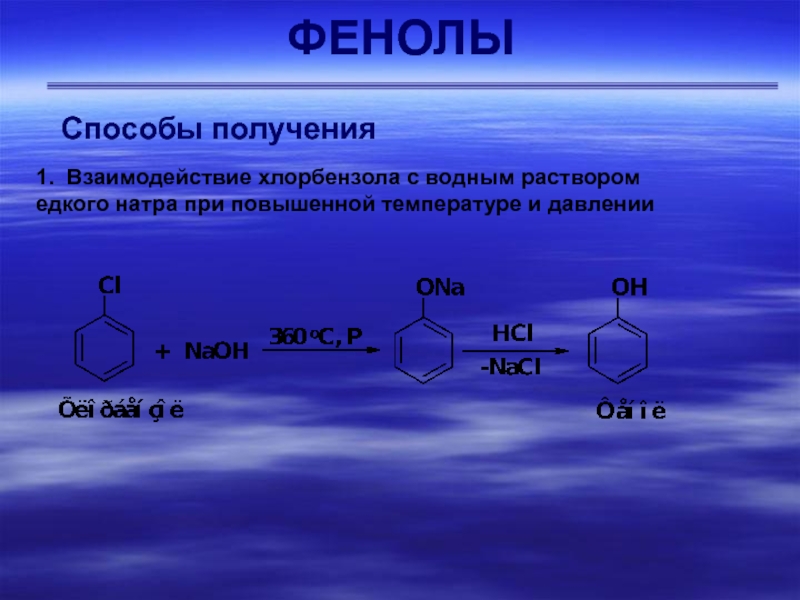
- 39. ФЕНОЛЫСпособы получения 1. Взаимодействие хлорбензола с водным раствором едкого натра при повышенной температуре и давлении
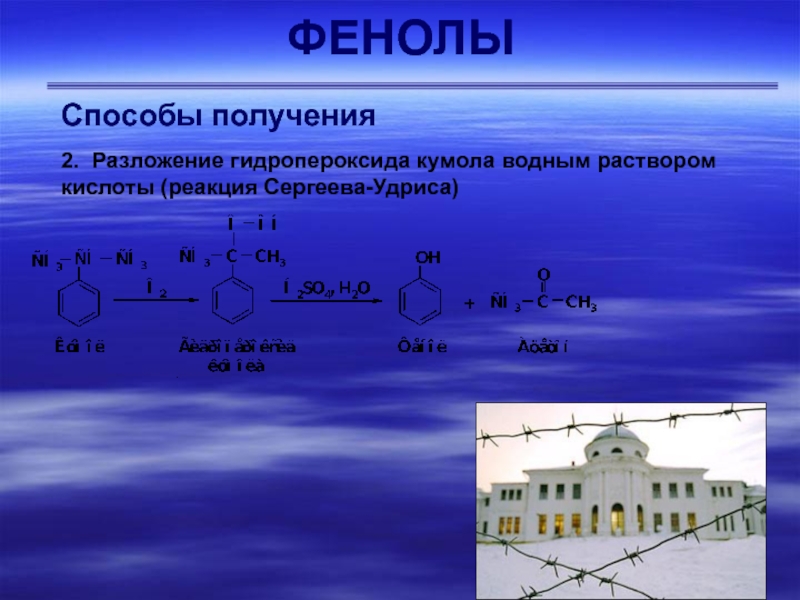
- 40. ФЕНОЛЫСпособы получения 2. Разложение гидропероксида кумола водным раствором кислоты (реакция Сергеева-Удриса)
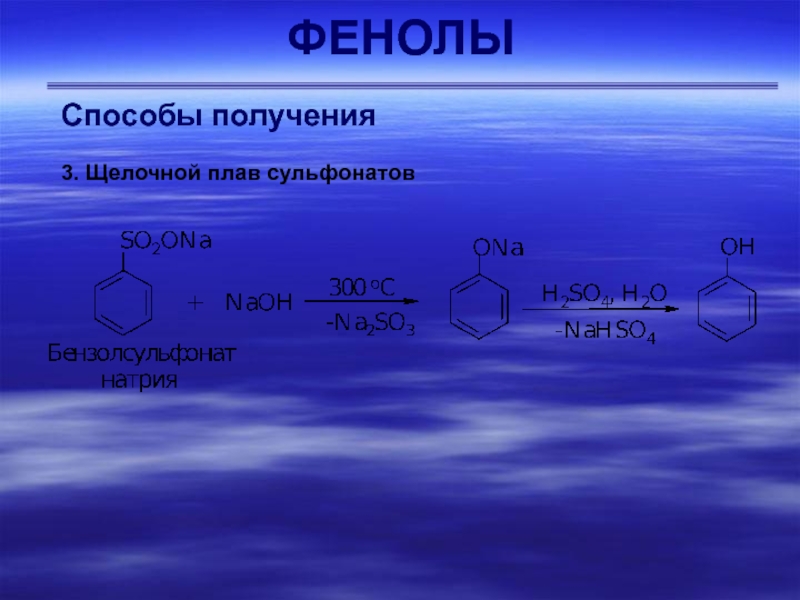
- 41. ФЕНОЛЫСпособы получения 3. Щелочной плав сульфонатов
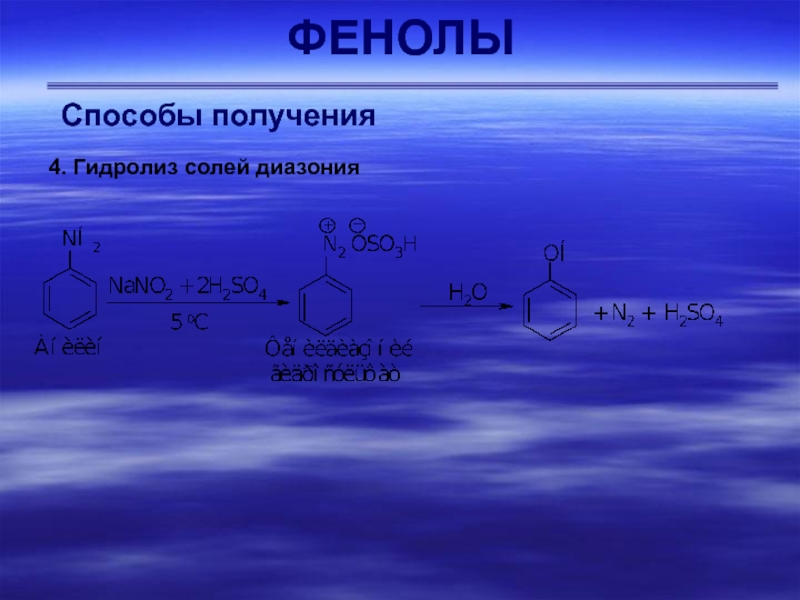
- 42. ФЕНОЛЫСпособы получения 4. Гидролиз солей диазония
- 43. ФЕНОЛЫ
- 44. Скачать презентанцию
Слайды и текст этой презентации
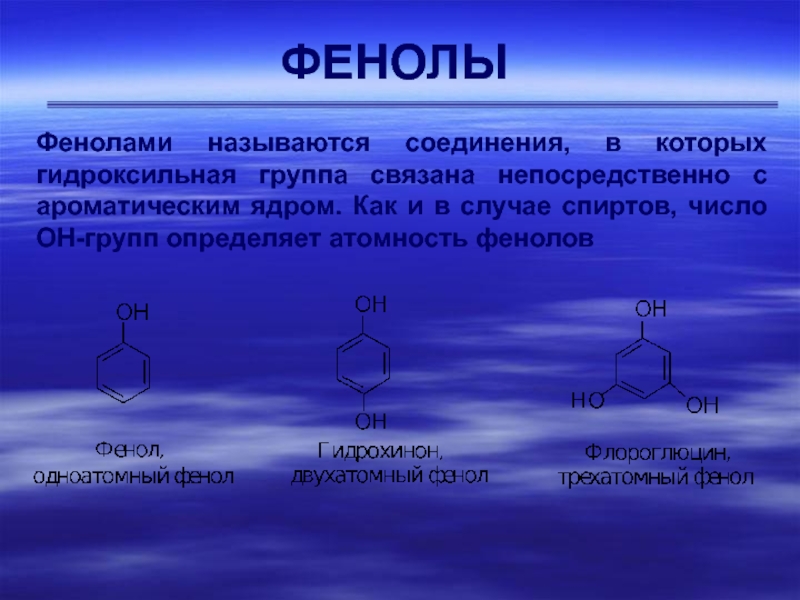
Слайд 1ФЕНОЛЫ
Фенолами называются соединения, в которых гидроксильная группа связана непосредственно с
Слайд 2ФЕНОЛЫ
Следует выделить особенности строения и свойства фенолов, в которых проявляются,
с одной стороны сходство со свойствами спиртов, а с другой
– влияние ароматического кольца на реакционную способность гидроксильной группы и влияние гидроксильной группы на реакционную способность кольца.Слайд 6ФЕНОЛЫ
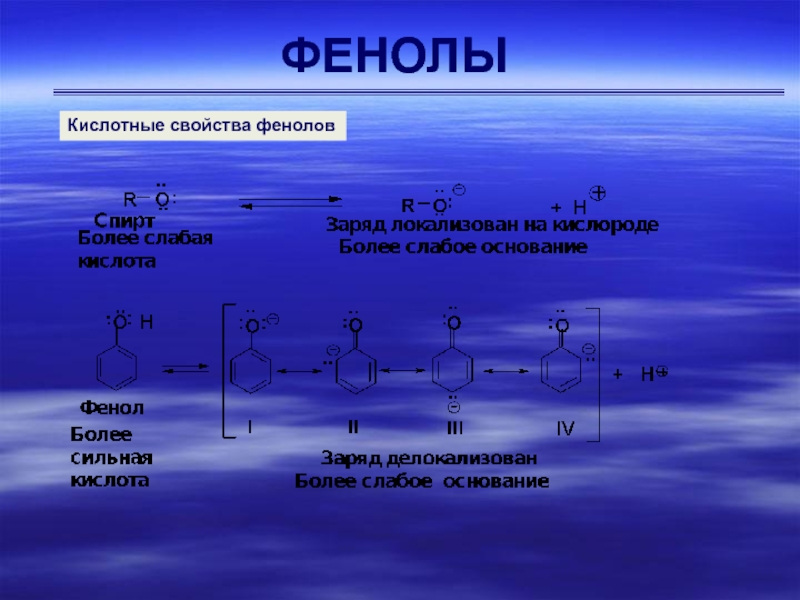
Фенолы более сильные кислоты чем вода (рКа=15,70) и спирты (рКа~16-17),
но значительно более слабые чем карбоновые кислоты (рКа~5). Большинство фенолов
имеют рКа~10. Гидроксигруппа, связанная с ароматическим ядром, является более кислой, чем группа ОН в воде и спирте вследствие делокализации электронной пары фенолят-иона, изображенной с помощью граничных структур II – IVКислотные свойства фенолов
Слайд 10ФЕНОЛЫ
Электроноакцепторные заместители в ароматическом ядре рассредоточивают отрицательный заряд фенолят-иона и
тем самым увеличивают кислотность фенолов, а электронодонорные заместители затруднят делокализацию
отрицательного заряда, способствуют увеличению электронной плотности и таким образом уменьшают кислотность фенолов.Слайд 11ФЕНОЛЫ
Качественная реакция на фенолы.
Образование окрашенных комплексных
соединений с FeCl3:
Фенол -
красно-фиолетовый
Крезол – синий
Резорцин – темно-фиолетовый
Салициловая кислота - красный
Относительно высокая кислотность
фенолов определяется:p-π-сопряжением n-электронов кислорода и π-электронов ароматического
ядра. Заряд делокализуется.
Связь О−Н в феноле более поляризована, т.к. атом О связан с атомом С в
состоянии sp2-гибридизации.
Слайд 12ФЕНОЛЫ
Фенолы и феноксид-ионы – нуклеофильные реагенты
Химические свойства
О-алкилирование фенолов
Фенолы
как нуклеофилы не реагируют даже с самыми реакционноспособными галогеналканами. Феноксид-ион
реагирует с галогеналканами, алкилсульфатами, способными вступать в реакции SN2, с образованием простых эфиров (реакция Вильямсона).
Слайд 13ФЕНОЛЫ
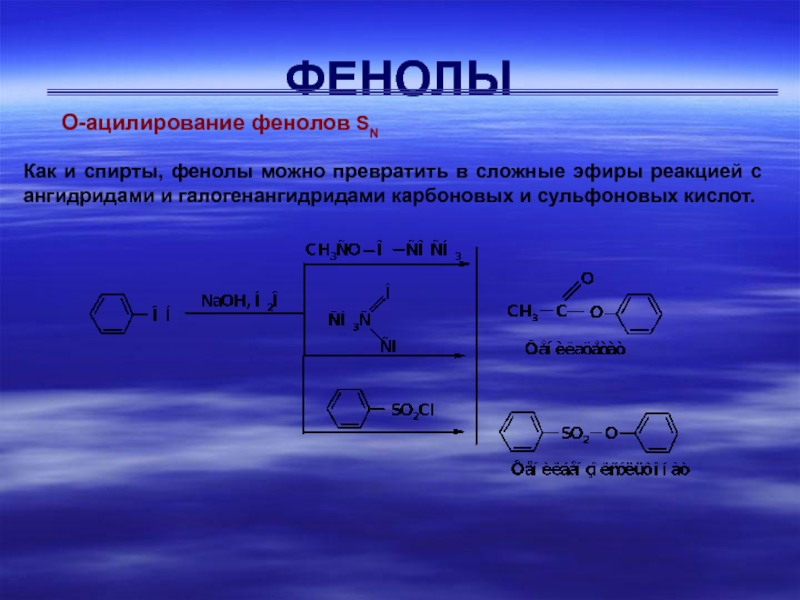
О-ацилирование фенолов SN
Как и спирты, фенолы можно превратить в сложные
эфиры реакцией с ангидридами и галогенангидридами карбоновых и сульфоновых кислот.
Слайд 15ФЕНОЛЫ
О-ацилирование фенолов SN
Перегруппировка Фриса
Перегруппировка может протекать как по внутримолекулярному, так
и по межмолекулярному пути и включает стадию генерации ацилий-иона RCO+,
который далее атакует кольцо по обычной схеме ацилирования.Слайд 16ФЕНОЛЫ
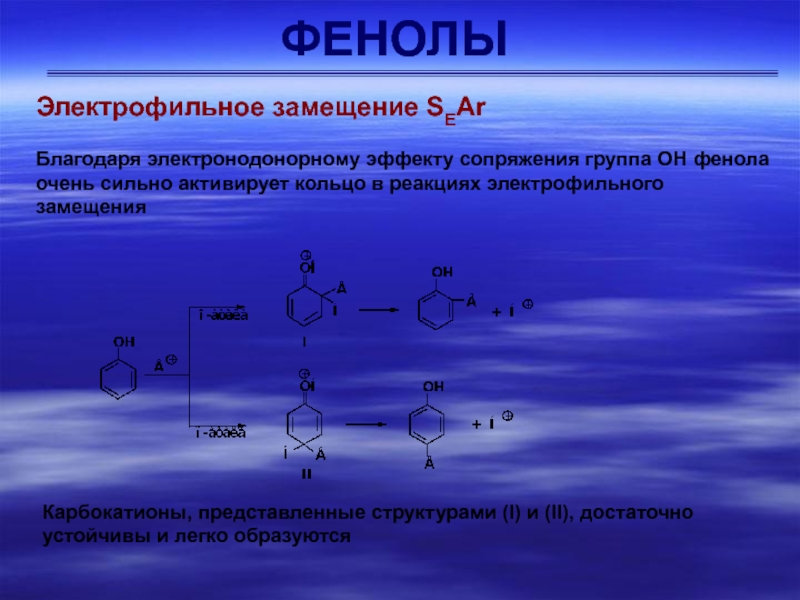
Электрофильное замещение SEAr
Благодаря электронодонорному эффекту сопряжения группа ОН фенола очень
сильно активирует кольцо в реакциях электрофильного замещения
Карбокатионы, представленные структурами
(I) и (II), достаточно устойчивы и легко образуются Слайд 17ФЕНОЛЫ
Электрофильное замещение SEAr
В том случае, если атаке электрофила подвергается фенолят-ион
С6Н5О, промежуточный σ-комплекс представляет собой нейтральную частицу (III) или (IV),
еще более устойчивую и еще быстрее образующуюсяСлайд 18ФЕНОЛЫ
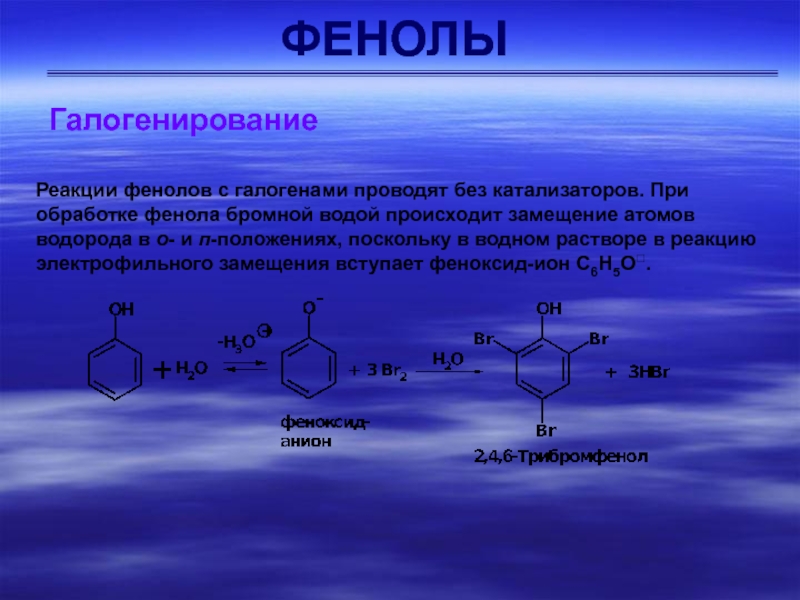
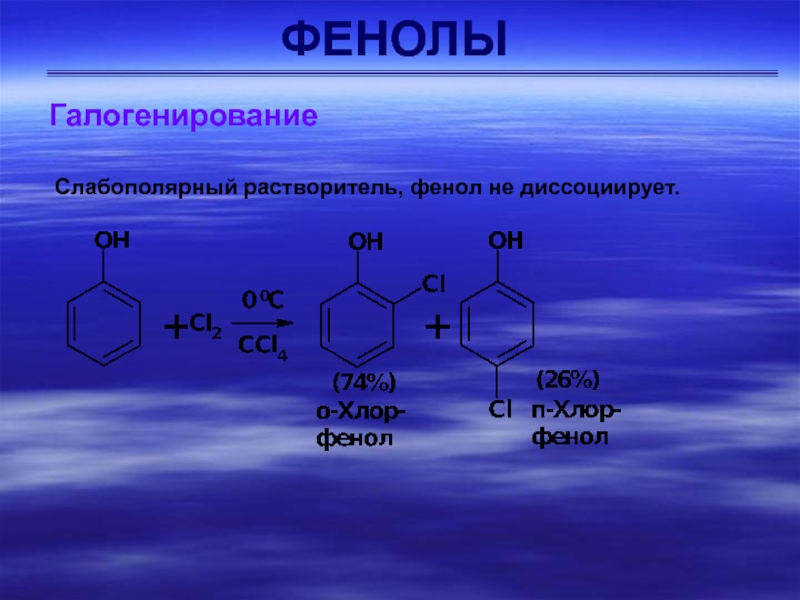
Галогенирование
Реакции фенолов с галогенами проводят без катализаторов. При обработке
фенола бромной водой происходит замещение атомов водорода в о- и
п-положениях, поскольку в водном растворе в реакцию электрофильного замещения вступает феноксид-ион С6Н5О.Слайд 22ФЕНОЛЫ
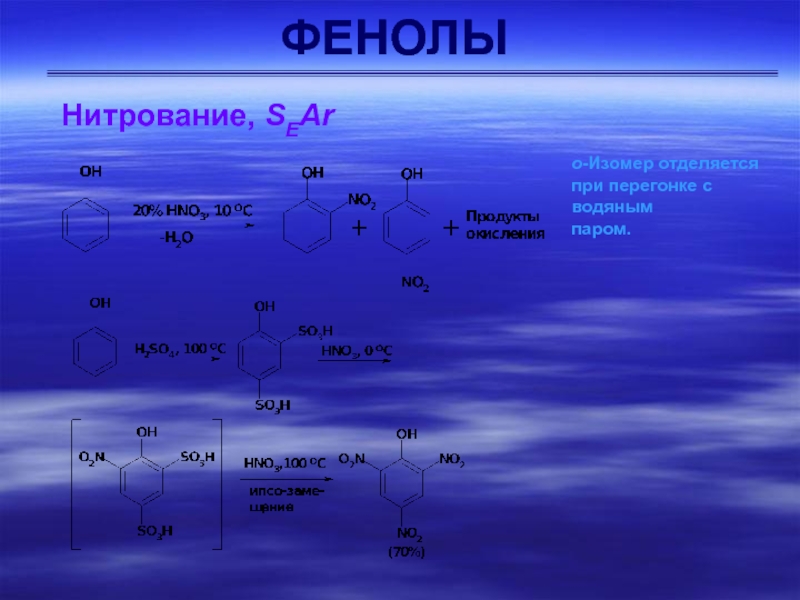
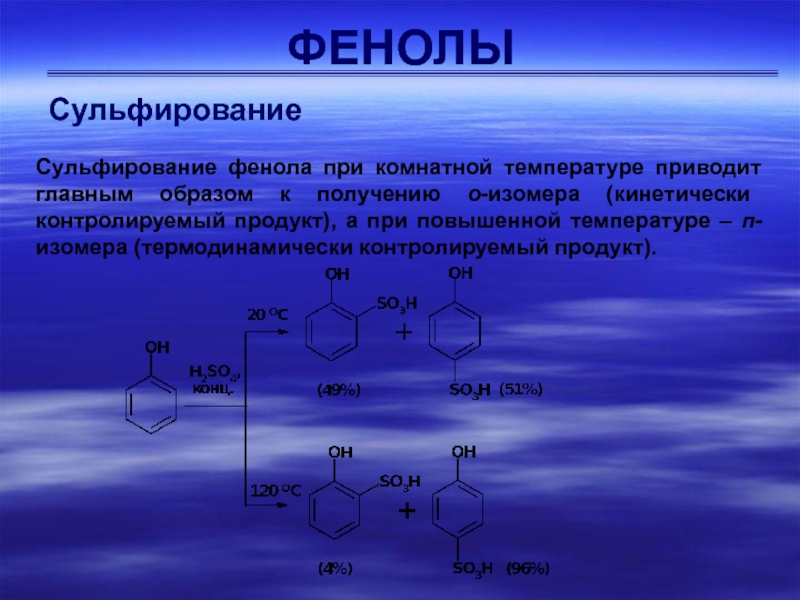
Сульфирование
Сульфирование фенола при комнатной температуре приводит главным образом к
получению о-изомера (кинетически контролируемый продукт), а при повышенной температуре –
п-изомера (термодинамически контролируемый продукт).Слайд 23ФЕНОЛЫ
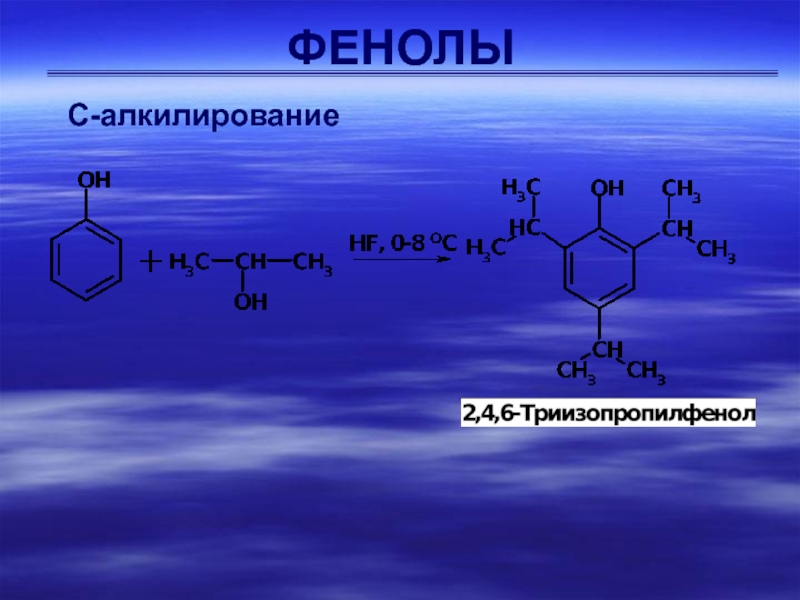
С-алкилирование
Фенолы легко подвергаются алкилированию в ядро. Наиболее часто для
алкилирования используют спирты или алкены в присутствии протонных кислот (Н2SO4,
Н3РO4).применяется в качестве антиоксиданта в производстве пищевых продуктов (пищевая добавка E321), смазочных масел, каучуков, пластмасс и др
Слайд 25ФЕНОЛЫ
С-ацилирование
Реакции Фриделя-Крафтса в присутствии хлорида алюминия с фенолом не
проводят. Причиной этого служат комплексообра-зование АlСlз по гидроксильной группе и
потеря каталитической активности катализатора.обработка фенола уксусной кислотой в присутствии ВF3 дает
п-гидроксиацетофенон с выходом, близким к количественному
Слайд 26ФЕНОЛЫ
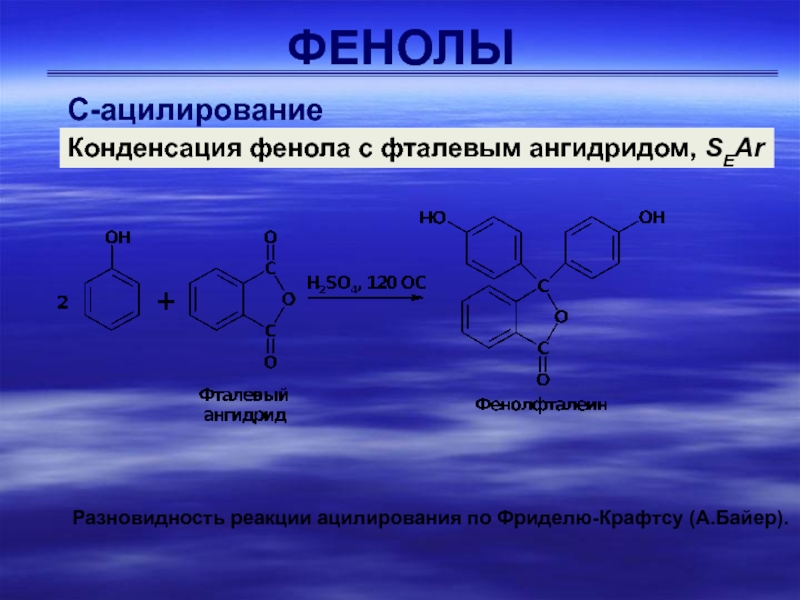
С-ацилирование
Конденсация фенола с фталевым ангидридом, SEAr
Разновидность реакции ацилирования по
Фриделю-Крафтсу (А.Байер).
Слайд 28ФЕНОЛЫ
Реакция с формальдегидом.
Фенолформальдегидные смолы
К числу старейших синтетических полимеров
относятся полимеры, образующиеся при реакции фенола с формальдегидом в присутствии
щелочи или кислоты. При кислотном катализе атакующей электрофильной частицей является карбокатион, возникающий при протонировании карбонильного соединения. Первая стадия реакции может трактоваться как электрофильное замещение в кольце под действием электронодефицитного атома углерода формальдегида.Слайд 29ФЕНОЛЫ
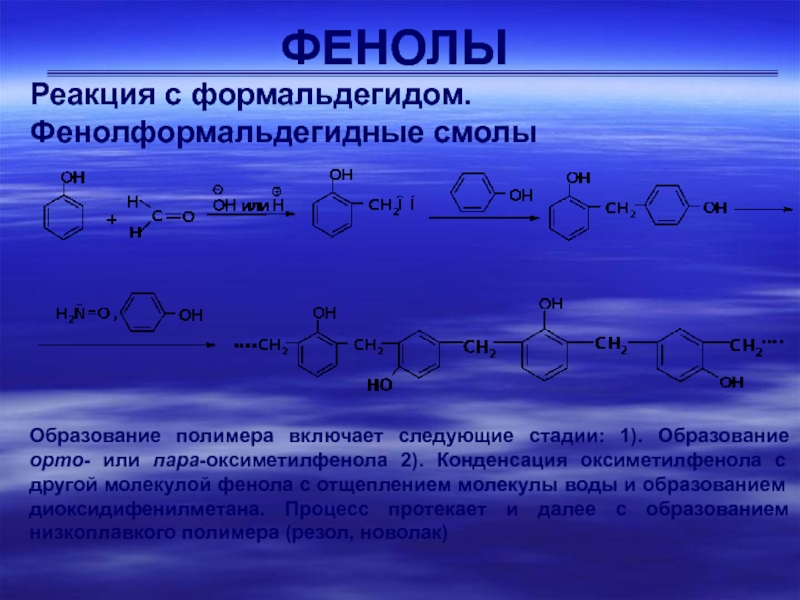
Реакция с формальдегидом.
Фенолформальдегидные смолы
Образование полимера включает следующие стадии:
1). Образование орто- или пара-оксиметилфенола 2). Конденсация оксиметилфенола с другой
молекулой фенола с отщеплением молекулы воды и образованием диоксидифенилметана. Процесс протекает и далее с образованием низкоплавкого полимера (резол, новолак)Слайд 30ФЕНОЛЫ
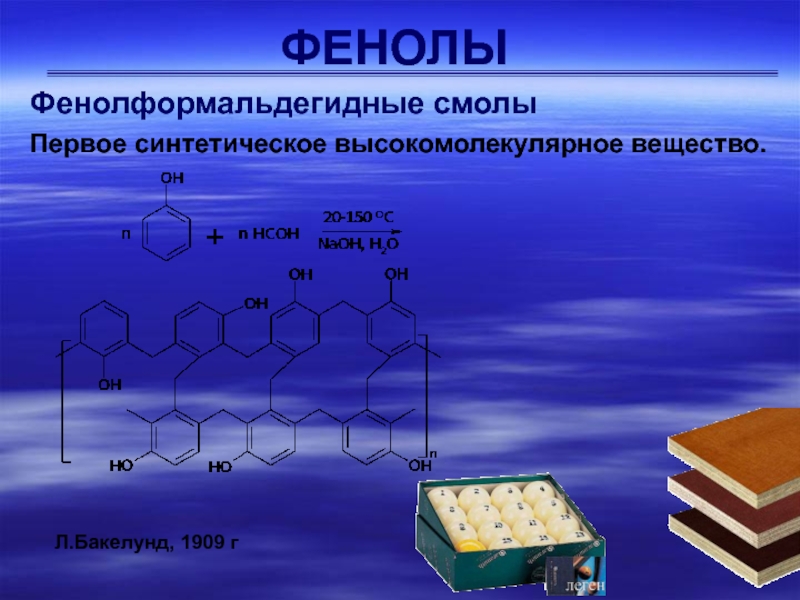
Фенолформальдегидные смолы
Первое синтетическое высокомолекулярное вещество.
Л.Бакелунд, 1909 г
Слайд 31ФЕНОЛЫ
Электрофильное замещение в феноксид-ионе
Реакция Кольбе
Двуокись углерода реагирует с фенолятом
натрия при температуре 125 оС, образуя натриевую соль о-оксибензойной (салициловой)
кислотыДиоксид углерода является электрофильным агентом, реакция протекает по механизму SEAr. Салициловую кислоту и ряд ее производных применяют в качестве лекарственных препаратов (аспирин, салол и др.).
Слайд 34ФЕНОЛЫ
Реакция Реймера-Тимана
Обработка фенола хлороформом и водной щелочью приводит к
введению альдегидной группы –СНО в ароматическое кольцо в орто-положение к
–ОН-группеВначале образуется замещенный бензальхлорид, который далее гидролизуется в щелочной среде
Слайд 35ФЕНОЛЫ
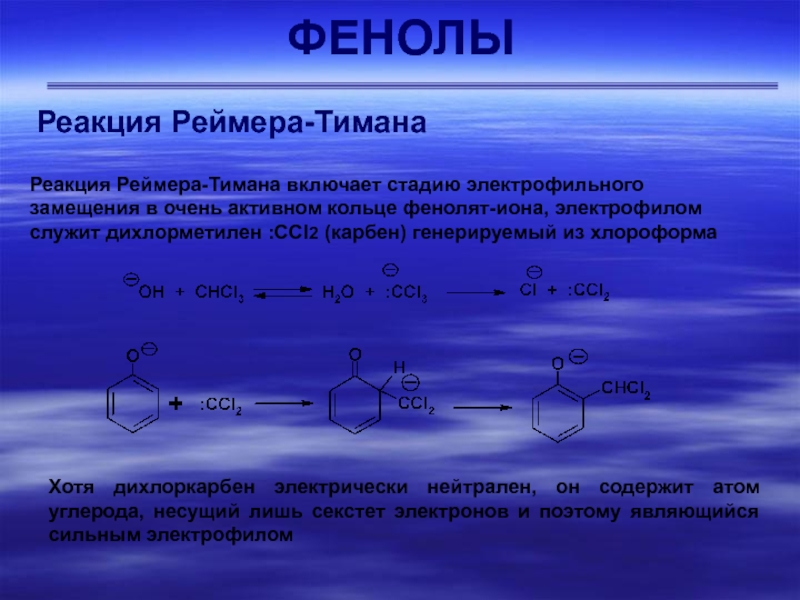
Реакция Реймера-Тимана
Реакция Реймера-Тимана включает стадию электрофильного замещения в очень
активном кольце фенолят-иона, электрофилом служит дихлорметилен :СCl2 (карбен) генерируемый из
хлороформаХотя дихлоркарбен электрически нейтрален, он содержит атом углерода, несущий лишь секстет электронов и поэтому являющийся сильным электрофилом
Слайд 36ФЕНОЛЫ
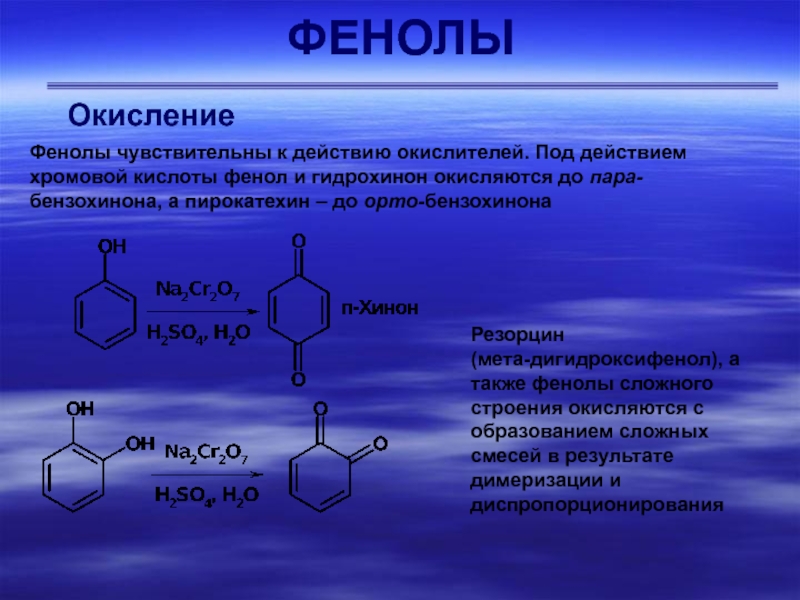
Окисление
Фенолы чувствительны к действию окислителей. Под действием хромовой кислоты
фенол и гидрохинон окисляются до пара-бензохинона, а пирокатехин – до
орто-бензохинонаРезорцин
(мета-дигидроксифенол), а также фенолы сложного строения окисляются с образованием сложных смесей в результате димеризации и диспропорционирования
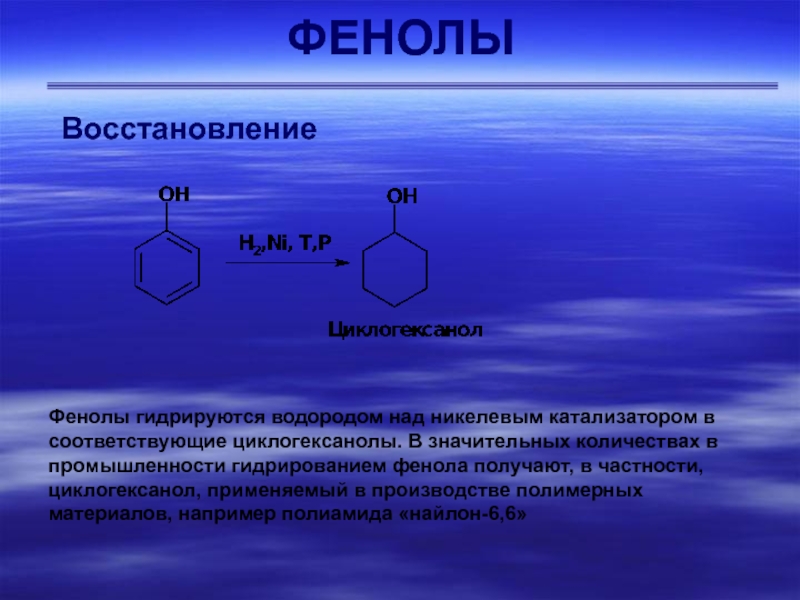
Слайд 37ФЕНОЛЫ
Окисление
Фенолы, содержащие разветвленные алкильные группы в орто-положении к группе
ОН, применят в качестве антиоксидантов, стабилизаторов полимерных материалов. Такие фенолы
легко образуют очень устойчивые (малореакционноспособные) радикалы, вызывая тем самым обрыв радикально-цепных окислительных реакций