Слайд 1Физическая химия
Тема 1
Учение об агрегатных состояниях вещества.
Газообразное состояние
Слайд 21. Учение об агрегатных состояниях
Основные формы, в которых существует вещество,
называют агрегатными или фазовыми состояниями.
Агрегатное состояние вещества – форма существования
вещества, зависящая от расстояния между частицами и взаимодействия между ними.
Газообразное, жидкое, твердое, плазма
Для большинства веществ существуют три основных состояния, переход между которыми осуществляется при изменении температуры: газ, жидкость, твёрдое.
Слайд 31. Учение об агрегатных состояниях
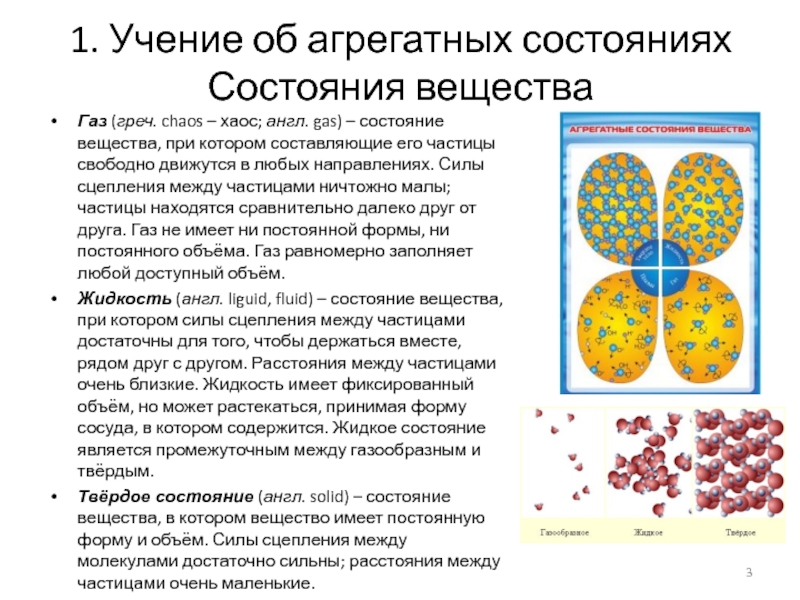
Состояния вещества
Газ (греч. chaos – хаос;
англ. gas) – состояние вещества, при котором составляющие его частицы
свободно движутся в любых направлениях. Силы сцепления между частицами ничтожно малы; частицы находятся сравнительно далеко друг от друга. Газ не имеет ни постоянной формы, ни постоянного объёма. Газ равномерно заполняет любой доступный объём.
Жидкость (англ. liguid, fluid) – состояние вещества, при котором силы сцепления между частицами достаточны для того, чтобы держаться вместе, рядом друг с другом. Расстояния между частицами очень близкие. Жидкость имеет фиксированный объём, но может растекаться, принимая форму сосуда, в котором содержится. Жидкое состояние является промежуточным между газообразным и твёрдым.
Твёрдое состояние (англ. solid) – состояние вещества, в котором вещество имеет постоянную форму и объём. Силы сцепления между молекулами достаточно сильны; расстояния между частицами очень маленькие.
Слайд 41. Учение об агрегатных состояниях
Слайд 51. Учение об агрегатных состояниях
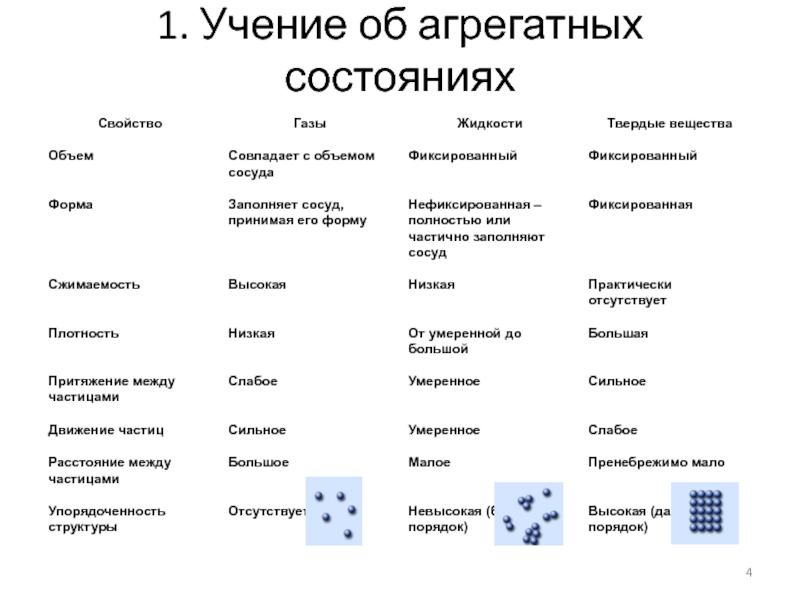
Для любого вещества существует одна форма
газообразного состояния и одна форма жидкого состояния
Твердому состоянию вещества могут
отвечать несколько форм (модификаций), отличающихся по строению и свойствам – полиморфизм.
Полиморфные состояния простых веществ называются аллотропными модификациями.
Твёрдое и жидкое состояние называют конденсированным состоянием
Слайд 61. Учение об агрегатных состояниях
1.1 Параметры состояния вещества
Давлением p газа,
жидкости или твердого тела, т.е. среды или вещества, называют силу,
равномерно действующую на площадь поверхности
В системе SI единицей измерения давления является паскаль, Па, Pa
Атмосферное давление над уровнем моря равно 10⁵ Па (100 кПа)
Другие единицы измерения давления: атмосфера (атм), бар (бар), мм ртутного столба (мм рт. ст. , мм Hg, торр), мм водяного столба (мм вод. ст., мм Н₂O), фунт на квадратный дюйм (PSI – pounds per square inch)
Слайд 71. Учение об агрегатных состояниях
1.1 Параметры состояния вещества
Давление окружающей среды,
например, атмосферного воздуха, называется барометрическим (рб или ратм); измеряют прибором,
называемым барометром
Давление выше барометрического называют избыточным или манометрическим (ризб, рман); измеряют прибором, называемым манометром
Давление ниже барометрического называют вакуумом или разрежением (рвак); измеряют прибором, называемым вакуумметром
Слайд 81. Учение об агрегатных состояниях
1.1 Параметры состояния вещества
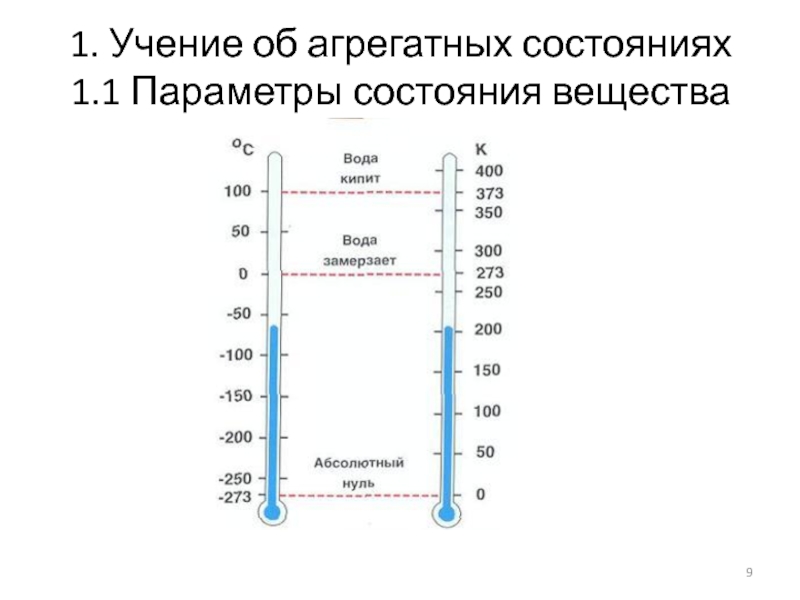
Температура - мера
нагретости тела.
Температура - показатель величины кинетической энергии молекул; молекулы движутся
тем быстрее, чем выше температура, и всякое движение прекращается при абсолютном нуле.
В международной практике применяют две температурные шкалы: термодинамическую и международную
NB! Разность температур в шкалах Цельсия и Кельвина всегда одна и та же.
Слайд 91. Учение об агрегатных состояниях
1.1 Параметры состояния вещества
Слайд 101. Учение об агрегатных состояниях
1.1 Параметры состояния вещества
Удельным объёмом вещества
называют объём единицы массы
Плотность вещества – это масса единицы объёма
Нетрудно
заметить, что
Количество вещества
Нормальные физические условия:
давление р = 101325 Па = 760 мм рт. ст. = 1 атм
температура t = 0⁰С; Т = 273К
Слайд 111. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Идеальный газ:
частицы
газа (атомы, молекулы, ионы) принимаются за материальные точки (т.е. не
имеют объема)
между частицами отсутствуют силы взаимного притяжения (межмолекулярные силы)
взаимодействие между молекулами сводится к абсолютно упругим ударам (т.е. ударам, при которых кинетическая энергия полностью переносится с одного объекта на другой)
Реальный газ:
частицы газа (атомы, молекулы, ионы) имеют объем
частицы газа связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между частицами
соударения между молекулами не являются абсолютно упругими
Реальный газ похож на идеальный при сильном разрежении и при обычных температурах
Слайд 121. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Газовые законы
Состояние газа
полностью характеризуется его температурой, давлением, объемом, массой и молярной массой.
Уравнение
состояния идеального газа (уравнение Менделеева-Клапейрона) – соотношение, связывающее между собой значения давления, объема и температуры:
R - универсальная газовая постоянная, равная 8,314 Дж/(моль·К)
Газ, подчиняющийся этому закону, называется идеальным.
Слайд 131. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Закон Бойля-Мариотта
При постоянной
температуре и массе объем газа обратно пропорционален его давлению
Закон описывает
изотермический процесс
Слайд 141. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Закон Гей-Люссака
Объем данной
массы газа при постоянном давлении прямо пропорционален абсолютной температуре
Закон описывает
изобарный процесс
Слайд 151. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Закон Шарля
Давление данной
массы газа при постоянном объеме прямо пропорционально абсолютной температуре
Закон описывает
изохорный процесс
Слайд 161. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Уравнение Клапейрона или
объединенный газовый закон
Объединяет три предыдущих частных закона
Это уравнение часто применяют
для приведения объема к нормальным условиям, т. е. для определения объема, занимаемого газом при t = 0°С и Р = 760 мм рт. ст., если объем его при каких-либо значениях Р и t известен.
Для этого случая уравнение обычно представляют в следующем виде:
В этом уравнении индексом «0» обозначены параметры газа при нормальных условиях, а индексом «1» - при произвольных условиях.
Слайд 171. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Смеси идеальных газов
Подчиняются
тем же законам, что и чистые газы
Компоненты смеси – газы,
составляющие смесь
Парциальное (частичное) давление компонента смеси – это то давление, которое оказывал бы данный компонент, если бы он один занимал весь объем при температуре смеси (т.е. при отсутствии других компонентов газа)
Закон Дальтона: сумма парциальных давлений компонентов равна общему давлению смеси газов
, следовательно
Слайд 181. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Кинетическая теория газов
Молекулярно-кинетическая
теория (МКТ). Р. Клаузиус
Основные положения:
Молекулы – материальные точки с определенной
массой. Размеры молекул ничтожно малы по сравнению с расстоянием между ними.
Молекулы газа находятся в состоянии непрерывного и беспорядочного движения. Между столкновениями они движутся прямолинейно. Движение равновероятно по всем направлениям.
Между молекулами нет ни сил притяжения, ни сил отталкивания. При столкновении молекулы ведут себя, как упругие шары.
Средняя кинетическая энергия газа пропорциональна его температуре. Скорости молекул могут быть любыми: от 0 до ∞.
Слайд 191. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Идеальные газы обладают
одинаковым мольным объемом.
При н. у. =
22,4140
При других температурах и давлениях эта величина будет другой!
Слайд 201. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Реальные газы
Не подчиняются
законам идеальных газов. Основными причинами отклонений являются взаимное притяжение молекул
газа и наличие у них собственного объема
Характеристикой отклонений может служить мольный объем
Слайд 211. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
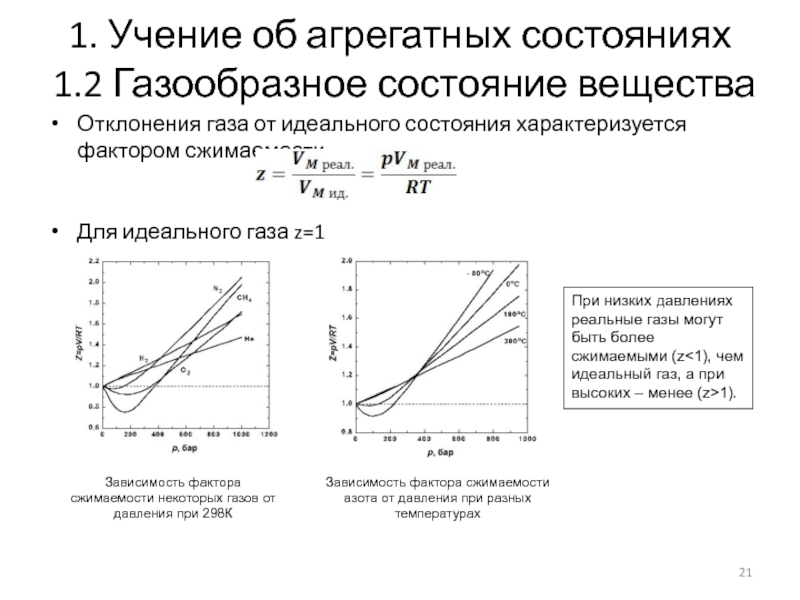
Отклонения газа от
идеального состояния характеризуется фактором сжимаемости
Для идеального газа z=1
Зависимость фактора
сжимаемости азота от давления при разных температурах
Зависимость фактора сжимаемости некоторых газов от давления при 298К
При низких давлениях реальные газы могут быть более сжимаемыми (z<1), чем идеальный газ, а при высоких – менее (z>1).
Слайд 221. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Реальные газы не
подчиняются уравнению Менделеева –Клапейрона.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса)
для одного
моля
для n молей
а – учитывает межмолекулярные взаимодействия;
b – учитывает собственный объем молекул.
Коэффициенты а и b для разных газов различны, поэтому уравнение Ван-дер-Ваальса не является универсальным.
При низких давлениях и высоких температурах уравнение Ван-дер-Ваальса переходит в уравнение состояния идеального газа.
Слайд 231. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Уравнение Диттеричи
Вириальное уравнение
или уравнение с вириальными коэффициентами
B, C, D и т.д. –
второй, третий, четвертый и т.д. вириальные коэффициенты. Они зависят от природы газа, температуры и вычисляются из экспериментальных значений p, V, T.
В большинстве случаев используют уравнение только со вторым вириальным коэффициентом.
Слайд 241. Учение об агрегатных состояниях
1.2 Газообразное состояние вещества
Наибольшее применение в
технологических расчетах получило уравнение состояния реальных газов
где z – коэффициент
сжимаемости газа