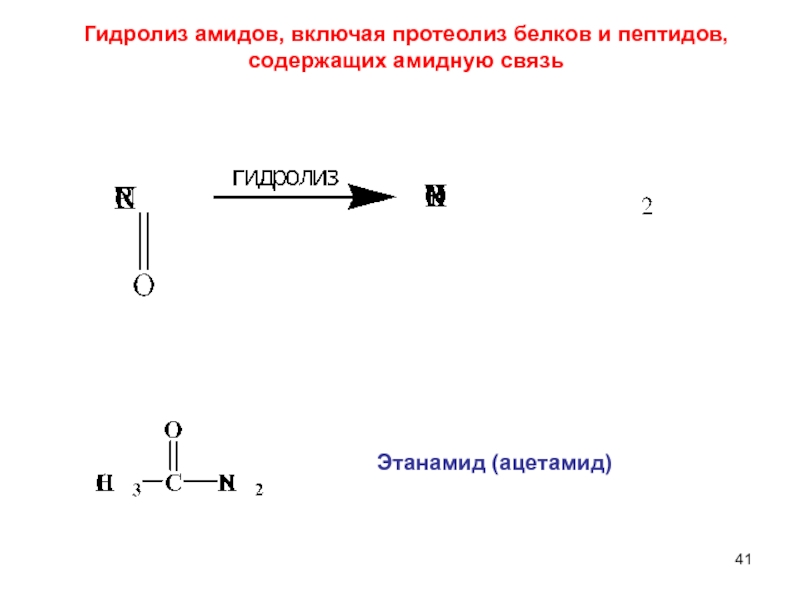
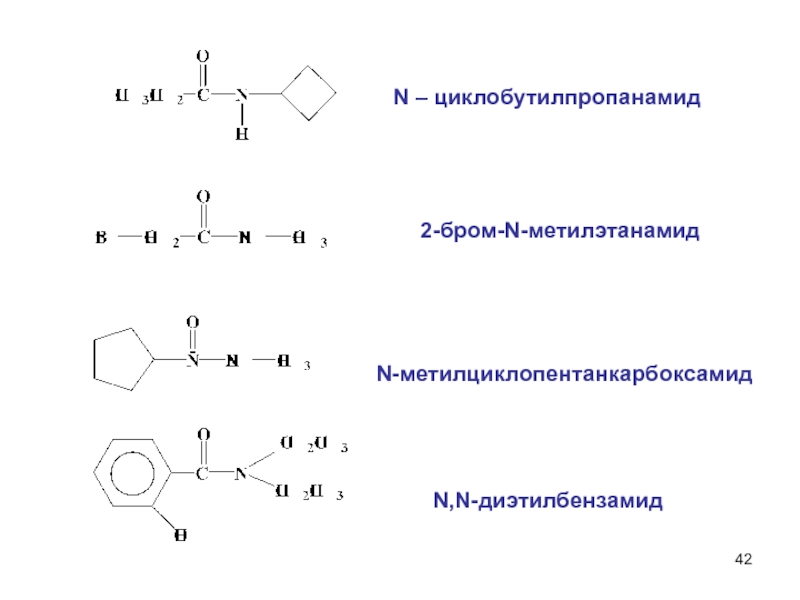
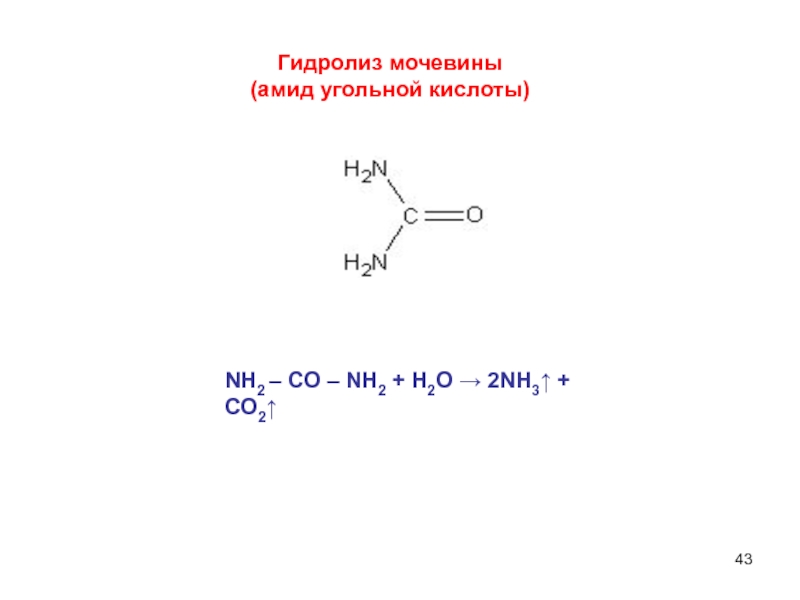
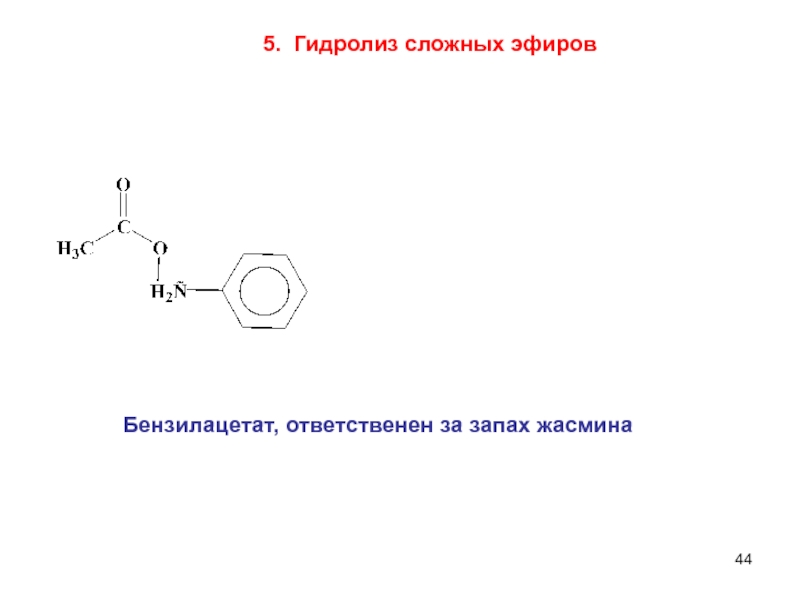
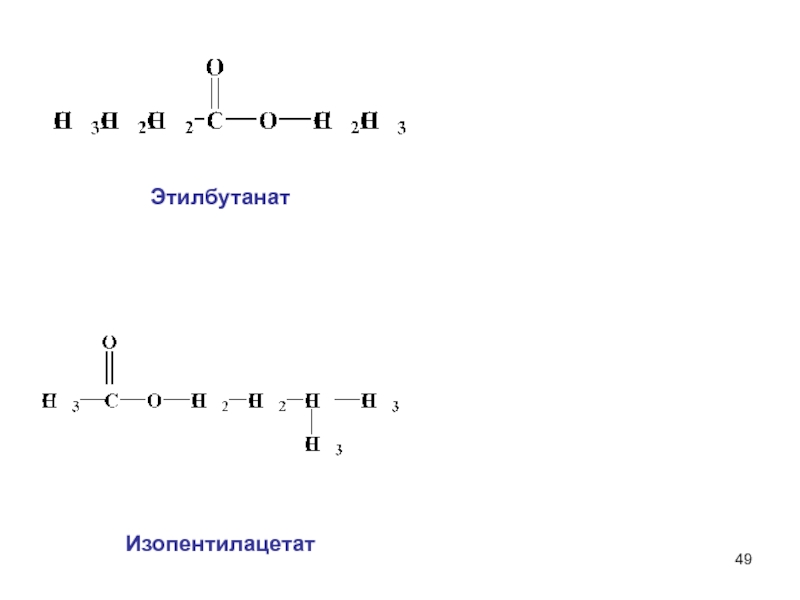
составными частями воды (Н+ и ОН–).
Причина-образование малодиссоциированных
соединений (слабых электролитов)Следствие – сдвиг равновесия диссоциации (ионизации) воды, который сопровождается изменением кислотности среды вследствие накопления Н+ или ОН– ионов.







![1
Домножим числитель и знаменатель на [H+]:Значение Кг показывает, что в момент равновесия произведение концентраций](/img/thumbs/1dc467b4669221236e564ad7ee972873-800x.jpg)
![1
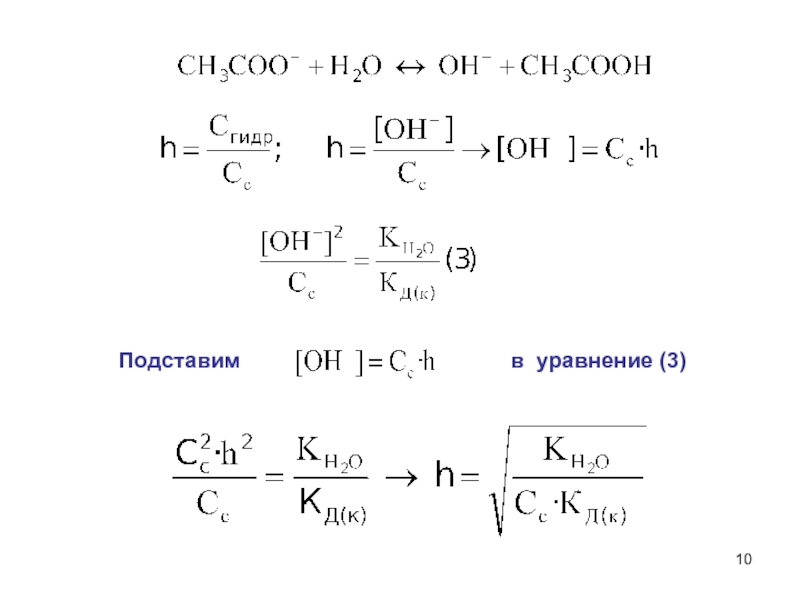
Приравнивая формулы (1) и (2), получим:[OH-]=[CH3COOH] Вывод степени гидролиза h](/img/thumbs/872f568a48889d5872030efbd473e549-800x.jpg)
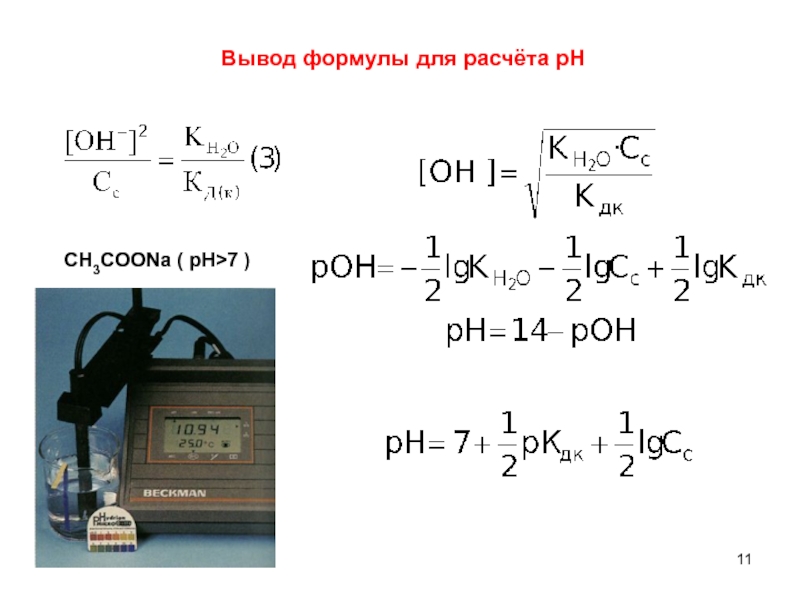 7 )" alt="Вывод формулы для расчёта pHCH3COONa ( рН>7 )">
7 )" alt="Вывод формулы для расчёта pHCH3COONa ( рН>7 )">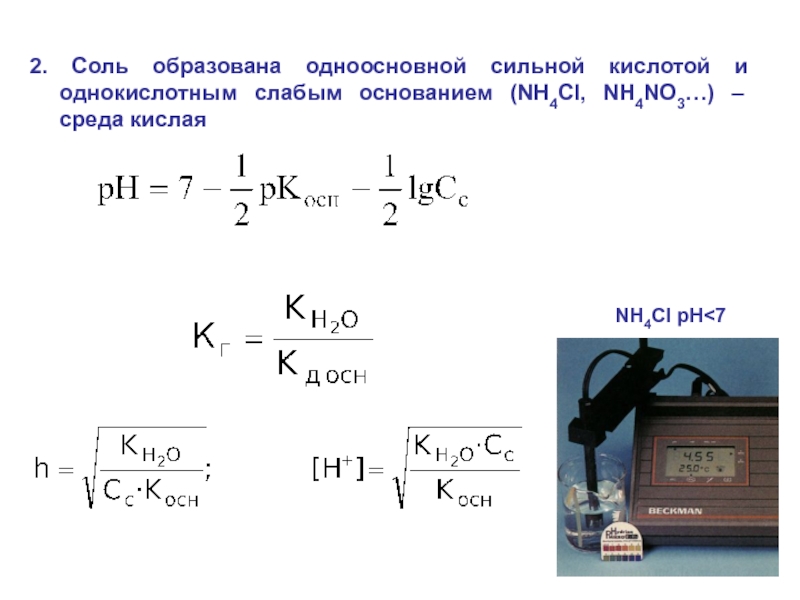

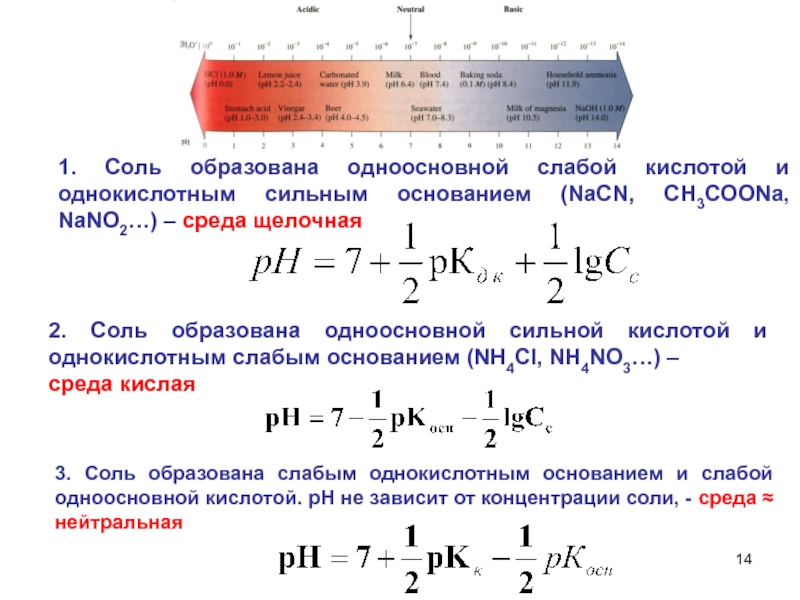
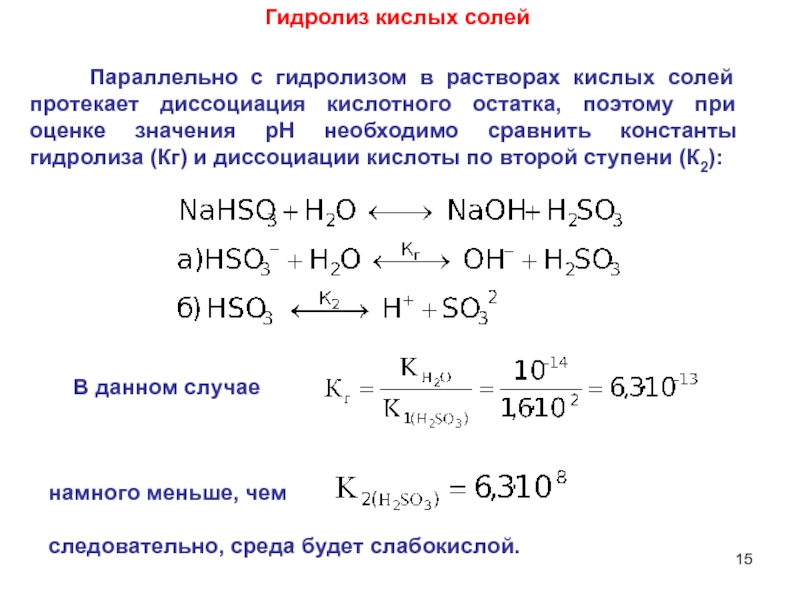


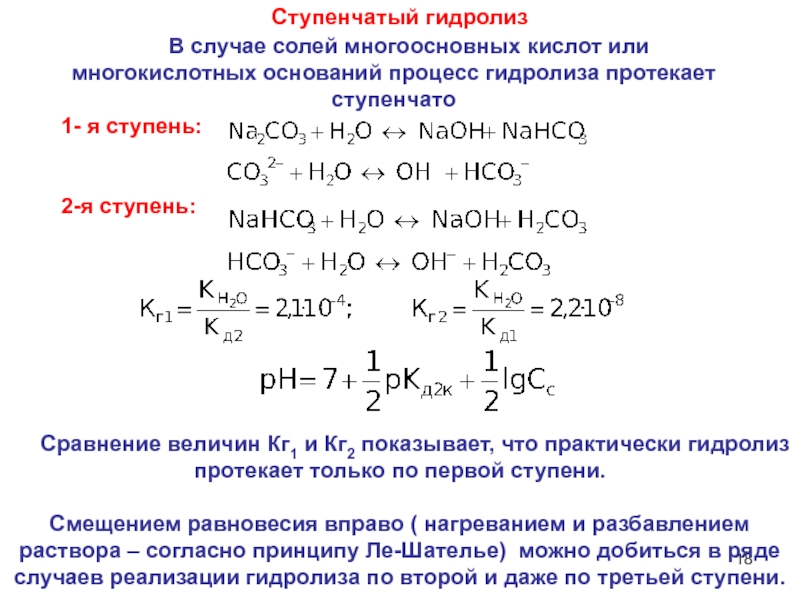

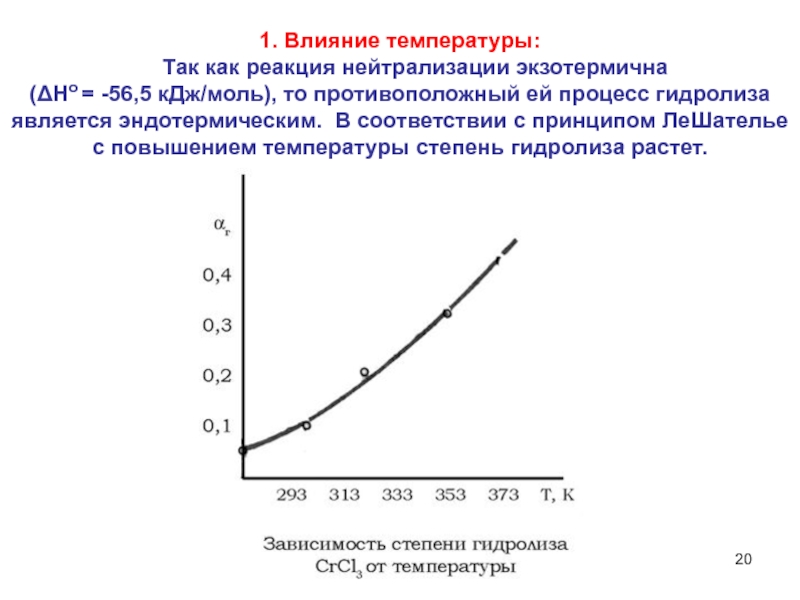
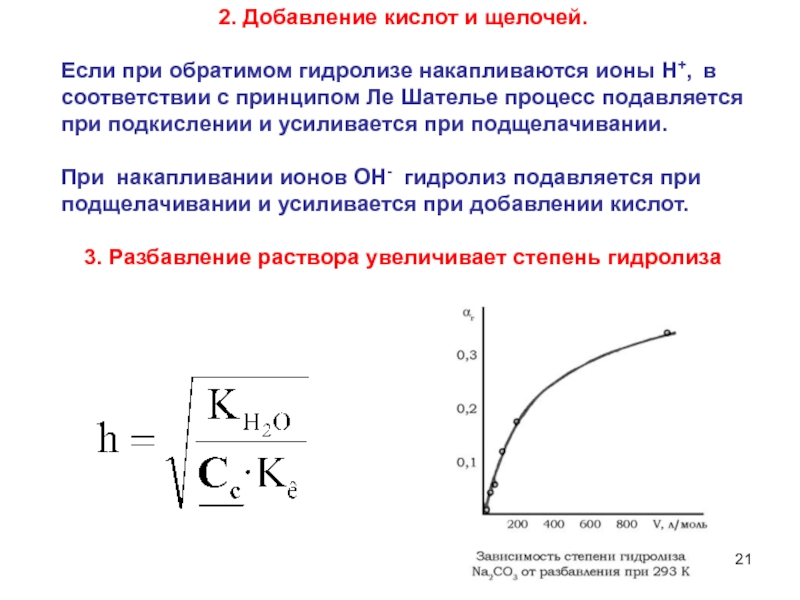




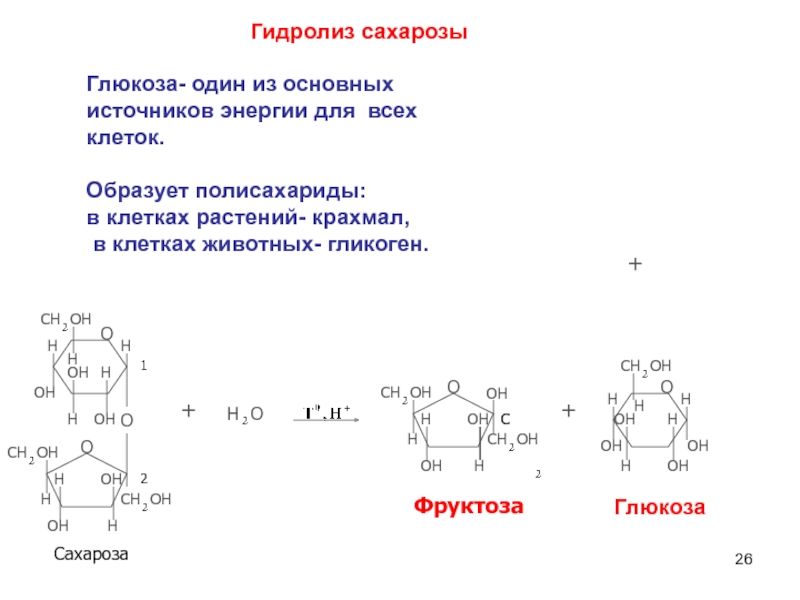


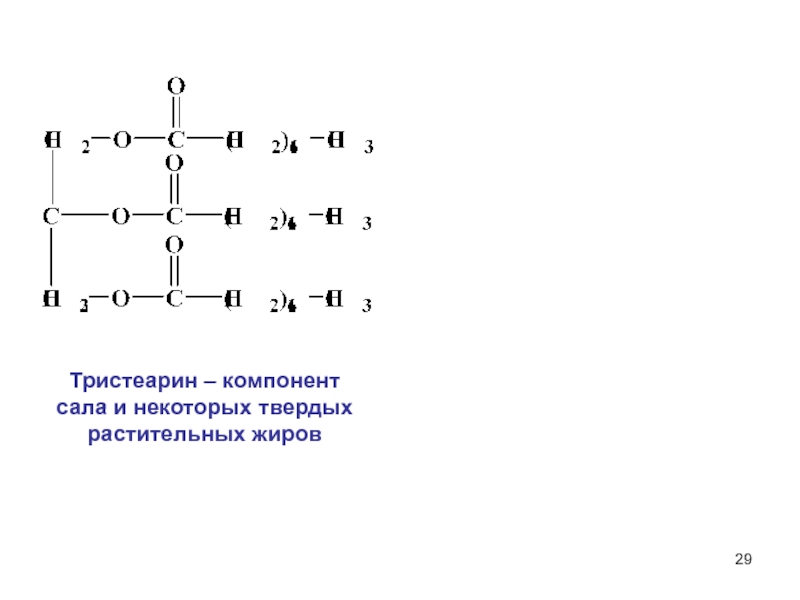

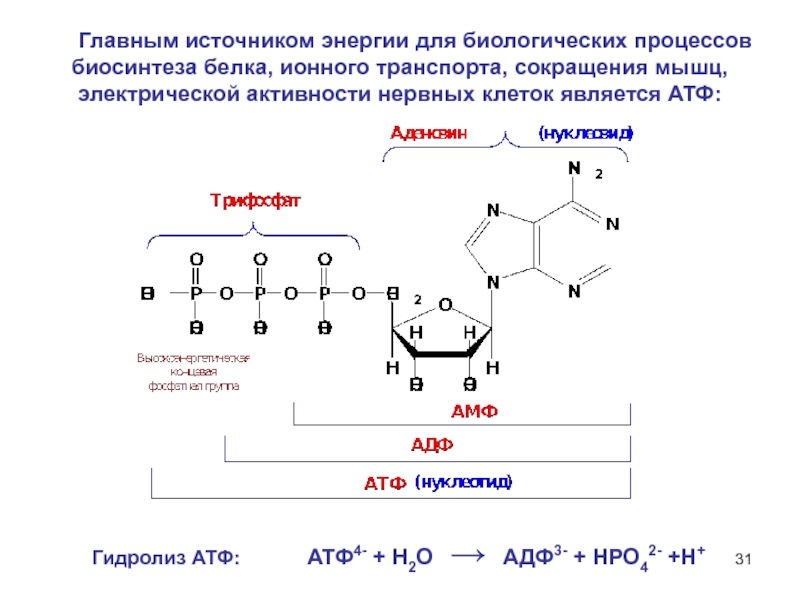
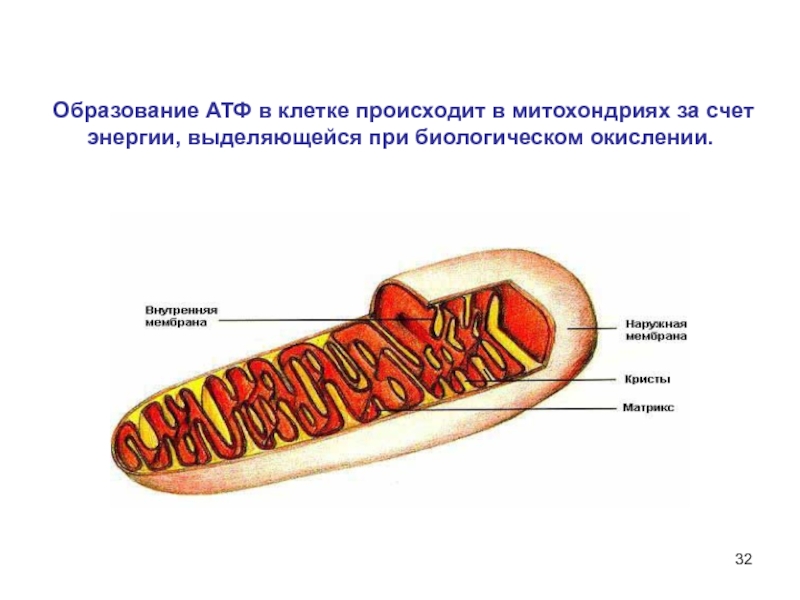
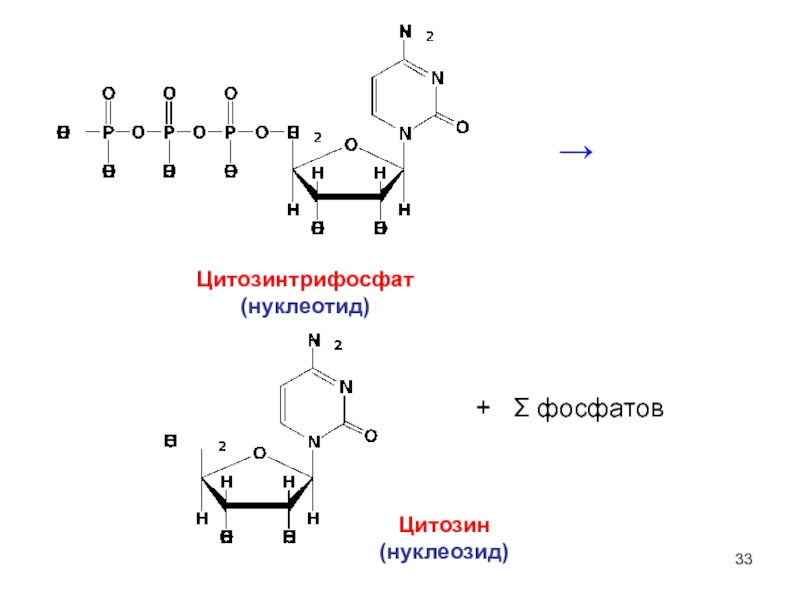
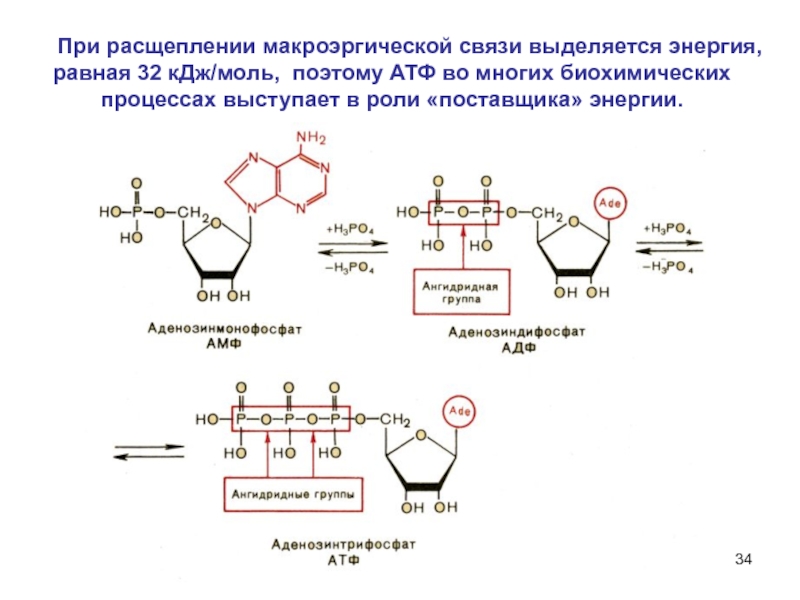

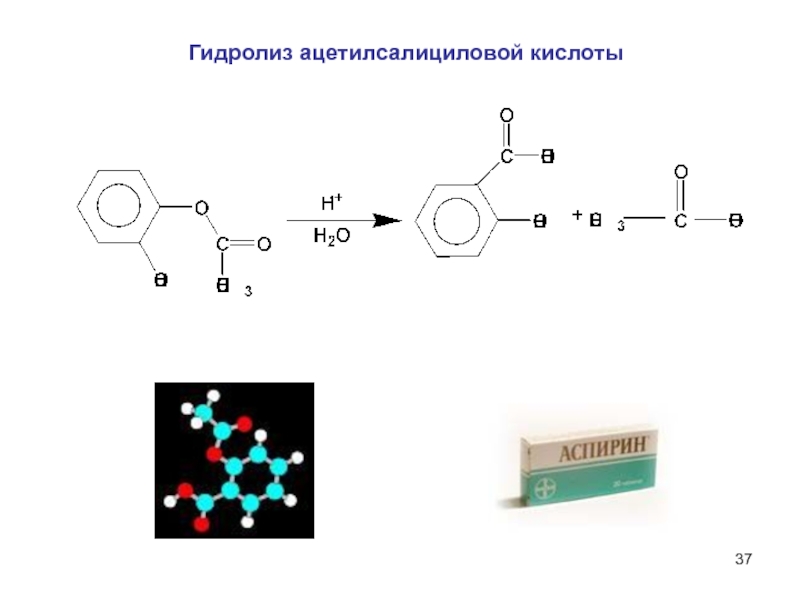
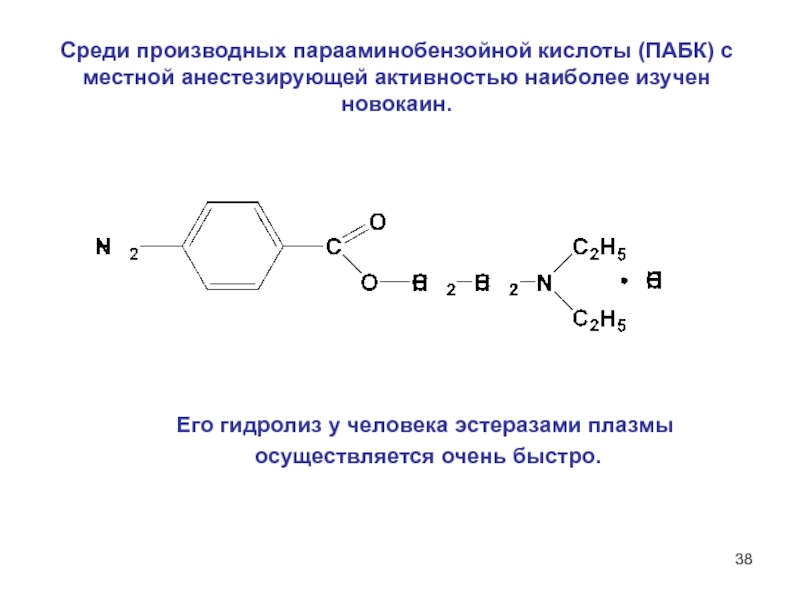
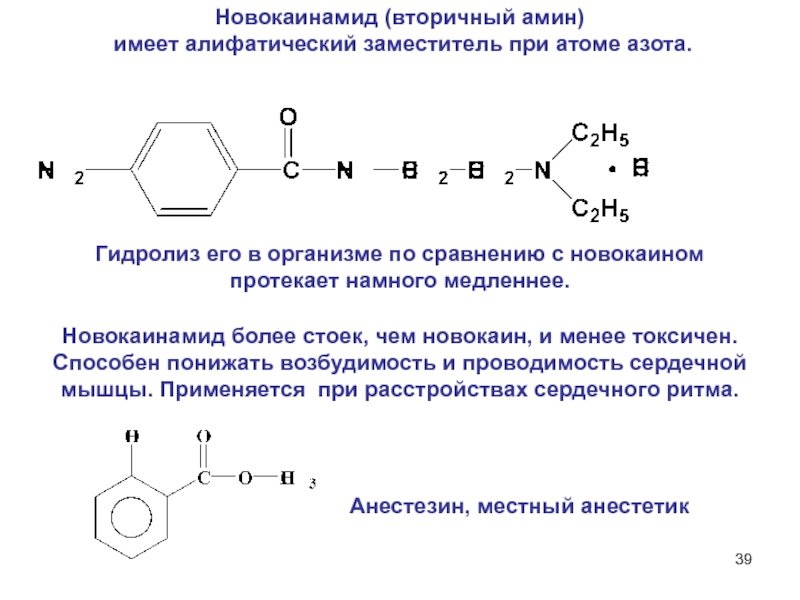
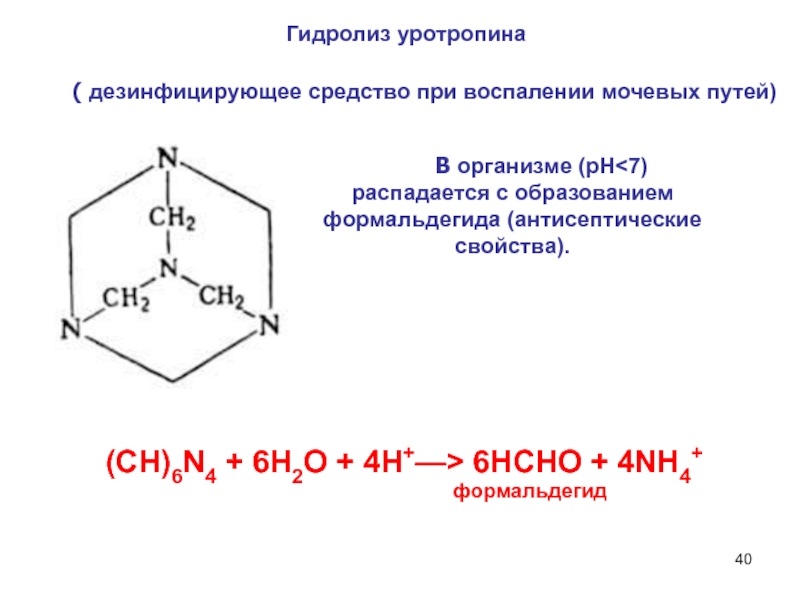 6НСНО + 4NH4+" alt="(CH)6N4 + 6Н2О + 4H+—> 6НСНО + 4NH4+">
6НСНО + 4NH4+" alt="(CH)6N4 + 6Н2О + 4H+—> 6НСНО + 4NH4+">