рассматривать как слабую
кислоту или слабое основание.
С. Аррениус
Ионное произведение
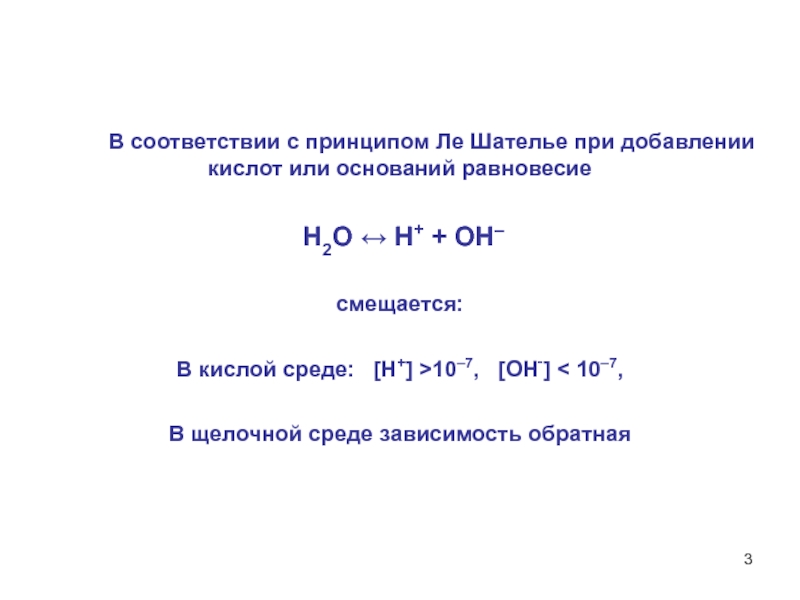
водыВода в малой степени ионизирована по уравнению:
H2O H+ + OH–.
Константа диссоциации Кдисс, в соответствии с законом действующих масс, выразится уравнением:







![1
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ
Имеющую огромное значение для химии чистую Расчет рН в сильных электролитахСильные: Рассчитать рН, рОН, [OH-] для 0,001 Расчет рН в сильных электролитахСильные: Рассчитать рН, рОН, [OH-] для 0,001 м НNO3рН = 14 - рОНрОН](/img/thumbs/ebad4bbcc0a8d6314151b7c651b41b80-800x.jpg)

![1
КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ
Имеющую огромное значение для химии чистую Расчет [ Н+] и рН для растворов слабых электролитовКислоты Смесь кислот Расчет [ Н+] и рН для растворов слабых электролитовКислоты Смесь кислот](/img/thumbs/6508ba2942e7b849793cac2fc8446068-800x.jpg)