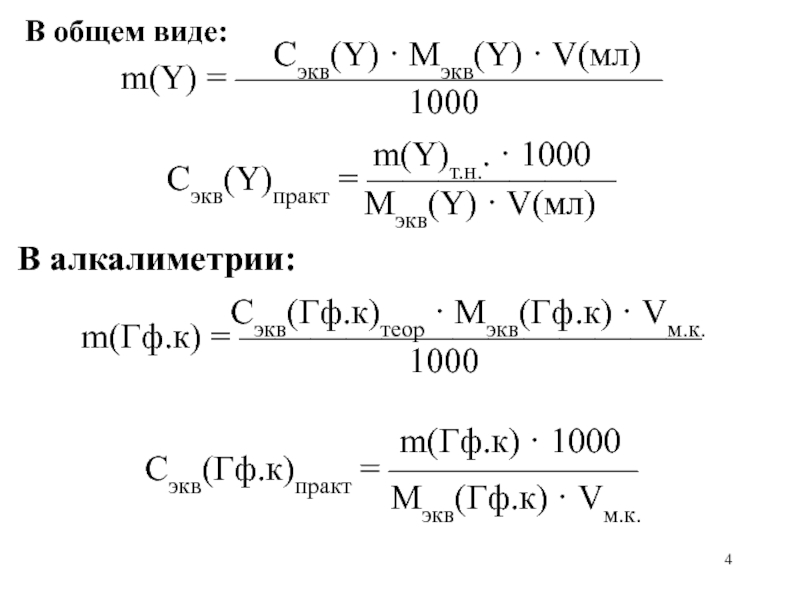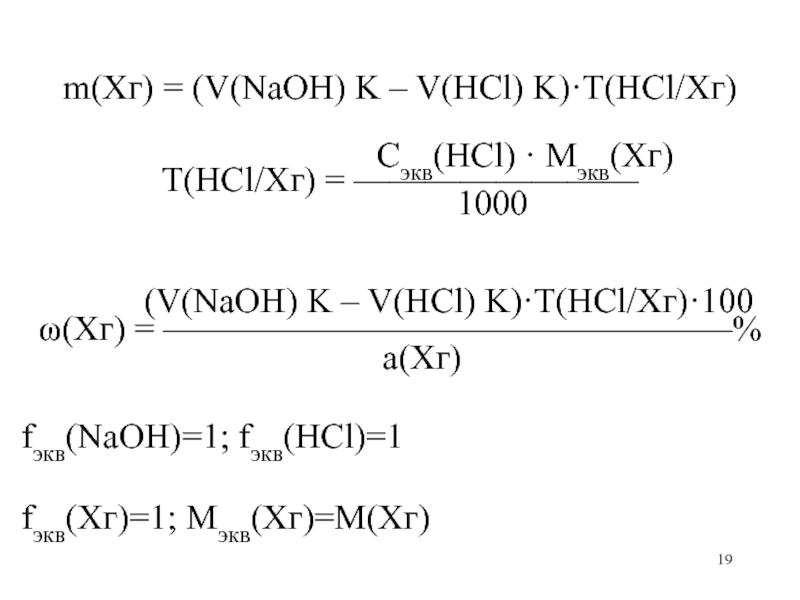Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Кислотно-основное титрование Ацидиметрия – титранты, растворы сильных кислот
Содержание
- 1. 1 Кислотно-основное титрование Ацидиметрия – титранты, растворы сильных кислот
- 2. Алкалиметрия. Стандартизация титранта NaOH, KOH1 – 0,5
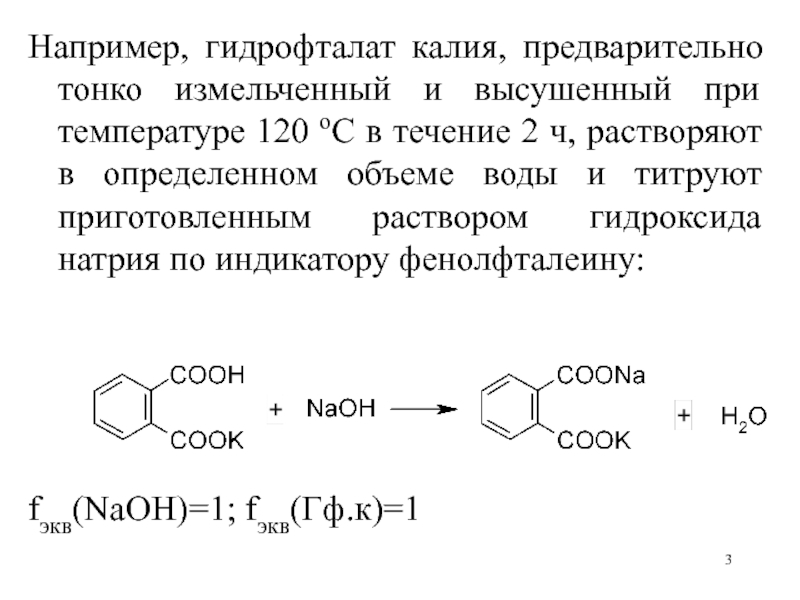
- 3. Например, гидрофталат калия, предварительно тонко измельченный и
- 4. В общем виде:
- 5. Сэкв(Гф.к)V(Гф.к.) = Сэкв(NaOH)V(NaOH)
- 6. Алкалиметрия применяется для количествен-ного определения сильных и
- 7. Обратное титрование:
- 8. Заместительное титрование4NH4Cl + 6HCOH (CH2)6N4 +
- 9. В фармацевтическом анализе прямое алкалиметрическое титрование применяется
- 10. Кислота бензойная (кислота салициловая):Для предотвращения гидролиза бензоата
- 11. Расчет массы бензойной кислоты:m(Б.к.) = V(NaOH)·K·T(NaOH/Б.к.)Расчет массовой
- 12. Расчет массы и массовой доли с учетом
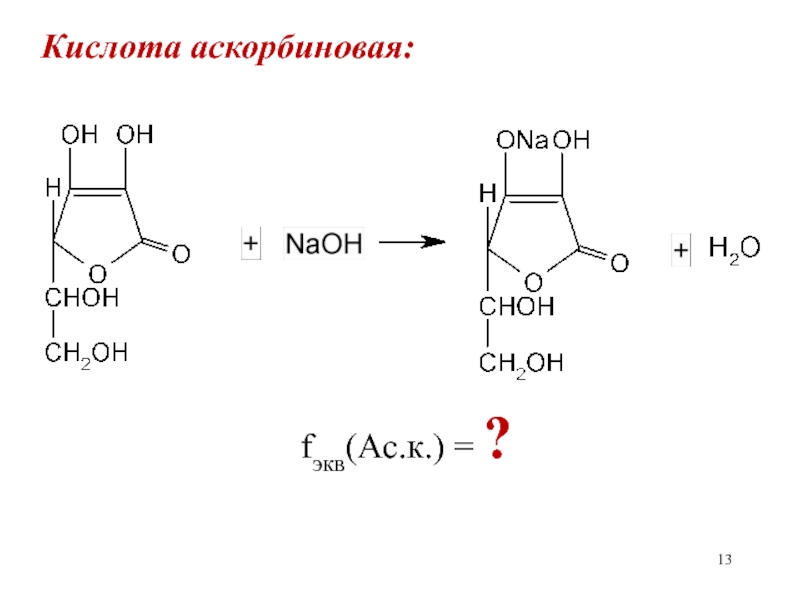
- 13. Кислота аскорбиновая:
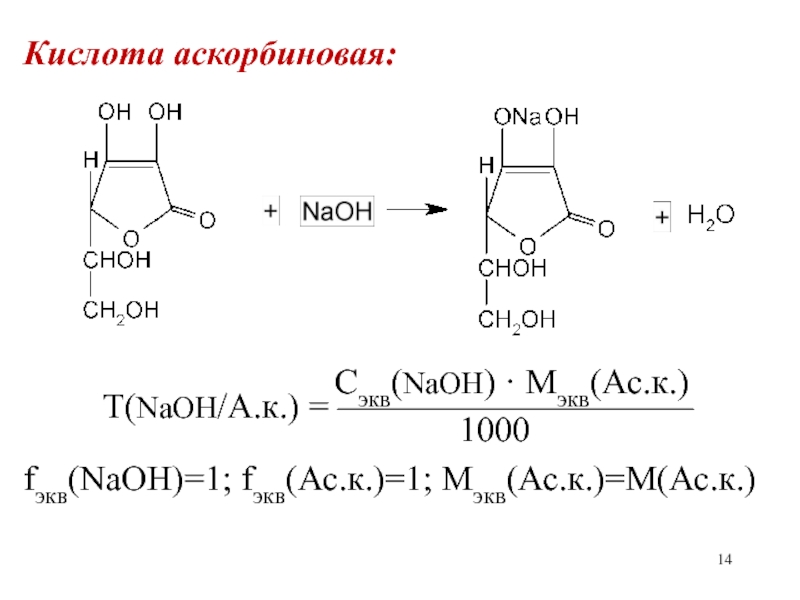
- 14. Кислота аскорбиновая:
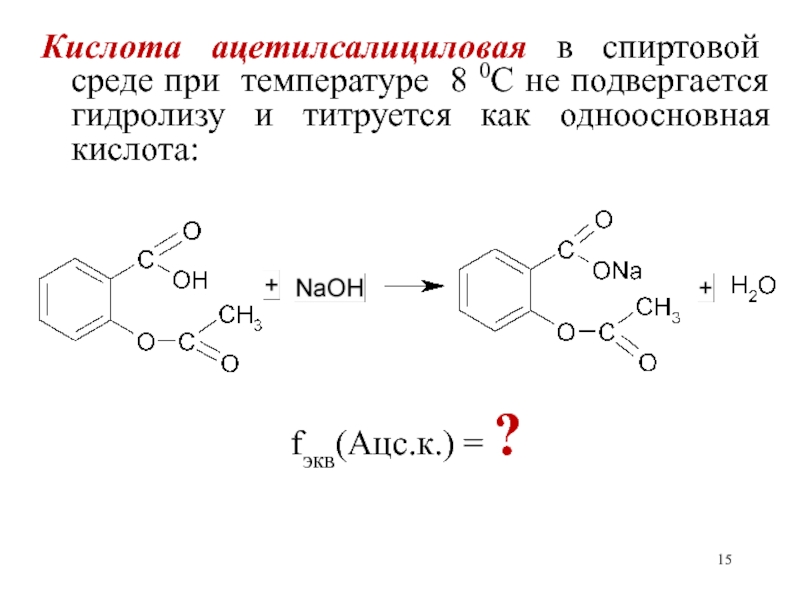
- 15. Кислота ацетилсалициловая в спиртовой среде при температуре
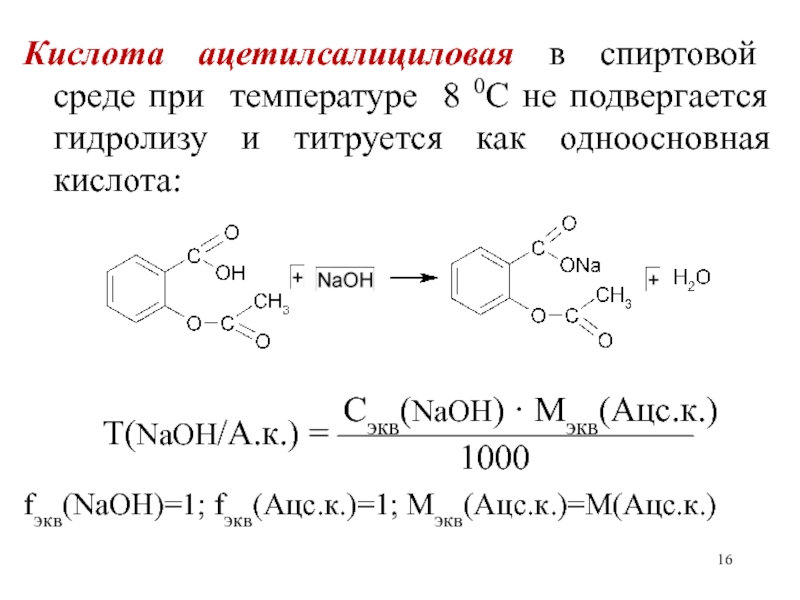
- 16. Кислота ацетилсалициловая в спиртовой среде при температуре
- 17. Новокаин:
- 18. Обратное алкалиметрическое титрование применяется для количественного определе-ния
- 19. m(Xг) = (V(NaOH) K – V(HCl) K)·T(HCl/Xг)
- 20. Фенилсалицилат:fэкв(Фс) = ?
- 21. При титровании избытка щелочи одновременно будут оттитровываться
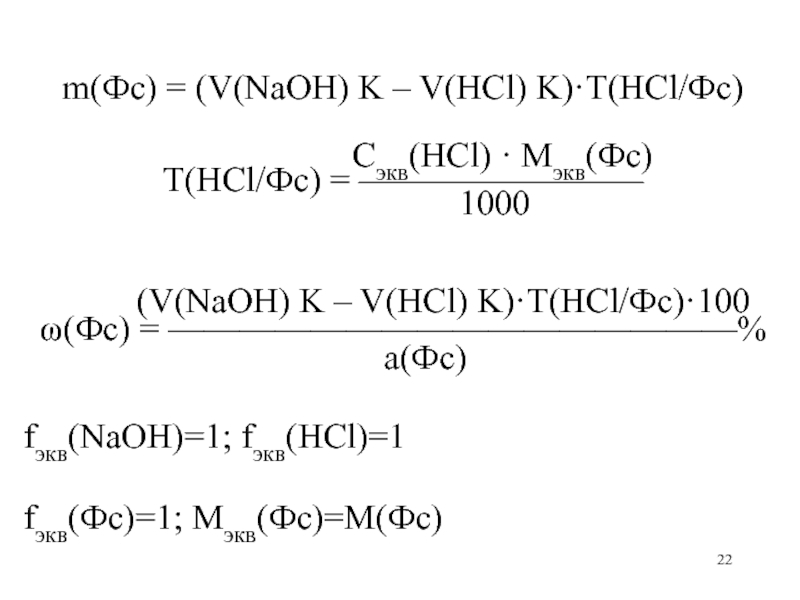
- 22. m(Фс) = (V(NaOH) K – V(HCl) K)·T(HCl/Фс)
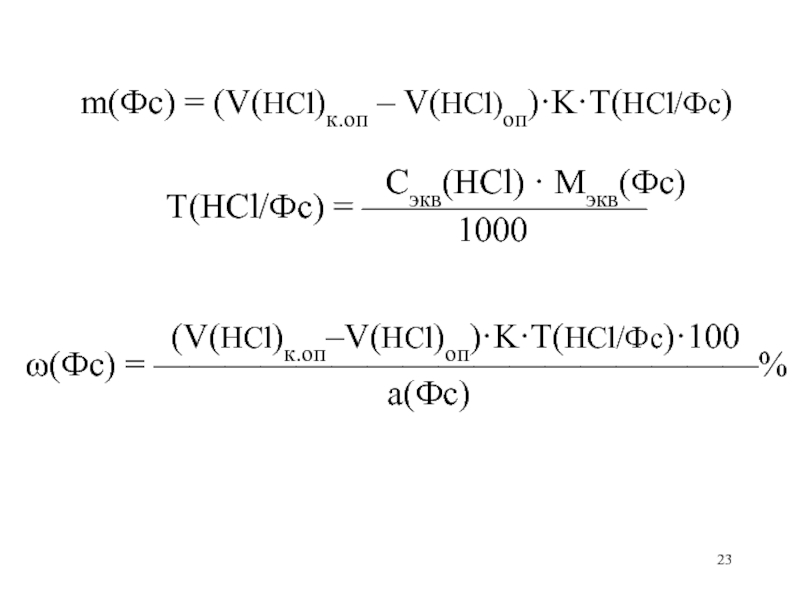
- 23. m(Фс) = (V(HCl)к.оп – V(HCl)оп)·K·T(HCl/Фс)
- 24. Вариант заместительного титрования (косвенного титрования) применяется для
- 25. Метод основан на свойстве веществ за счет
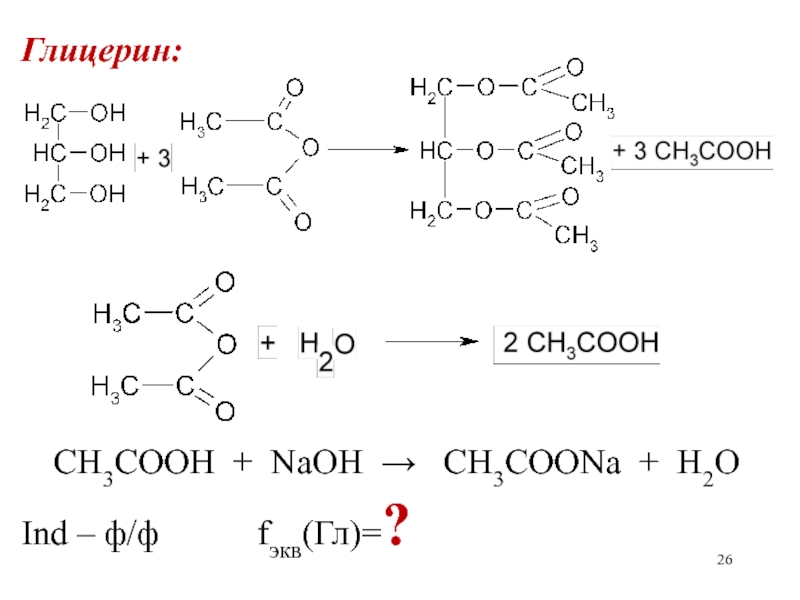
- 26. Глицерин:CH3COOH + NaOH CH3COONa + H2OInd – ф/ф fэкв(Гл)=?
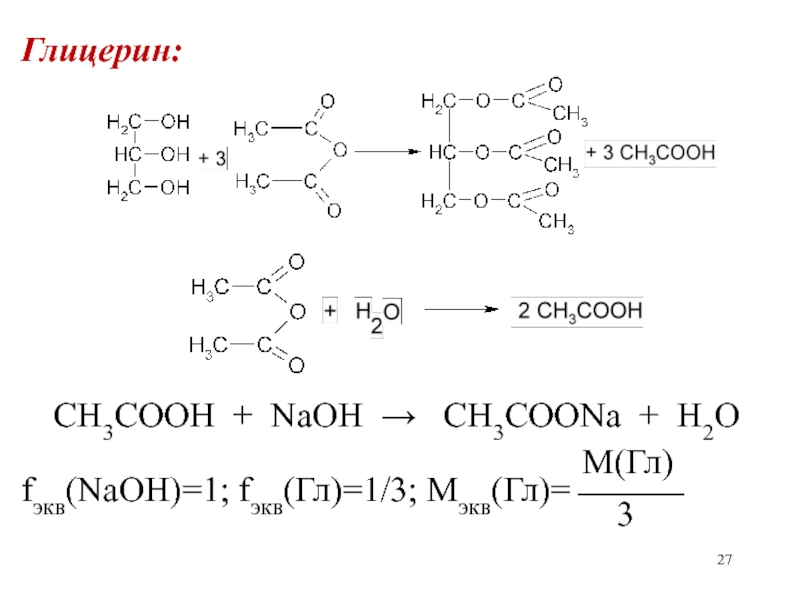
- 27. Глицерин:CH3COOH + NaOH CH3COONa +
- 28. m(Гл) = (V(NaOH)к.оп –V(NaOH)оп)·K·T(NaOH/Гл)
- 29. Ментол:
- 30. Ментол:
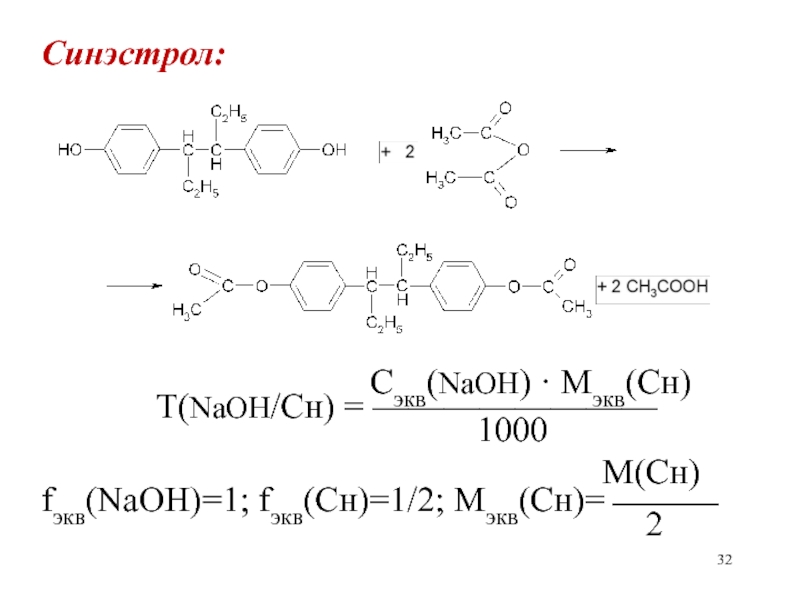
- 31. Синэстрол: Т(NaOH/Сн) = ?
- 32. Синэстрол:
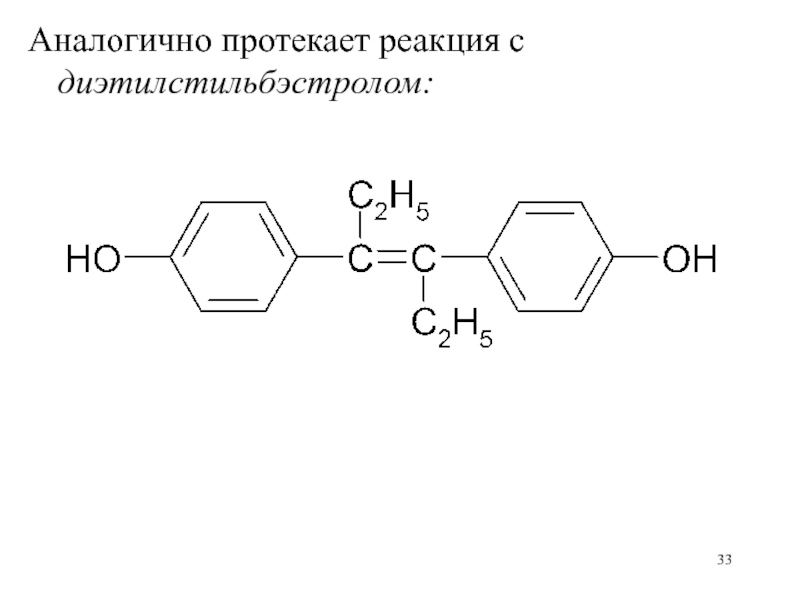
- 33. Аналогично протекает реакция с диэтилстильбэстролом:
- 34. Косвенный метод нейтрализации применяется, также, для количественного
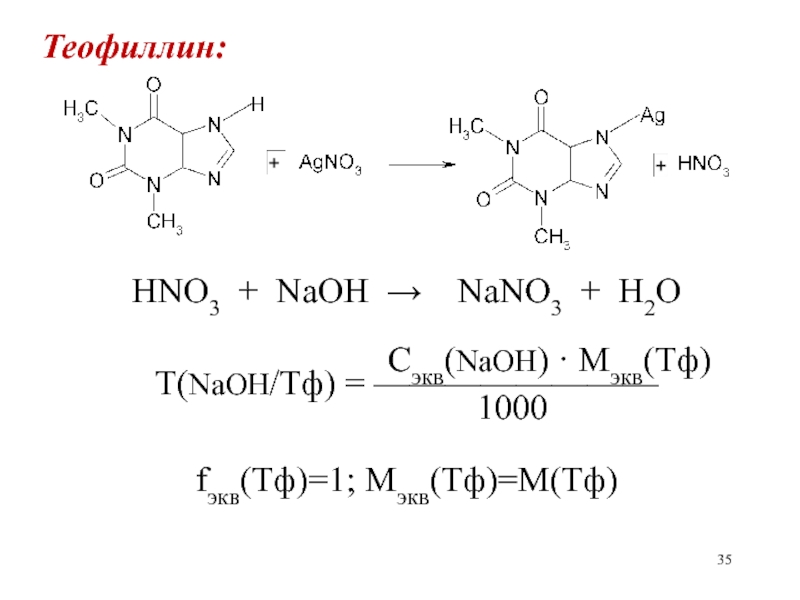
- 35. Теофиллин:HNO3 + NaOH NaNO3 +
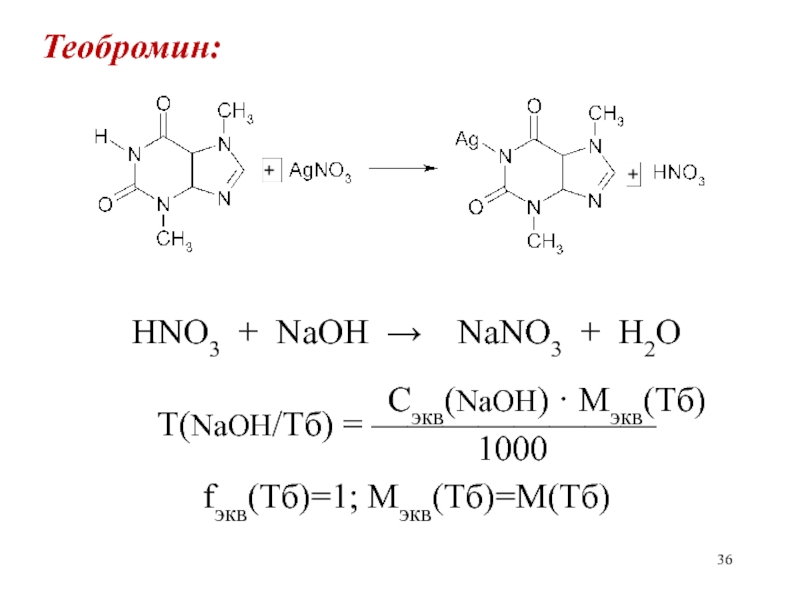
- 36. Теобромин:HNO3 + NaOH NaNO3 +
- 37. Слайд 37
- 38. Скачать презентанцию
Алкалиметрия. Стандартизация титранта NaOH, KOH1 – 0,5 – 0,1 – 0,05 – 0,02 – 0,01 н.По точной навеске приготовить нельзя, т.к. щелочи гигроскопичны и поглощают углекислый газ воздухаГотовят раствор щелочи приблизительно
Слайды и текст этой презентации
Слайд 1
Кислотно-основное титрование
Ацидиметрия – титранты, растворы сильных кислот HCl, H2SO4, HNO3
Алкалиметрия
– титранты, растворы сильных щелочей NaOH, KOH
Слайд 2Алкалиметрия. Стандартизация титранта
NaOH, KOH
1 – 0,5 – 0,1 –
0,05 – 0,02 – 0,01 н.
По точной навеске приготовить нельзя,
т.к. щелочи гигроскопичны и поглощают углекислый газ воздухаГотовят раствор щелочи приблизительно нужной концентрации и проводят стандарти-зацию по установочным веществам: гидрофта-лату калия C8H9O4K, щавелевой кислоте H2C2O42H2O, янтарной кислоте H2C4H4O4, бензойной кислоте C6H5COOH и другим веществам.
Слайд 3Например, гидрофталат калия, предварительно тонко измельченный и высушенный при температуре
120 оС в течение 2 ч, растворяют в определенном объеме
воды и титруют приготовленным раствором гидроксида натрия по индикатору фенолфталеину:fэкв(NaOH)=1; fэкв(Гф.к)=1
Слайд 4 В общем виде:
m(Y) = ————————————
1000
m(Y)т.н.. · 1000
Сэкв(Y)практ = ———————
Mэкв(Y) · V(мл)
В алкалиметрии:
Сэкв(Гф.к)теор · Mэкв(Гф.к) · Vм.к.
m(Гф.к) = —————————————
1000
m(Гф.к) · 1000
Сэкв(Гф.к)практ = ———————
Mэкв(Гф.к) · Vм.к.
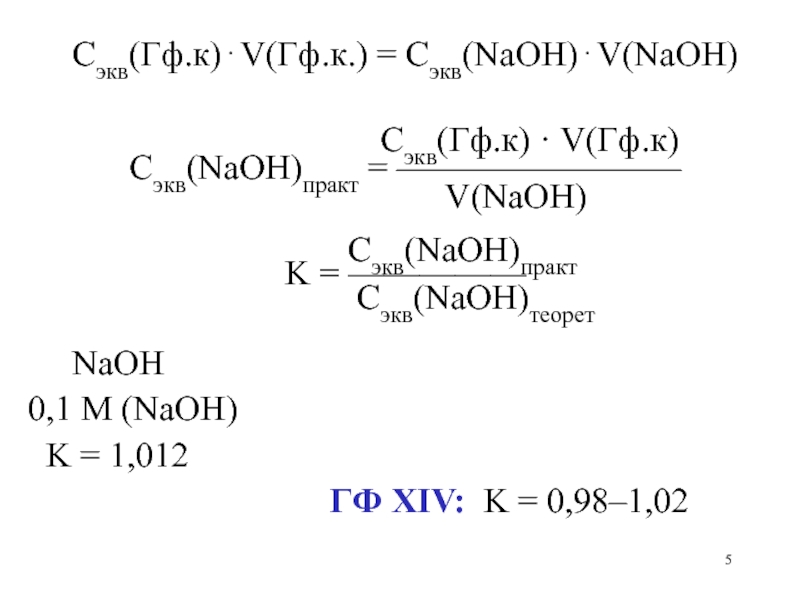
Слайд 5
Сэкв(Гф.к)V(Гф.к.) = Сэкв(NaOH)V(NaOH)
Сэкв(Гф.к) · V(Гф.к)
Сэкв(NaOH)практ = ————————
V(NaOH)
Сэкв(NaOH)практ
K = —————
Сэкв(NaOH)теорет
NaOH
0,1 M (NaOH)
K = 1,012
ГФ ХIV: K = 0,98–1,02
Слайд 6Алкалиметрия применяется для количествен-ного определения сильных и слабых кислот, солей
слабых оснований, как правило, прямым титрованием.
Ион аммония NH4+
очень слабая кислота (рК=9,24), поэтому прямое титрование его в водном растворе невозможно. Определяют аммиак в солях аммония одним из двух способов: обратным титрованием или заместительным титрованием.Слайд 7Обратное титрование:
t
NH4Cl + NaOH NH3 + NaCl + H2O
избыток
NaOH + HCl NaCl + H2O
остаток
m(NH3) = (V(NaOH)K V(HCl)K)Т(HCl/NH3)
(V(NaOH)K V(HCl)K)Т(HCl/NH3)100
(NH3) = (%)
а (NH4Cl)
Сэкв(HCl)Мэкв(NH3)
Т(HCl/NH3) =
1000
fэкв(HCl)=1; fэкв(NH3)=1; Мэкв(NH3)=М(NH3)
Слайд 8Заместительное титрование
4NH4Cl + 6HCOH (CH2)6N4 + 4HCl + 6H2O
Гексаметилентетрамин (ГМТА)
HCl + NaOH NaCl + H2O
m(NH3) = V(NaOH)KТ(NaOH/NH3)
V(NaOH)KТ(NaOH/NH3)100
(NH3) = (%)
а (NH4Cl)
Сэкв(NaOH)Мэкв(NH3)
Т(NaOH/NH3) =
1000
fэкв(NaOH)=1; fэкв(NH3)=1; Мэкв(NH3)=М(NH3)
Слайд 9
В фармацевтическом анализе прямое алкалиметрическое титрование применяется для количественного определения
кислот (хлороводородной, бензойной, салициловой, аскорбиновой и др. кислот) и солей,
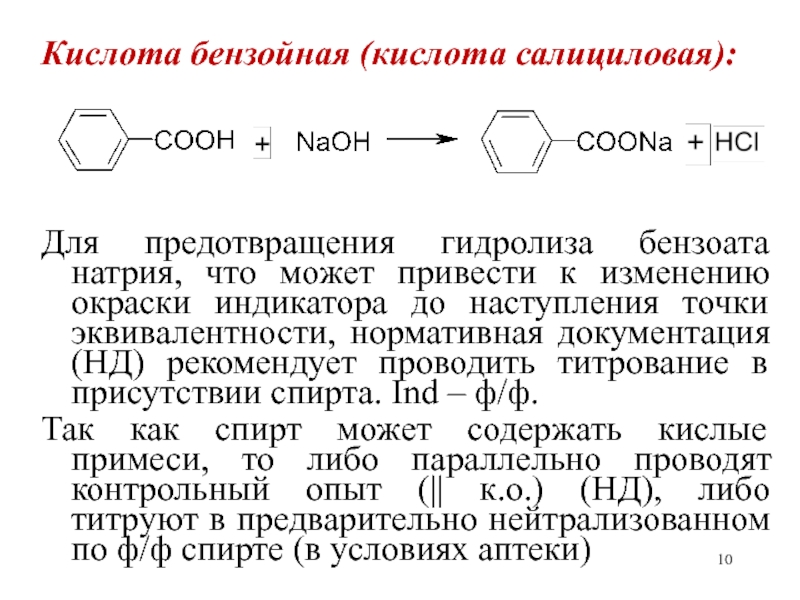
образованных слабым основанием и сильной кислотой (новокаин, гоматропина гидробромид, тровентол и др. солей).Слайд 10Кислота бензойная (кислота салициловая):
Для предотвращения гидролиза бензоата натрия, что может
привести к изменению окраски индикатора до наступления точки эквивалентности, нормативная
документация (НД) рекомендует проводить титрование в присутствии спирта. Ind – ф/ф.Так как спирт может содержать кислые примеси, то либо параллельно проводят контрольный опыт (|| к.о.) (НД), либо титруют в предварительно нейтрализованном по ф/ф спирте (в условиях аптеки)
Слайд 11Расчет массы бензойной кислоты:
m(Б.к.) = V(NaOH)·K·T(NaOH/Б.к.)
Расчет массовой доли бензойной кислоты:
V(NaOH)·K·T(NaOH/Б.к.)·100
(Б.к.) = —————————————%
а(Б.к.)Сэкв(NaOH) · Mэкв(Б.к.)
Т(NaOH/Б.к.) = ————————
1000
fэкв(NaOH)=1; fэкв(Б.к.)=1; Мэкв(Б.к.)=М(Б.к.)
Слайд 12
Расчет массы и массовой доли с учетом контрольного опыта:
m(Б.к.)
= (V(NaOH)оп –V(NaOH)к.оп)·K·T(NaOH/Б.к.)
(V(NaOH)оп–V(NaOH)к.оп)·K·T(NaOH/Б.к.)·100
(Б.к.)
= ——————————————————%а(Б.к.)
Слайд 14Кислота аскорбиновая:
Сэкв(NaOH)
· Mэкв(Ас.к.)Т(NaOH/А.к.) = ——————————
1000
fэкв(NaOH)=1; fэкв(Ас.к.)=1; Мэкв(Ас.к.)=М(Ас.к.)
Слайд 15Кислота ацетилсалициловая в спиртовой среде при температуре 8 0С не
подвергается гидролизу и титруется как одноосновная кислота:
fэкв(Ацс.к.) = ?
Слайд 16Кислота ацетилсалициловая в спиртовой среде при температуре 8 0С не
подвергается гидролизу и титруется как одноосновная кислота:
Сэкв(NaOH) · Mэкв(Ацс.к.) Т(NaOH/А.к.) = ——————————
1000
fэкв(NaOH)=1; fэкв(Ацс.к.)=1; Мэкв(Ацс.к.)=М(Ацс.к.)
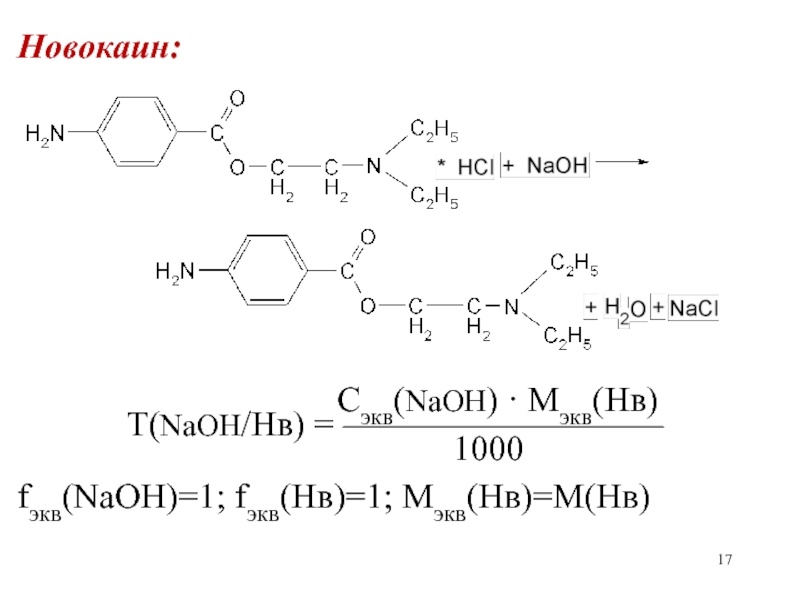
Слайд 17Новокаин:
Сэкв(NaOH) ·
Mэкв(Нв)Т(NaOH/Нв) = —————————
1000
fэкв(NaOH)=1; fэкв(Нв)=1; Мэкв(Нв)=М(Нв)
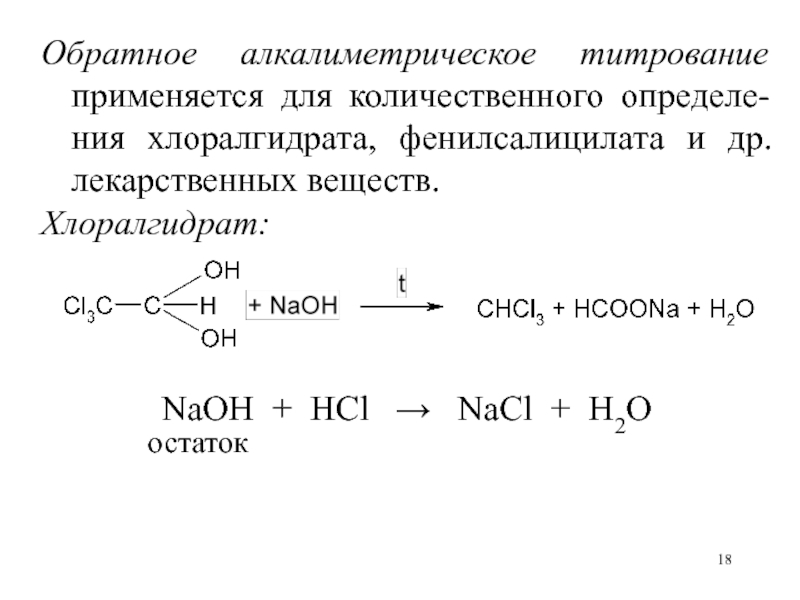
Слайд 18Обратное алкалиметрическое титрование применяется для количественного определе-ния хлоралгидрата, фенилсалицилата и
др. лекарственных веществ.
Хлоралгидрат:
NaOH + HCl NaCl +
H2Oостаток
Слайд 19
m(Xг) = (V(NaOH) K – V(HCl) K)·T(HCl/Xг)
Сэкв(HCl) · Mэкв(Xг)
Т(HCl/Хг) = ————————
1000
(V(NaOH) K – V(HCl) K)·T(HCl/Xг)·100
(Xг) = ————————————————%
а(Хг)
fэкв(NaOH)=1; fэкв(HCl)=1
fэкв(Хг)=1; Мэкв(Хг)=М(Хг)
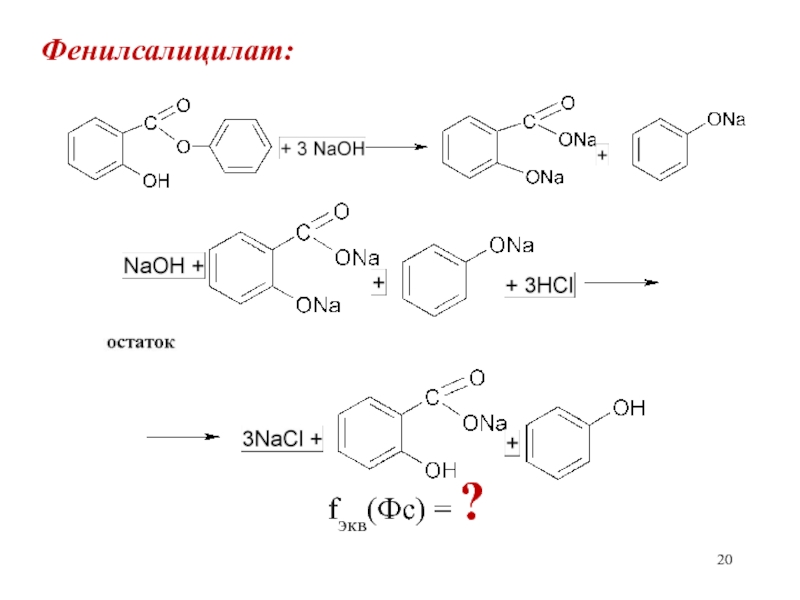
Слайд 21
При титровании избытка щелочи одновременно будут оттитровываться динатривая соль салициловой
кислоты и фенолят натрия. Изменение окраски фенолфталеина будет происходить при
переходе от динатриевой соли салицилата в мононатриевую сольСлайд 22
m(Фс) = (V(NaOH) K – V(HCl) K)·T(HCl/Фс)
Сэкв(HCl) · Mэкв(Фс)
Т(HCl/Фс) = ————————
1000
(V(NaOH) K – V(HCl) K)·T(HCl/Фс)·100
(Фс) = ————————————————%
а(Фс)
fэкв(NaOH)=1; fэкв(HCl)=1
fэкв(Фс)=1; Мэкв(Фс)=М(Фс)
Слайд 23
m(Фс) = (V(HCl)к.оп – V(HCl)оп)·K·T(HCl/Фс)
Сэкв(HCl) · Mэкв(Фс)
Т(HCl/Фс) = ————————
1000
(V(HCl)к.оп–V(HCl)оп)·K·T(HCl/Фс)·100
(Фс) = —————————————————%
а(Фс)
Слайд 24
Вариант заместительного титрования (косвенного титрования) применяется для лекарственных веществ, содержащих
гидроксильную группу (глицерин, ментол, синэстрол, диэтилстильбэстрол и др) (метод ацетилирования).
Слайд 25Метод основан на свойстве веществ за счет спиртовых гидроксилов ацетилироваться
уксусным ангидридом с образованием слож-ных эфиров и выделением эквивалентного количества
уксусной кислоты, которую оттитровывают стандартным раствором гид-роксида натрия.Так как одновременно будет оттитровываться уксусная кислота, образующаяся при гидролизе избытка уксусного ангидрида, взятого для ацетилирования, параллельно проводят контрольный опыт.
Слайд 28
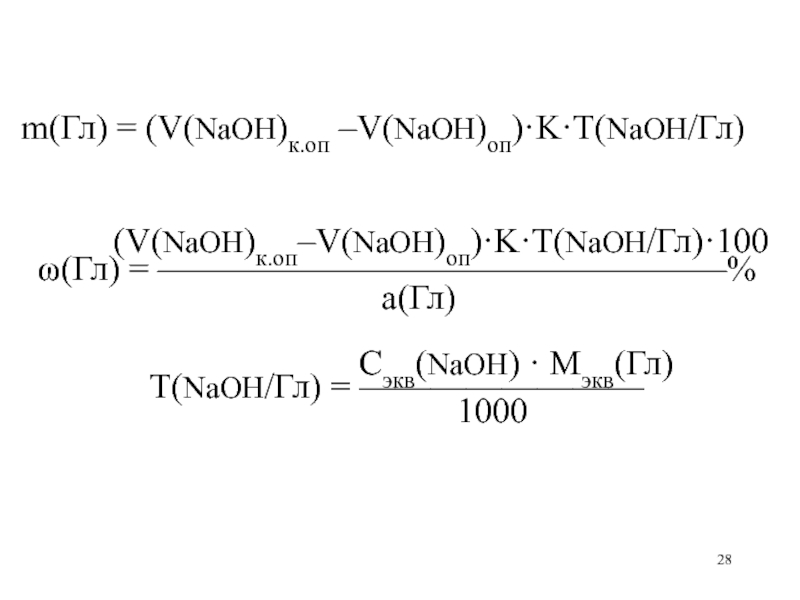
m(Гл) = (V(NaOH)к.оп –V(NaOH)оп)·K·T(NaOH/Гл)
(V(NaOH)к.оп–V(NaOH)оп)·K·T(NaOH/Гл)·100
(Гл) =
————————————————%
а(Гл)
Сэкв(NaOH) · Mэкв(Гл) Т(NaOH/Гл) = ————————
1000
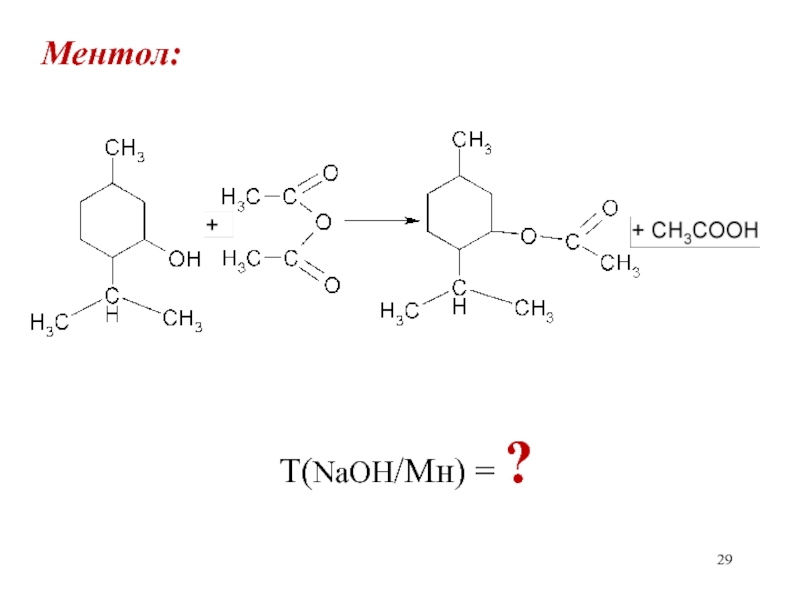
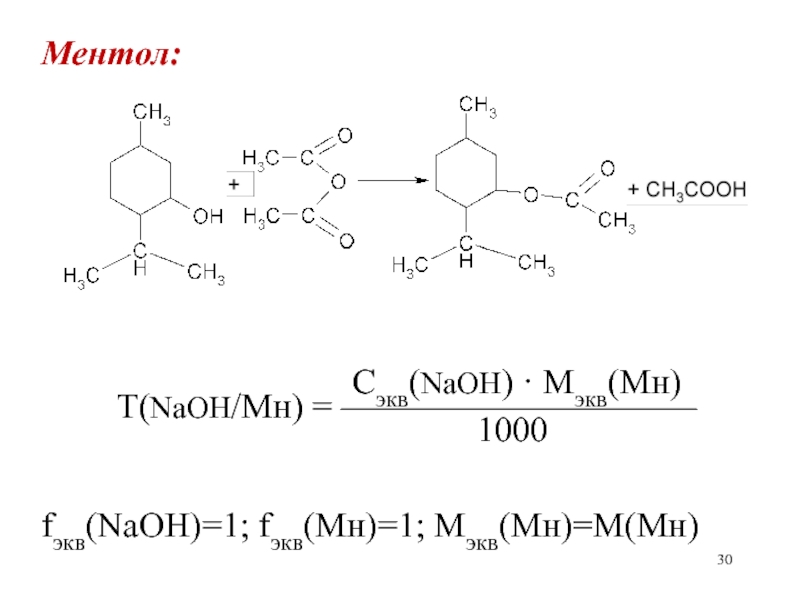
Слайд 30Ментол:
Сэкв(NaOH) ·
Mэкв(Мн)Т(NaOH/Мн) = ——————————
1000
fэкв(NaOH)=1; fэкв(Мн)=1; Мэкв(Мн)=М(Мн)
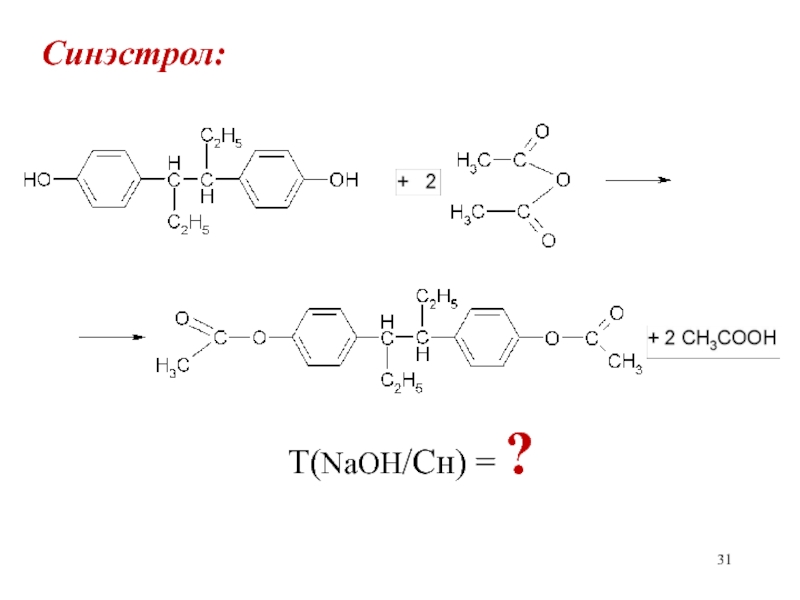
Слайд 32Синэстрол:
Сэкв(NaOH)
· Mэкв(Сн)Т(NaOH/Сн) = ————————
1000
М(Сн)
fэкв(NaOH)=1; fэкв(Сн)=1/2; Мэкв(Сн)=
2
Слайд 34
Косвенный метод нейтрализации применяется, также, для количественного определения теобромина и
теофиллина. При взаимодей-ствии с нитратом серебра выделяется азотная кислота, которая
оттитровывается стандарт-ным раствором гидроксида натрия.Слайд 35Теофиллин:
HNO3 + NaOH NaNO3 + H2O
Сэкв(NaOH) · Mэкв(Тф)
Т(NaOH/Тф) = ————————
1000
fэкв(Тф)=1; Мэкв(Тф)=М(Тф)
Слайд 36Теобромин:
HNO3 + NaOH NaNO3 + H2O
Сэкв(NaOH) · Mэкв(Тб)
Т(NaOH/Тб) = ————————
1000
fэкв(Тб)=1; Мэкв(Тб)=М(Тб)