Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
Содержание
- 1. 1 Курс Общая химия Лектор: проф. Майстренко Валерий Николаевич Башкирский
- 2. Лекция № 6ХИМИЯ РАСТВОРОВ(Коллигативные свойства растворов)
- 3. Раствор - однородная многокомпонентная система, состоящая из
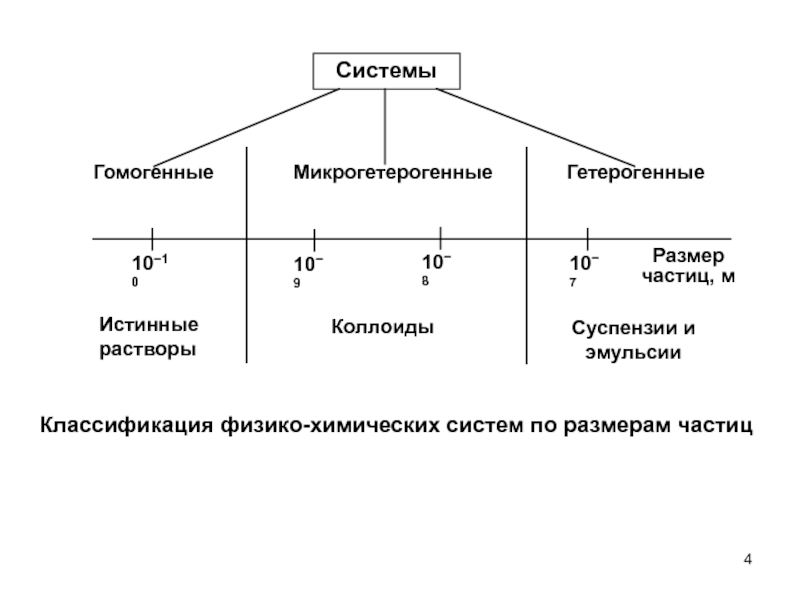
- 4. СистемыГомогенныеГетерогенныеМикрогетерогенныеИстинныерастворыКоллоидыСуспензии иэмульсииРазмерчастиц, м1010109108107Классификация физико-химических систем по размерам частиц
- 5. По агрегатному состоянию растворы
- 6. Способы выражения концентраций растворов Массовая
- 7. Процентная концентрация (Р) –
- 8. Условие самопроизвольности образования растворовGp < 0, Hp
- 9. Рассмотрим равновесиеH2Oж ⇆ H2OпарПри равновесииУчитывая, чтогде р0
- 10. Это первый закон Рауля – относительное понижение
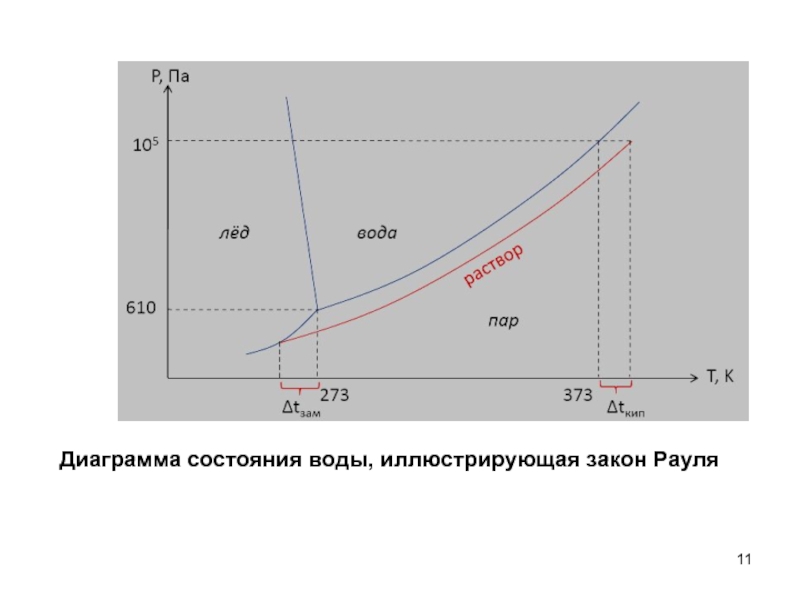
- 11. Диаграмма состояния воды, иллюстрирующая закон Рауля
- 12. Слайд 12
- 13. Осмотическое давлениеОсмос – самопроизвольный переход вещества через
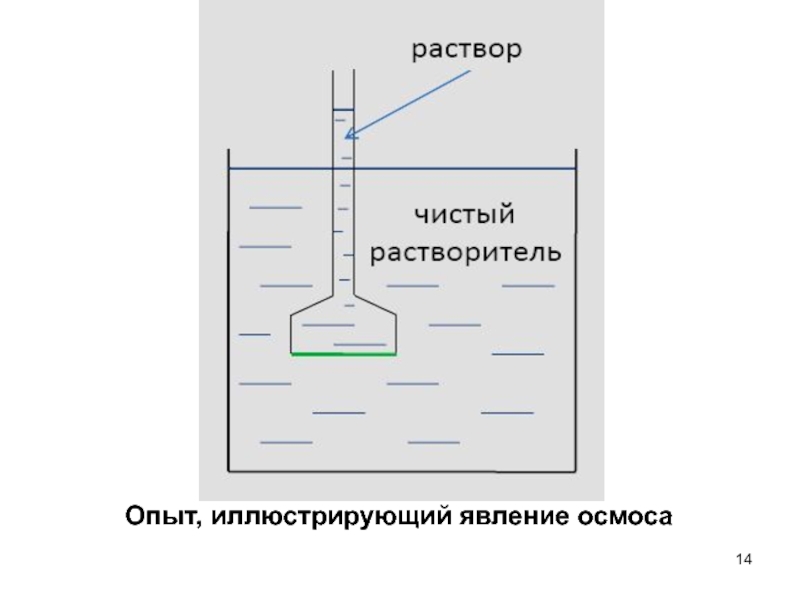
- 14. Опыт, иллюстрирующий явление осмоса
- 15. Биологическое значение осмотического давления
- 16. Определение молекулярной массы веществ на основе коллигативных
- 17. Изотонический коэффициент Изотонический коэффициент
- 18. Благодарю за внимание
- 19. Скачать презентанцию
Лекция № 6ХИМИЯ РАСТВОРОВ(Коллигативные свойства растворов)
Слайды и текст этой презентации
Слайд 1Курс «Общая химия»
Лектор: проф. Майстренко Валерий Николаевич
Башкирский государственный университет
Кафедра неорганической
химии
Слайд 3Раствор - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ
и продуктов их взаимодействия.
Растворение — переход молекул вещества из одной
фазы в другую (раствор, растворенное состояние).
Слайд 4Системы
Гомогенные
Гетерогенные
Микрогетерогенные
Истинные
растворы
Коллоиды
Суспензии и
эмульсии
Размер
частиц, м
1010
109
108
107
Классификация физико-химических систем по размерам частиц
Слайд 5 По агрегатному состоянию растворы могут быть жидкими
(морская вода), газообразными (воздух) или твёрдыми (сплавы металлов). Размеры частиц
в истинных растворах - менее 10-9 м. Если молекулы или ионы в растворе присутствуют в таком количестве, что не происходит дальнейшего растворения вещества, раствор называется насыщенным. Иначе говоря, насыщенным называет-ся раствор, который находится в динамическом равновесии с осадком растворенного вещества. Если насыщенный раствор осторожно охладить, то избыточное количество растворенного вещества не всегда выпадает в осадок. В этом случае мы имеем пересыщенный раствор. Пересыщенные растворы неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать выпадение вещества в осадок и переход раствора в насыщенное устойчивое состояние.Ненасыщенный раствор - раствор, содержащий меньше растворен-ного вещества, чем насыщенный.
Пересыщенный раствор - раствор, содержащий больше растворен-ного вещества, чем насыщенный.
Слайд 6Способы выражения концентраций растворов
Массовая доля растворённого вещества
(w) - безразмерная величина, равная отношению массы растворённого вещества к
общей массе раствора:Молярная концентрация (CM) – число молей растворённого вещества
в 1 литре раствора:
Нормальная концентрация (CN) – число грамм-эквивалентов вещества в 1 литре раствора
Слайд 7
Процентная концентрация (Р) – число граммов растворенного
вещества в 100 г раствора:
Моляльная концентрация (m) – число молей растворённого вещества
в 1 кг растворителя:
Мольная доля (N) – безразмерная величина, равная отношению числа молей растворённого вещества к общему числу молей раствора:
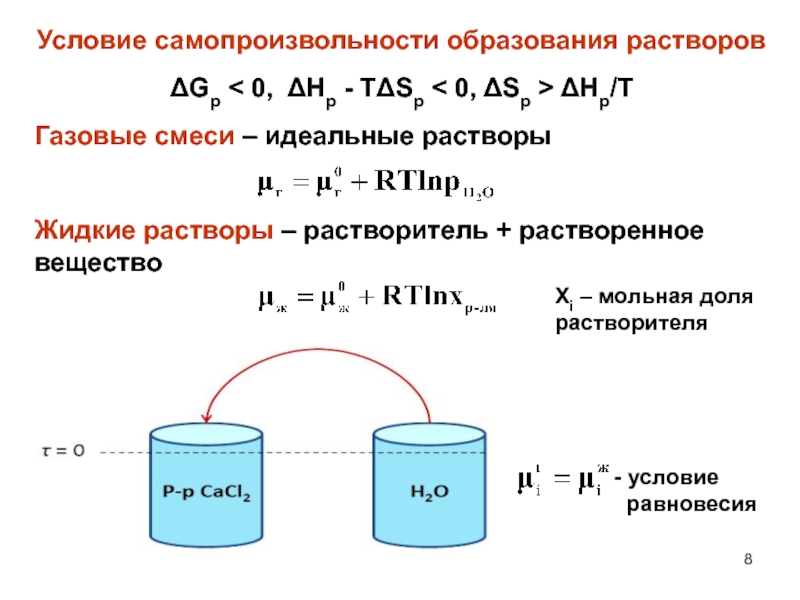
Слайд 8Условие самопроизвольности образования растворов
Gp < 0, Hp - TSp
0, Sp > Hp/T
Газовые смеси – идеальные растворы
Жидкие растворы
– растворитель + растворенное вещество- условие
равновесия
Xi – мольная доля растворителя
Слайд 9Рассмотрим равновесие
H2Oж ⇆ H2Oпар
При равновесии
Учитывая, что
где р0 – давление пара
над чистым растворителем, р – давление
пара растворителя над раствором
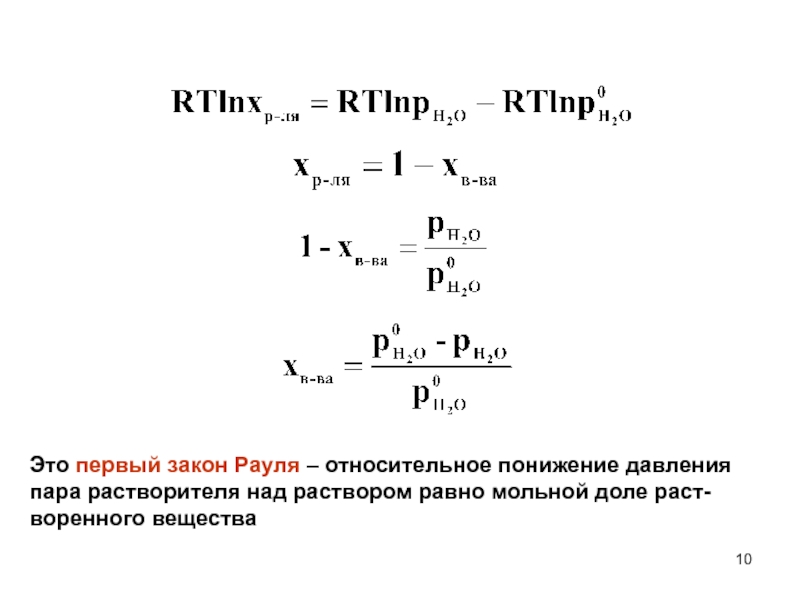
Слайд 10Это первый закон Рауля – относительное понижение давления пара растворителя
над раствором равно мольной доле раст-воренного вещества
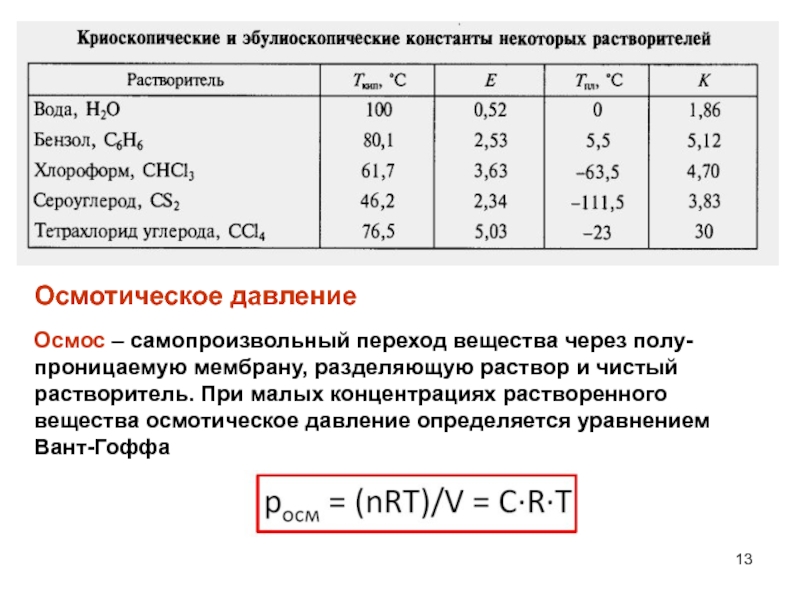
Слайд 13Осмотическое давление
Осмос – самопроизвольный переход вещества через полу-проницаемую мембрану, разделяющую
раствор и чистый растворитель. При малых концентрациях растворенного вещества осмотическое
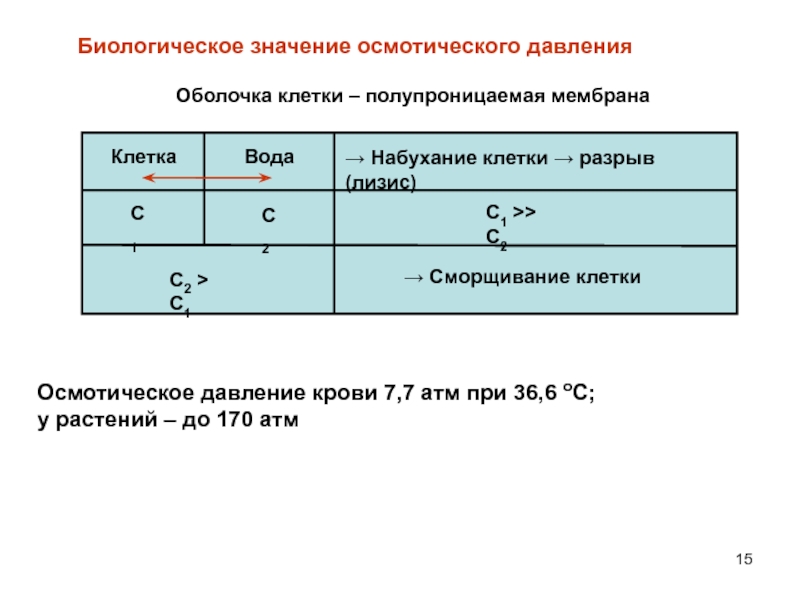
давление определяется уравнением Вант-ГоффаСлайд 15 Биологическое значение осмотического давления
Осмотическое давление крови 7,7 атм при 36,6 оС;
у растений – до 170 атм
Клетка
Вода
Набухание клетки разрыв (лизис)
С1
С2
С1 >> C2
С2 > C1
Сморщивание клетки
Слайд 16Определение молекулярной массы веществ на основе
коллигативных свойств растворов
Пример: раствор
0,1155 г белого фосфора в 19,03 г бензола замер-
зает при
5,15 ºС. Для чистого бензола Тз = 5,4 ºС, К = 5,12. Установитьсостав молекулы белого фосфора.
Тз = К(1000.а)/(М.b)
где К – криоскопическая константа бензола, а – масса растворен-
ного вещества b – масса растворителя.
5,4 – 5,15 = 5,12(1000.0,1155)/(М.19,03)
М = 123,8; А.м. фосфора = 30,9; n = 4.
Белый фосфор имеет состав Р4
Слайд 17Изотонический коэффициент
Изотонический коэффициент (i)— безразмерный параметр,
характеризующий поведение вещества в растворе. Он численно равен отношению значения
некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:где N – число молекул электролита, - степень диссоциации электролита, n – число ионов в молекуле электролита
Тзам = iKm
Ткип = iЕm
Pосм = iCRT