Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
1 Закон действующих масс и его применение в аналитической химии
Содержание
- 1. 1 Закон действующих масс и его применение в аналитической химии
- 2. Като Гульдберг Петер Вааге
- 3. 1867 г.К.М. Гульдберг и
- 4. Гомогенная реакцияVп = kп · [A]a · [B]bkп – константа скорости прямой реакции
- 5. Vо = kо · [C]c · [D]dkо – константа скорости обратной реакции
- 6. При установившемся химическом равновесииVп = Vоkп
- 7. Слайд 7
- 8. При установившемся химическом равновесии произведение концентраций продуктов
- 9. Константа равновесия зависит от температуры и давления
- 10. Слайд 10
- 11. Равновесие в гомогенной системе. Термодинамическая и концентрационная (реальная) константы равновесия. Связь между ними.
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. -коэффициент (молярная доля)
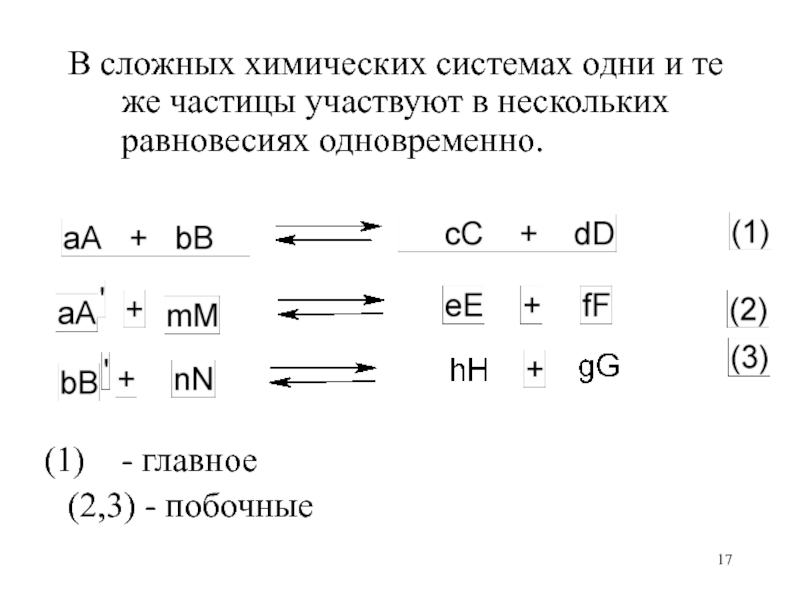
- 17. В сложных химических системах одни и те
- 18. Характеристикой глубины протекания конкурирующих реакций служит -коэффициент
- 19. CA = [A] + [A'] Аналогично:
- 20. Слайд 20
- 21. Например: Насыщенный водный раствор HgS в присутствии
- 22. HgS = Hg2+ + S2Hg2+ + Cl
- 23. HgS = Hg2+ + S2
- 24. -коэффициенты служат мерой степени химических взаимодействий в
- 25. Условная константа равновесия гомогенной реакции. Связь с термодинамической и концентрационной константами
- 26. Слайд 26
- 27. CCc
- 28. 1. В реальной системе при наличии химических
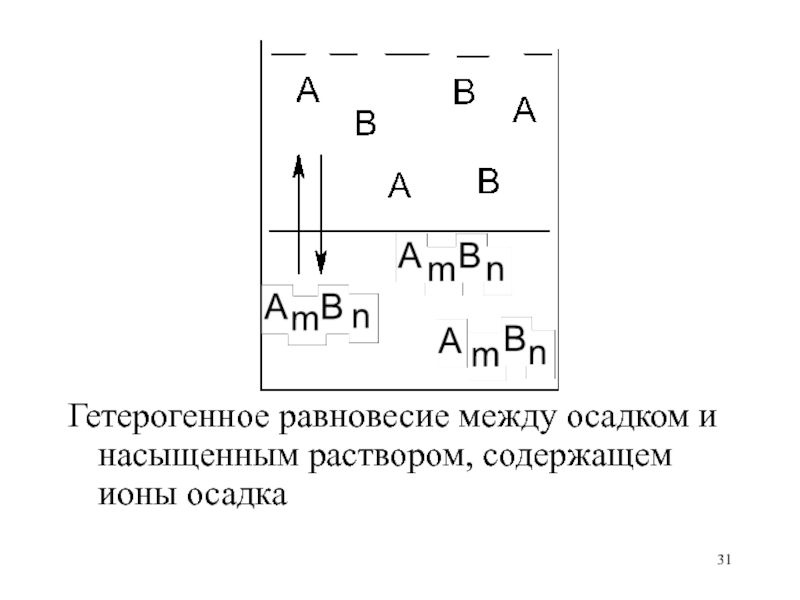
- 29. Равновесие в гетерогенной системе
- 30. Слайд 30
- 31. Гетерогенное равновесие между осадком и насыщенным раствором, содержащем ионы осадка
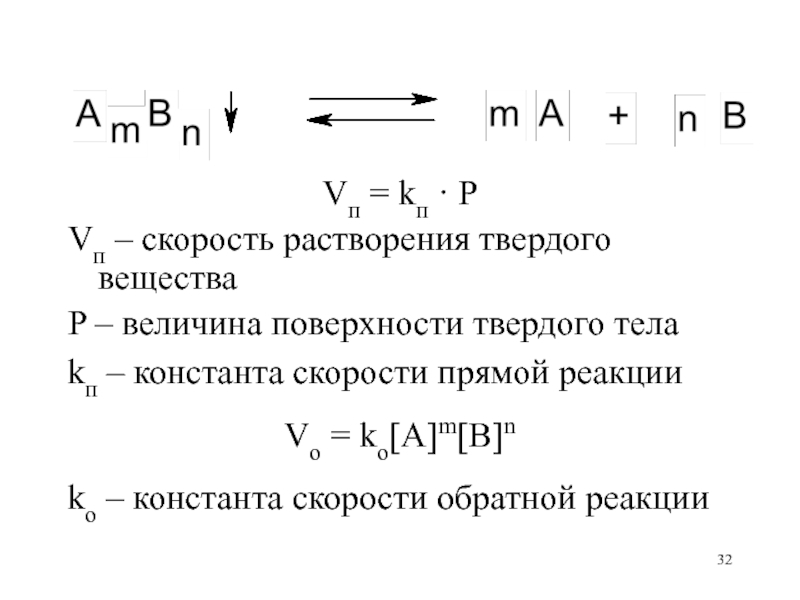
- 32. Vп = kп · PVп – скорость
- 33. Vп = VoP = 0kп = ko[A]m[B]nkп
- 34. Термодинамическая, концентрационная и условная константы равновесия гетерогенной реакции
- 35. Слайд 35
- 36. Слайд 36
- 37. Скачать презентанцию
Като Гульдберг Петер Вааге
Слайды и текст этой презентации
Слайд 3
1867 г.
К.М. Гульдберг и П. Вааге
Скорость химической
реакции прямо пропорциональна произведению концентраций реагирующих веществ
Слайд 7
kо · [C]c · [D]d
1 = ———————
kп · [A]a · [B]bkп [C]c · [D]d
Kр = —— = ——————
kо [A]a · [B]b
[C]c · [D]d
Kр = ——————
[A]a · [B]b
Слайд 8
При установившемся химическом равновесии произведение концентраций продуктов реакции, деленное на
произведение концентраций исходных веществ, есть величина постоянная (для данной реакции,
при данной температуре), называемая константой химического равновесияСлайд 9Константа равновесия зависит от температуры и давления и не зависит
от концентрации реагирующих веществ
Kр > 1 – преобладает прямая
реакцияKр < 1 – преобладает обратная реакция
pK = - lg Kp
рKp < 0 – преобладает прямая реакция
рKp > 0 – преобладает обратная реакция
Слайд 10
[C]c ·
[D]dKpP = ————
[A]a · [B]b
[C] 99,99% [D] 99,99%
[A] 0,01% [B] 0,01%
[C]c · [D]d 99,99 · 99,99
KpP = ———— = —————— = 108
[A]a · [B]b 0,01 · 0,01
Слайд 11
Равновесие в гомогенной системе. Термодинамическая и концентрационная (реальная) константы равновесия.
Связь между ними.
Слайд 13
[C]c
· [D]dKpP = ————
[A]a · [B]b
KpP зависит от температуры, давления, природы растворителя и ионной силы раствора (характеризует положение равновесия с учетом электростатических взаимодействий).
Слайд 14
[C]c
· [D]dKpP = ————
[A]a · [B]b
aA = fA · [A] [A] = aA / fA
aB = fB · [B] [B] = aB / fB
aC = fC · [C] [C] = aC / fC
aD = fD · [D] [D] = aD / fD
Слайд 15
[C]c ·
[D]d aCc · aDd
fAa · fBbKpP = ———— = ———— · ————
[A]a · [B]b aAa · aBb fCc · fDd
[C]c · [D]d fAa · fBb
KpP = ———— = KpT · ————
[A]a · [B]b fCc · fDd
при I = 0 KpP = KpT
Слайд 17В сложных химических системах одни и те же частицы участвуют
в нескольких равновесиях одновременно.
- главное
(2,3) - побочные
Слайд 18
Характеристикой глубины протекания конкурирующих реакций служит
-коэффициент или молярная доля
– отношение равновесной концентрации частиц, участвующих в основной реакции, к
общей концентрации этих частиц.Слайд 19
CA = [A] + [A']
Аналогично:
CB = [B] + [B']
CA – суммарная
концентрация компонента А[A] – кон-ция ч-цы А, участв. в главной реакции
[A'] – кон-ция ч-цы А, участв. в побоч. реакции
Слайд 20
[A]
[B]A = —— ; B = —— ;
CA CB
[C] [D]
C = —— ; D = —— ;
CC CD
= 0 — 1
При отсутствии конкурирующих реакций
CA = [A]; CB = [B];
Слайд 21Например: Насыщенный водный раствор HgS в присутствии HCl
гетерогенное: HgS = Hg2+ + S2
и гомогенные: Hg2+
+ Cl = HgCl+ Hg2+ + 2Cl = HgCl2
Hg2+ + 3Cl = HgCl3
Hg2+ + 4Cl = HgCl42
S2 + H+ = HS
S2 + 2H+ = H2S
Слайд 22
HgS = Hg2+ + S2
Hg2+ + Cl = HgCl+
Hg2+ + 2Cl = HgCl2
Hg2+ + 3Cl = HgCl3
Hg2+ + 4Cl = HgCl42
[Hg2+]
(Hg2+) = ——————————————————— [Hg2+]+[HgCl+]+[HgCl2]+[HgCl3]+[HgCl42]
Слайд 23
HgS = Hg2+ + S2
S2 + H+ = HS
S2 + 2H+ = H2S
[S2]
(S2) = —————————
[S2] + [HS] + [H2S]
Слайд 24
-коэффициенты служат мерой степени химических взаимодействий в системе подобно тому,
как коэффициенты активности служат мерой степени электростатических взаимодействий.
Слайд 25
Условная константа равновесия гомогенной реакции.
Связь с термодинамической
и концентрационной константами
Слайд 26
CCc · CDd
KpY
= —————CAa · CBb
KpY зависит от t, P, природы растворителя, ионной силы раствора и глубины протекания конкурирующих реакций
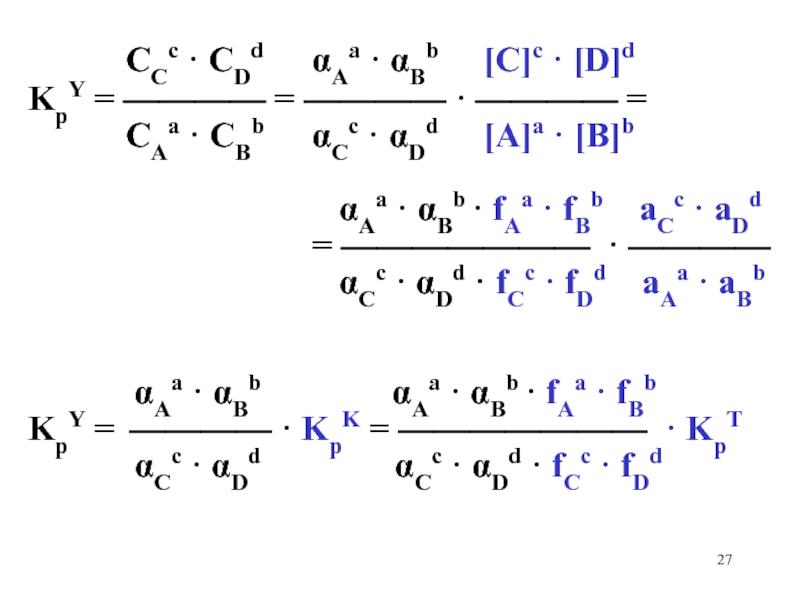
Слайд 27 CCc · CDd
Aa · Bb [C]c · [D]d
KpY = ———— = ———— · ———— =
CAa · CBb Cc · Dd [A]a · [B]b
Aa · Bb · fAa · fBb aCc · aDd
= ——————— · ————
Cc · Dd · fCc · fDd aAa · aBb
Aa · Bb Aa · Bb · fAa · fBb
KpY = ———— · KpK = ——————— · KpT
Cc · Dd Cc · Dd · fCc · fDd
Слайд 281. В реальной системе при наличии химических и электростатических взаимодействий
рассчитывается условная KpY
2. Если влиянием конкурирующих реакций пренебречь, то все
=1, тогда KY = KP , т.е. необходим учет только электростатических взаимодействий3. Если можно пренебречь электростатическими взаимодействиями (н-р, в очень разбавленных растворах), то все f=1 и KY = KP = KT
KK и KT отличаются на 1-2 порядка
KY и KK отличаются на 10 и более порядков
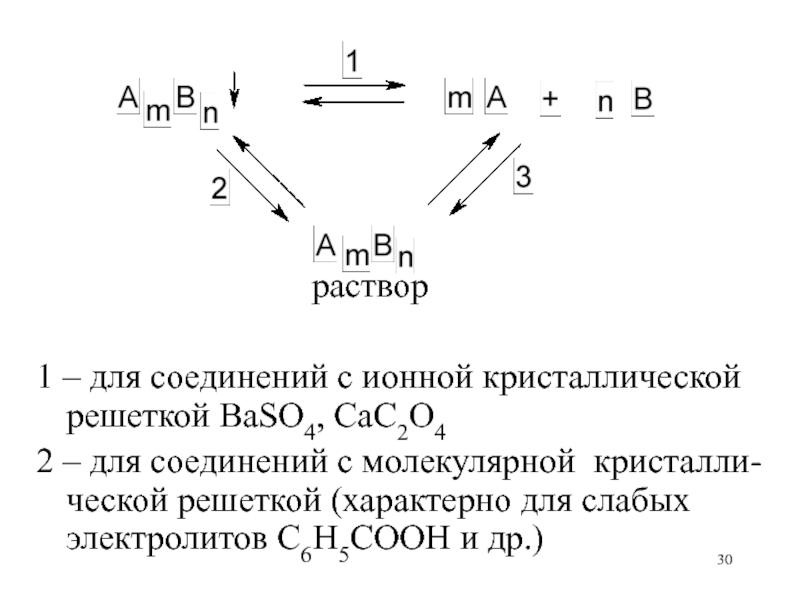
Слайд 30
раствор
1 – для соединений
с ионной кристаллической решеткой BaSO4, CaC2O42 – для соединений с молекулярной кристалли-ческой решеткой (характерно для слабых электролитов C6H5COOH и др.)
Слайд 32
Vп = kп · P
Vп – скорость растворения твердого вещества
P
– величина поверхности твердого тела
kп – константа скорости прямой реакции
Vo
= ko[A]m[B]nko – константа скорости обратной реакции
Слайд 33Vп = Vo
P = 0
kп = ko[A]m[B]n
kп /ko = [A]m[B]n
kп
/ko = Kp = ПР
ПР – константа равновесия гетерогенной реакции
ПР
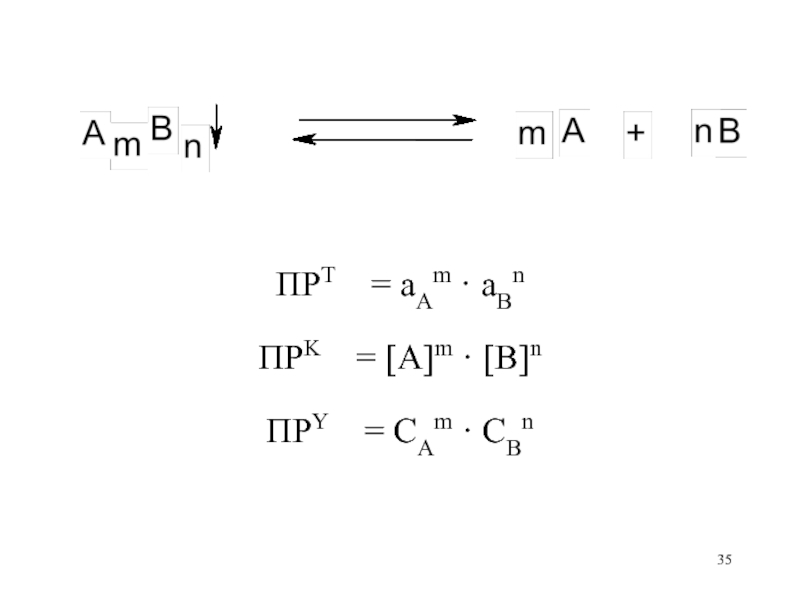
= [A]m[B]nСлайд 36
[A]m · [B]n
ПРKПРY = CAm · CBn = ———— = ———— =
Am · Bn Am · Bn
aAa · aBb ПРT
= ———————— = ————————
Am · Bn · fAm · fBn Am · Bn · fAm · fBn
[A] aA
CA= —— [A] = ——
A fA
[B] aB
CB= —— [B] = ——
B fB



![1
Закон действующих масс и его применение в аналитической химии Гомогенная реакцияVп = kп · [A]a · [B]bkп – константа скорости прямой реакции Гомогенная реакцияVп = kп · [A]a · [B]bkп – константа скорости прямой реакции](/img/thumbs/ee8bcbdc0bae9626241f937e794895bc-800x.jpg)
![1
Закон действующих масс и его применение в аналитической химии Vо = kо · [C]c · [D]dkо – константа скорости обратной реакции Vо = kо · [C]c · [D]dkо – константа скорости обратной реакции](/img/thumbs/7ace4dfea6fbcd270a9f22ce2031e020-800x.jpg)
![1
Закон действующих масс и его применение в аналитической химии При установившемся химическом равновесииVп = Vоkп · [A]a · [B]b = kо · [C]c · [D]d При установившемся химическом равновесииVп = Vоkп · [A]a · [B]b = kо · [C]c](/img/thumbs/22f77effb9e2516a67b5bd898826a1b9-800x.jpg)
![1
Закон действующих масс и его применение в аналитической химии kо · [C]c · [D]d1 = kо · [C]c · [D]d1 = ———————](/img/thumbs/71285ce9188c52d3f61dd01d65835bed-800x.jpg)


![1
Закон действующих масс и его применение в аналитической химии [C]c ·](/img/thumbs/105f9f8c12247b472aadd30485117f30-800x.jpg)


![1
Закон действующих масс и его применение в аналитической химии [C]c](/img/thumbs/e0728e45d0d34182ca31c9ac80c34ec2-800x.jpg)
![1
Закон действующих масс и его применение в аналитической химии [C]c](/img/thumbs/e1a4aa4195f529b83b9de3b3da891306-800x.jpg)
![1
Закон действующих масс и его применение в аналитической химии [C]c · [D]d aCc · [C]c · [D]d aCc ·](/img/thumbs/75b6a5f3037b2c651af15eb898f144df-800x.jpg)


![1
Закон действующих масс и его применение в аналитической химии CA = [A] + [A'] Аналогично: CB = [B] CA = [A] + [A'] Аналогично: CB = [B] + [B']](/img/thumbs/ea79d27b8d6175a09f00800a2b9c65f1-800x.jpg)
![1
Закон действующих масс и его применение в аналитической химии [A] [A]](/img/thumbs/00d0ca4ec4709b5993ae64ee1f4ccb53-800x.jpg)

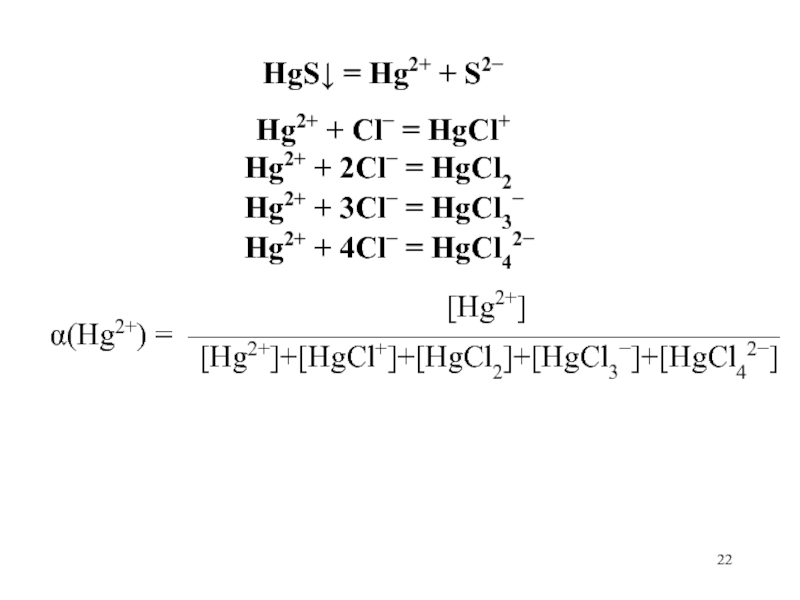
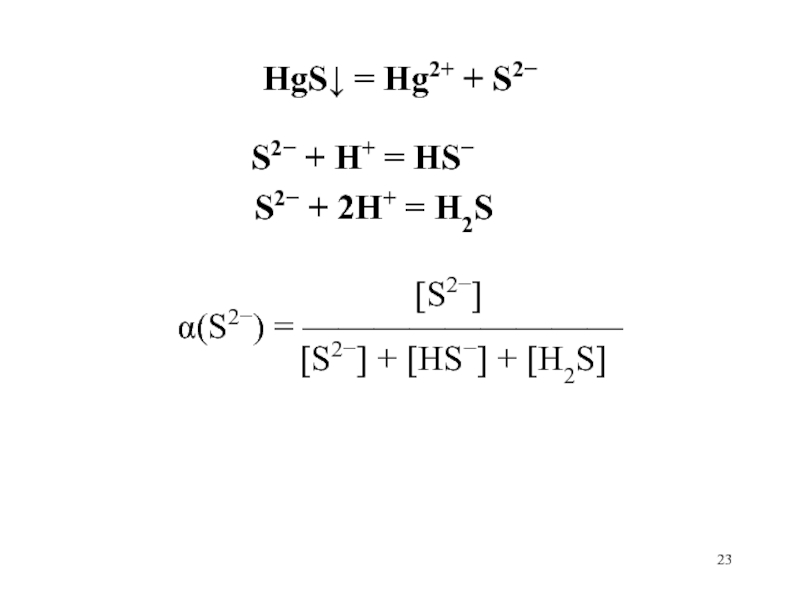





![1
Закон действующих масс и его применение в аналитической химии Vп = VoP = 0kп = ko[A]m[B]nkп /ko = [A]m[B]nkп /ko Vп = VoP = 0kп = ko[A]m[B]nkп /ko = [A]m[B]nkп /ko = Kp = ПРПР – константа](/img/thumbs/c437d22556336cdc11f8700f4ec235ed-800x.jpg)

![1
Закон действующих масс и его применение в аналитической химии [A]m ·](/img/thumbs/fda32d60b8b044c9c4b847f0cc8261c4-800x.jpg)