Слайд 2Оксиды – соединения элементов с кислородом, степень окисления кислорода в оксидах
всегда равна -2.
Оснóвные оксиды образуют типичные металлы со элементы I
и II а подгруппы, а так же с минимальной С.О. +1,+2 (Li2O, MgO, СаО,Cu2O и др.).
Кислотные оксиды образуют неметаллы со С.О. более +2 и металлы со С.О. от +5 до +7 (SO2, SeO2, Р2O5, As2O3, СO2,SiO2 , CrO3 и Mn2O7). Исключение: у оксидов NO2 и ClO2 нет соответствующих кислотных гидроксидов, но их считают кислотными.
Амфотерные оксиды образованы амфотерными металлами с промежуточными С.О. +2,+3,+4 (BeO, Cr2O3, ZnO, Al2O3, GeO2, SnO2 и РЬО).
Несолеобразующие оксиды – оксиды неметаллов со С.О.+1,+2 (СО, NO, N2O, SiO).
Слайд 3Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из иона металла (или иона
аммония) и гидроксогруппы (-OH).
Кислотные гидроксиды (кислоты) — сложные вещества, которые состоят
из атомов водорода и кислотного остатка.
Амфотерные гидроксиды образованы элементами с амфотерными свойствами.
Слайд 4Соли – сложные вещества, образованные атомами металлов, соединёнными с кислотными остатками.
Средние
(нормальные) соли — все атомы водорода в молекулах кислоты замещены на
атомы металла.
Слайд 5Кислые соли — атомы водорода в кислоте замещены атомами металла частично.
Они получаются при нейтрализации основания избытком кислоты. Чтобы правильно назвать кислую
соль, необходимо к названию нормальной соли прибавить приставку гидро- или дигидро- в зависимости от числа атомов водорода, входящих в состав кислой соли.
Например, KHCO3 – гидрокарбонат калия, КH2PO4 – дигидроортофосфат калия
Нужно помнить, что кислые соли могут образовывать только двух и более основные кислоты.
Слайд 6Осно́вные соли — гидроксогруппы основания (OH−) частично замещены кислотными остатками. Чтобы
назвать основную соль, необходимо к названию нормальной соли прибавить приставку гидроксо- или
дигидроксо- в зависимости от числа ОН — групп, входящих в состав соли.
Например, (CuOH)2CO3 — гидроксокарбонат меди (II).
Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп.
Слайд 7Двойные соли — в их составе присутствует два различных катиона, получаются
кристаллизацией из смешанного раствора солей с разными катионами, но одинаковыми
анионами. Например,KAl(SO4)2, KNaSO4.
Смешанные соли — в их составе присутствует два различных аниона. Например, Ca(OCl)Cl.
Гидратные соли (кристаллогидраты) — в их состав входят молекулы кристаллизационной воды. Пример: Na2SO4 ·10H2O.
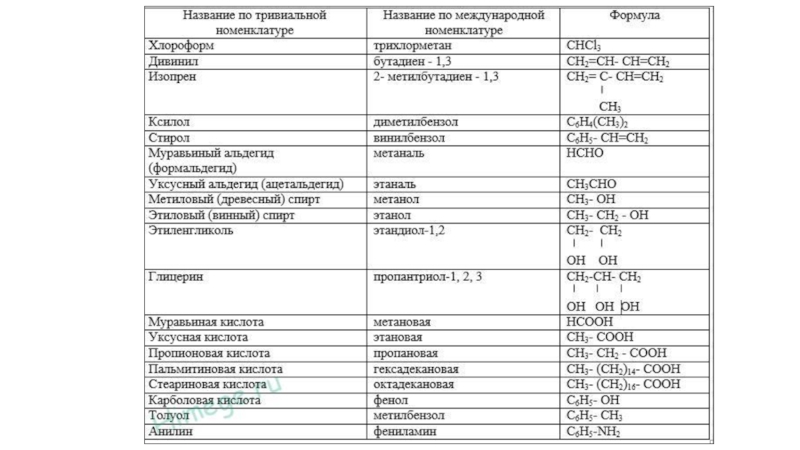
Слайд 9Углеводороды — это соединения, состоящие только из атомов водорода и углерода.
В
зависимости от строения углеродной цепи органические соединения разделяют на соединения
с открытой цепью — ациклические (алифатические) и циклические — с замкнутой цепью атомов.
Циклические делятся на две группы: карбоциклические соединения (циклы образованы только атомами углерода) и гетероциклические(в циклы входят и другие атомы, такие как кислород, азот, сера).
Карбоциклические соединения, в свою очередь, включают два ряда соединений: алицикличвские и ароматические.
Ароматические соединения в основе строения молекул имеют плоские углеродсодержащие циклы с особой замкнутой системой р-электронов, образующих общую π-систему (единое π-электронное облако). Ароматичность характерна и для многих гетероциклических соединений.
Все остальные карбоциклические соединения относятся к алициклическому ряду.
Слайд 10Как ациклические (алифатические), так и циклические углеводороды могут содержать кратные
(двойные или тройные) связи. Такие углеводороды называют непредельными (ненасыщенными) в
отличие от предельных (насыщенных), содержащих только одинарные связи.
Предельные алифатические углеводороды называют алканами, они имеют общую формулу СnН2n+2, где n — число атомов углерода. Старое их название часто употребляется и в настоящее время — парафины.
Непредельные алифатические углеводороды, содержащие одну двойную связь, получили название алкены. Они имеют общую формулу СnН2n.
Непредельные алифатические углеводороды с двумя двойными связями называют алкадиенами. Их общая формула СnН2n— 2.
Непредельные алифатические углеводороды с одной тройной связью называют алкинами. Их общая формула СnН2n—2.
Предельные алициклические углеводороды — циклоалканы, их общая формула СnН2n.
Слайд 11Особая группа углеводородов, ароматических, или аренов (с замкнутой общей π-электронной системой), известна из
примера углеводородов с общей формулой СnН2n-6.
Таким образом, если в их
молекулах один или большее число атомов водорода заменить на другие атомы или группы атомов (галогены, гидроксильные группы, аминогруппы и др.), образуются производные углеводородов: галогенопроизводные, кислородсодержащие, азотсодержащие и другие органические соединения.
Слайд 12 Галогенопроизводные углеводородов можно рассматривать как продукты замещения в углеводородах одного или
нескольких атомов водорода атомами галогенов. В соответствии с этим могут
существовать предельные и непредельные моно-, ди-, три- (в общем случае поли-) галогенопроизводные.
Общая формула моногалогенопроизводных предельных углеводородов:
R-Г,
а состав выражается формулой
CnH2n+1Г,
где R — остаток от предельного углеводорода (алкана), углеводородный радикал (это обозначение используется и далее при рассмотрении других классов органических веществ), Г — атом галогена (F, Сl, Вг, I).
Слайд 13К кислородсодержащим органическим веществам относят спирты, фенолы, альдегиды, кетоны, карбоновые
кислоты, простые и сложные эфиры.
Спирты — производные углеводородов, в которых один
или несколько атомов водорода замещены на гидроксильные группы.
Спирты называют одноатомными, если они имеют одну гидроксильную группу, и предельными, если они являются производными алканов.
Общая формула предельных одноатомных спиртов:
R-OH,
а их состав выражается общей формулой:
СnН2n+1ОН или СnН2n+2О
Известны примеры многоатомных спиртов, т. е. имеющих несколько гндроксильных групп.
Слайд 14Фенолы — производные ароматических углеводородов (ряда бензола), в которых один или
несколько атомов водорода в бензольном кольце замещены на гидроксильные группы.
Простейший
представитель с формулой С6Н5ОН называется фенолом.
Слайд 15Альдегиды и кетоны — производные углеводородов, содержащие карбонильную группу атомов (карбонил).
В
молекулах альдегидов одна связь карбонила идет на соединение с атомом
водорода, другая — с углеводородным радикалом.
В случае кетонов карбонильная группа связана с двумя (в общем случае разными) радикалами.
Состав предельных альдегидов и кетонов выражается формулой СnН2лО.
Слайд 16Простые эфиры представляют собой органические вещества, содержащие два углеводородных радикала, соединенных
атомом кислорода: R—О—R или R1-O-R2.
Радикалы могут быть одинаковыми или разными.
Состав простых эфиров выражается формулой СnН2n+2O
Сложные эфиры — соединения, образованные замещением атома водорода карбоксильной группы в карбоновых кислотах на углеводородный радикал.
Из азотсодержащих органических веществ известны нитро соединения, амины и аминокислоты.
Слайд 17Карбоновые кислоты — производные углеводородов, содержащие карбоксильные группы (—СООН).
Если в молекуле
кислоты одна карбоксильная группа, то карбоновая кислота является одноосновной. Общая
формула предельных одноосновных кислот (R-СООН). Их состав выражается формулой СnН2nO2.
Слайд 18Нитросоединения — производные углеводородов, в которых один или несколько атомов водорода
замещены на нитрогруппу —NO2.
Общая формула предельных мононитросоединений:
R-NO2,
а состав выражается общей
формулой
СnН2n+1NO2.
Слайд 19Амины — соединения, которые рассматривают как производные аммиака (NН3), в котором
атомы водорода замещены на углеводородные радикалы.
В зависимости от природы радикала
амины могут быть алифатическими и ароматическими.
В зависимости от числа замещенных на радикалы атомов водорода различают:
• первичные амины с общей формулой: R-NН2
• вторичные — с общей формулой: R1-NН-R2
• третичные — с общей формулой:
R1-NR2-R3
В частном случае у вторичных, а также третичных аминов радикалы могут быть и одинаковыми.
Первичные амины можно также рассматривать как производные углеводородов (алканов), в которых один атом водорода замещен на аминогруппу —NН2. Состав предельных первичных аминов выражается формулой СnН2n+3N.
Слайд 20Аминокислоты содержат две функциональные группы, соединенные с углеводородным радикалом: аминогруппу —NН2,
и карбоксил —СООН.
Состав предельных аминокислот, содержащих одну аминогруппу и один
карбоксил, выражается формулой СnН2n+1NO2.
Известны и другие важные органические соединения, которые имеют несколько разных или одинаковых функциональных групп, длинные линейные цепи, связанные с бензольными кольцами. В таких случаях строгое определение принадлежности вещества к какому-то определенному классу невозможно. Эти соединения часто выделяют в специфические группы веществ: углеводы, белки, нуклеиновые кислоты, антибиотики, алкалоиды и др.