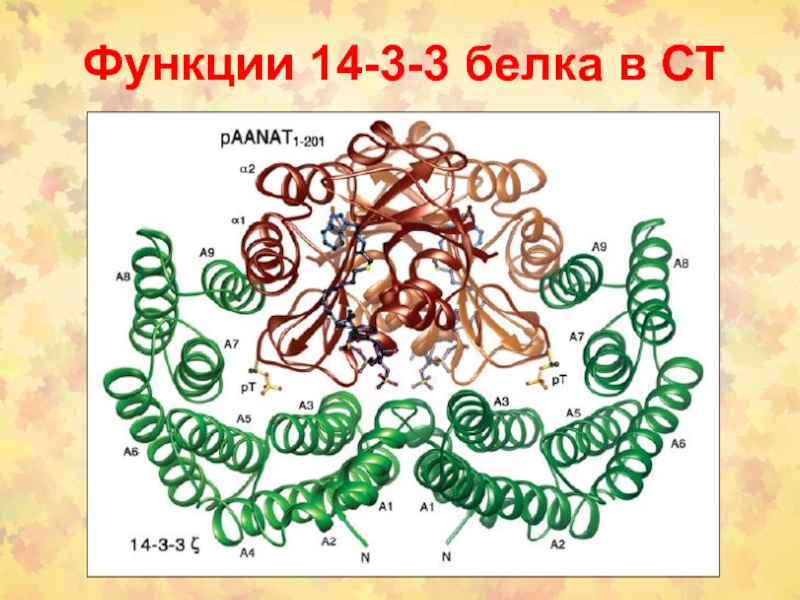
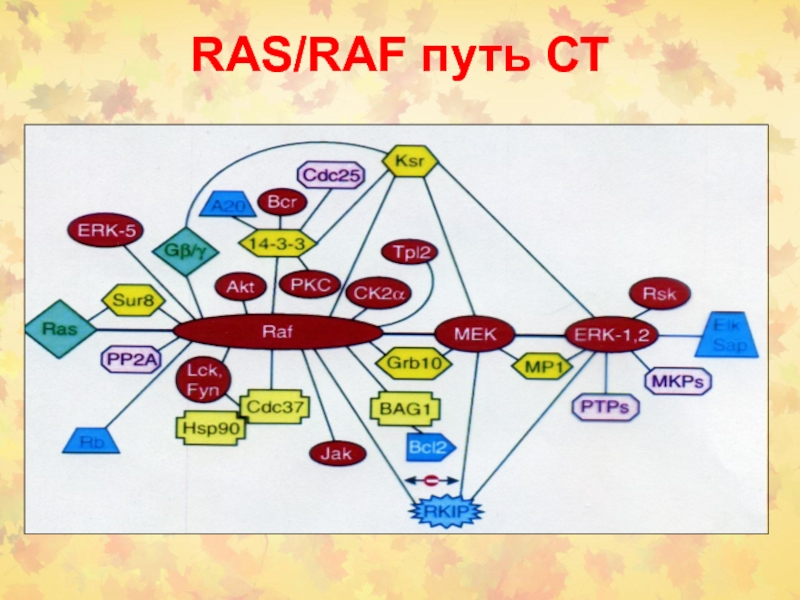
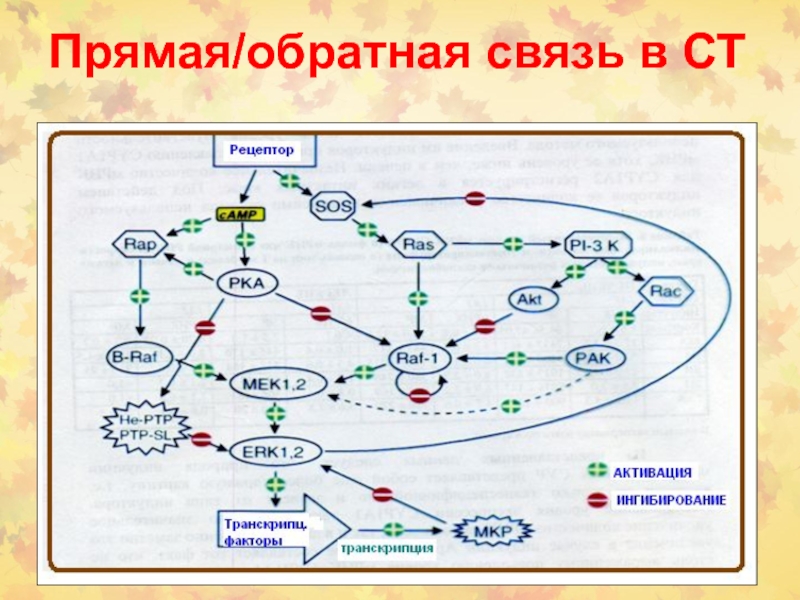
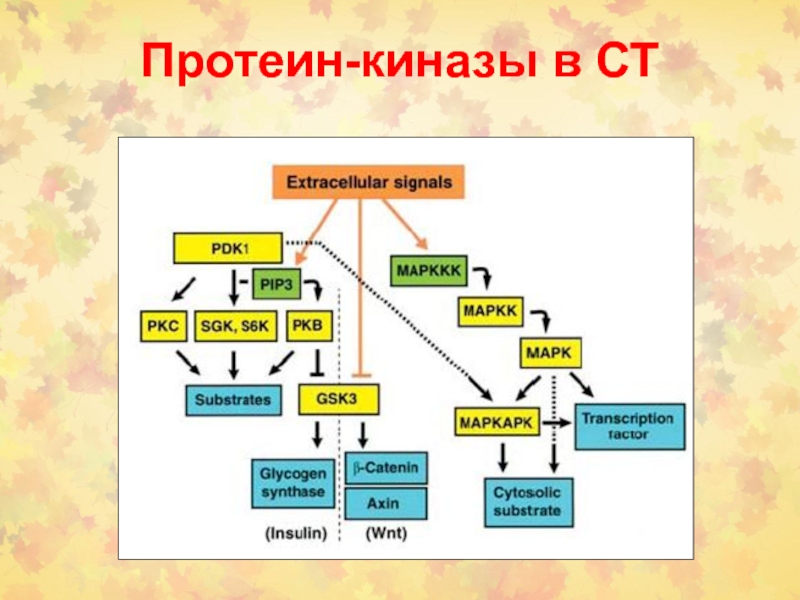
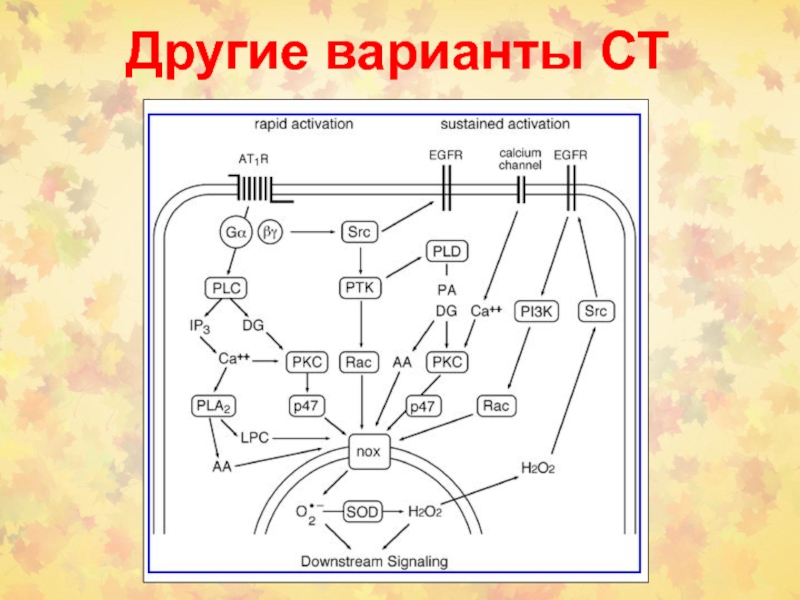
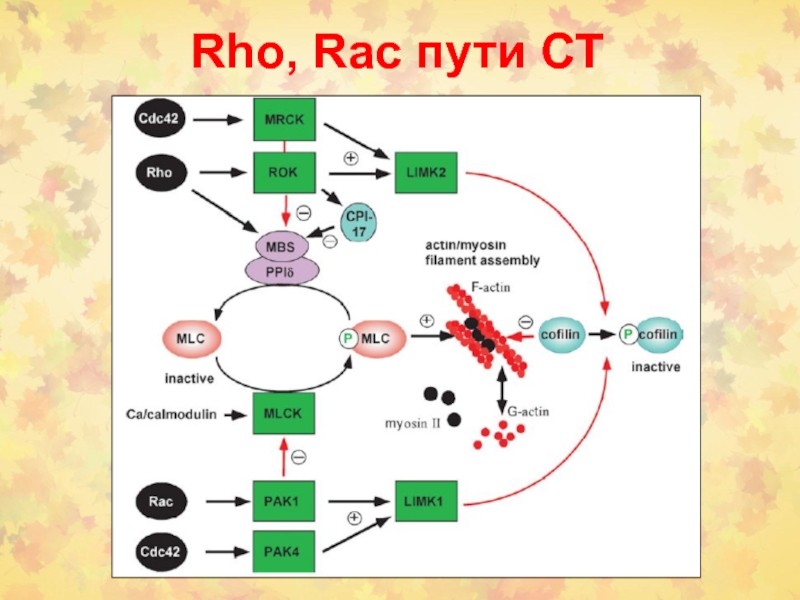
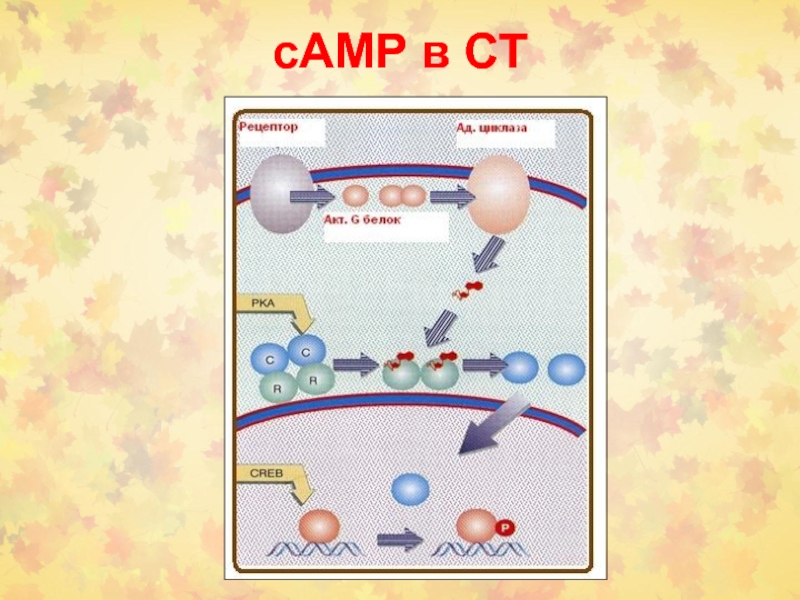
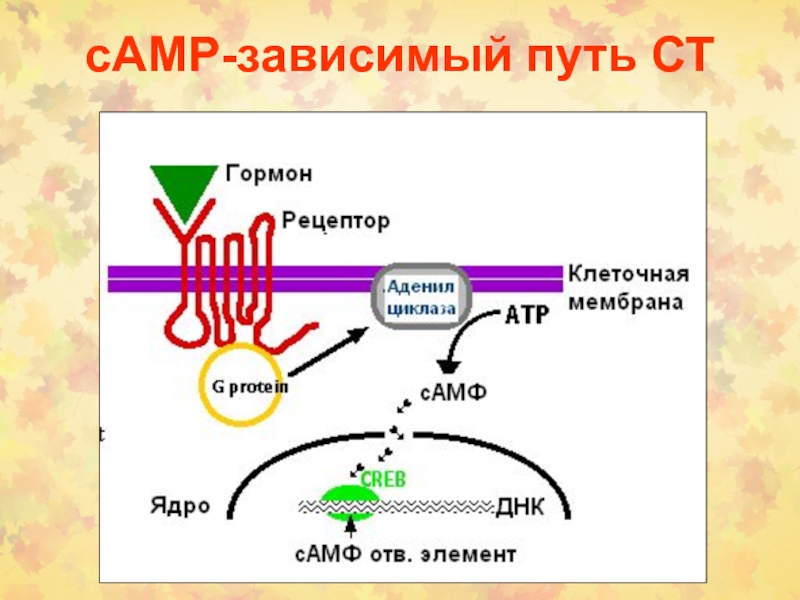
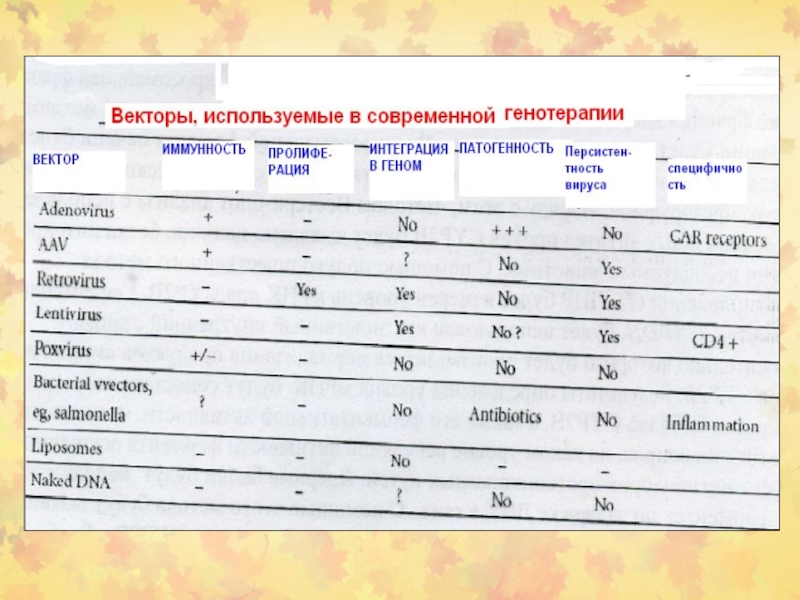
Слайд 1 5.2.1.
Ассоциированные с мембраной белки
(на примере RAS и SRC)
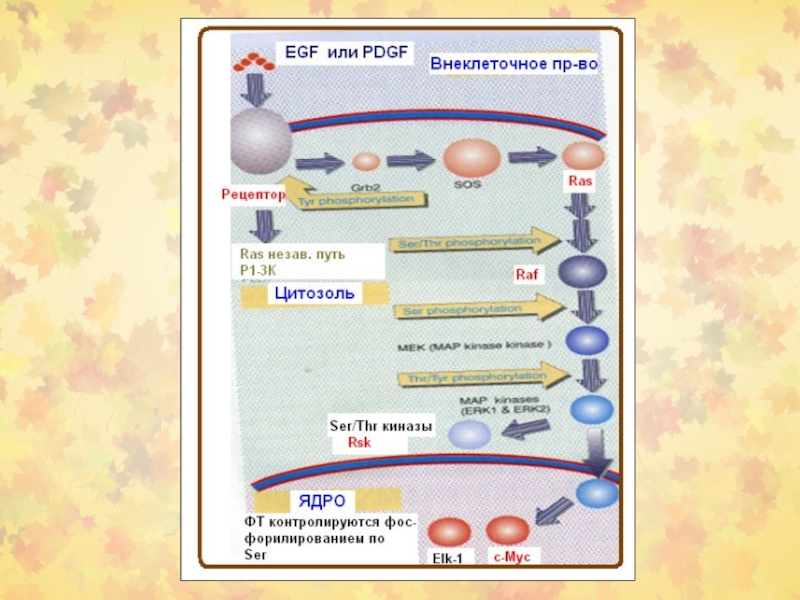
Слайд 2Фосфорилирование рецептора приводит к двум последствиям:
1. Фосфорилирование усиливает киназную активность
рецептора по типу положительной обратной связи.
2. Фосфорилирование тирозиновых остатков в
цитоплазматических доменах обеспечивает прохождение сигнала к следующему этапу сигнальной трансдукции.
Различают 3 типа белков, с которыми может взаимодействовать активированный рецептор:
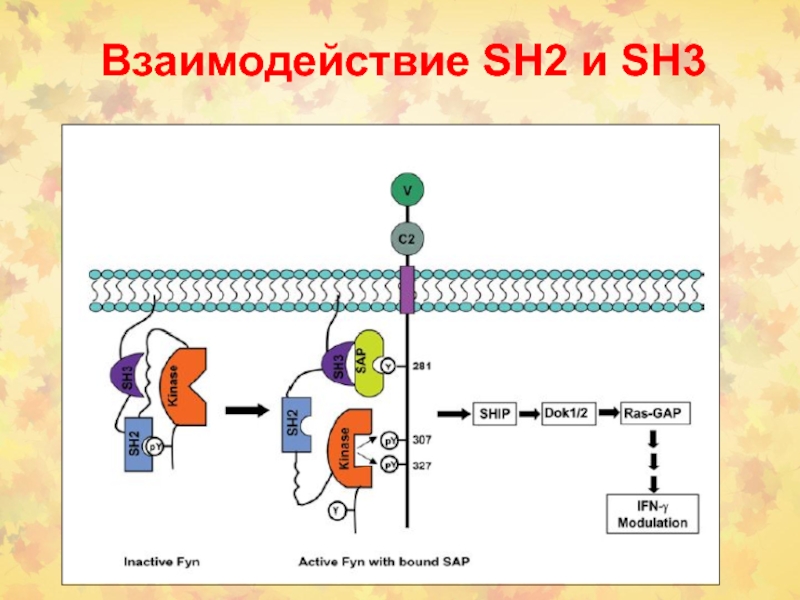
- Белок может быть мишенью для рецептора, если он сам не фосфорилирован. Мишень может быть также адаптерной молекулой, т.е. сама не обладать каталитической активностью (например, Grb-2) или быть ферментом, который активируется связыванием с рецептором (например, PI-3 киназа).
- Белок является субстратом для фермента, который его фосфорилирует. Если субстрат сам является ферментом, то он активируется фосфорилированием (например, c-src, PLCγ). Иногда субстрат – это киназа, тогда сигнальная трансдукции продолжается каскадом киназ.
- Некоторые субстраты могут быть концевыми мишенями, как в случае с цитоскелетными белками, которые фосфорилируются с изменением их биохимических свойств, что сопровождается появлением новых клеточных структур. Этот механизм работает, например, в митозе, когда появляется веретено для разделения хромосом.

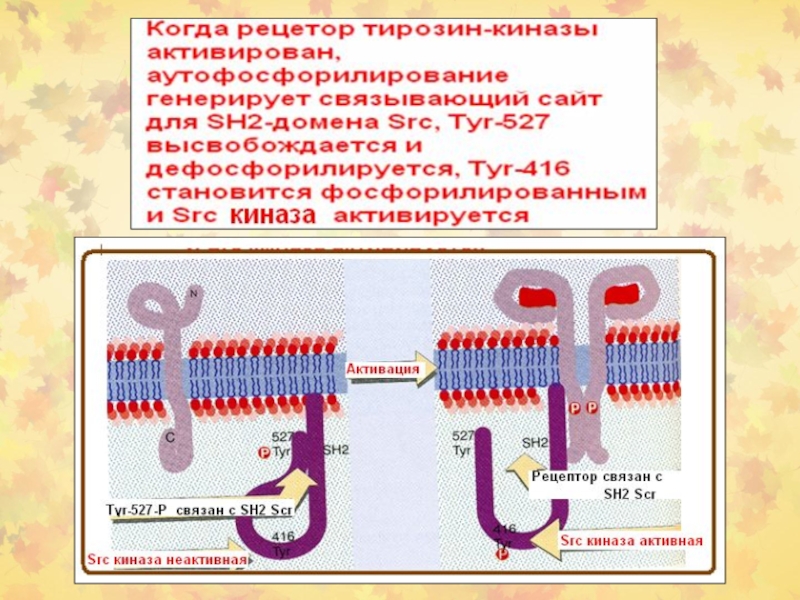
Слайд 3Семейство Src-киназ
Прототипом семейства Src-киназ является белок c-Src (pp60c-src), впервые открытый
как онкоген. Однако считается, что оригинальным белком этого семейства был
его вирусный аналог, открытый Раусом в ранние 1900-ые годы. Раус описал трансформирующий фактор, присутствующий в тканях саркомы цыплят, который индуцировал опухоль у здоровых цыплят после инъекции тканевого гомогената. Этот фактор позднее стал известен как вирус саркомы Рауса, содержащий вирусный онкоген Scr. Клеточный аналог этого онкогена или протоонкоген впервые был охарактеризован Майклом Бишопом и Гарольдом Вармусом, за открытие которого в 1989 г. они получили Нобелевскую премию.
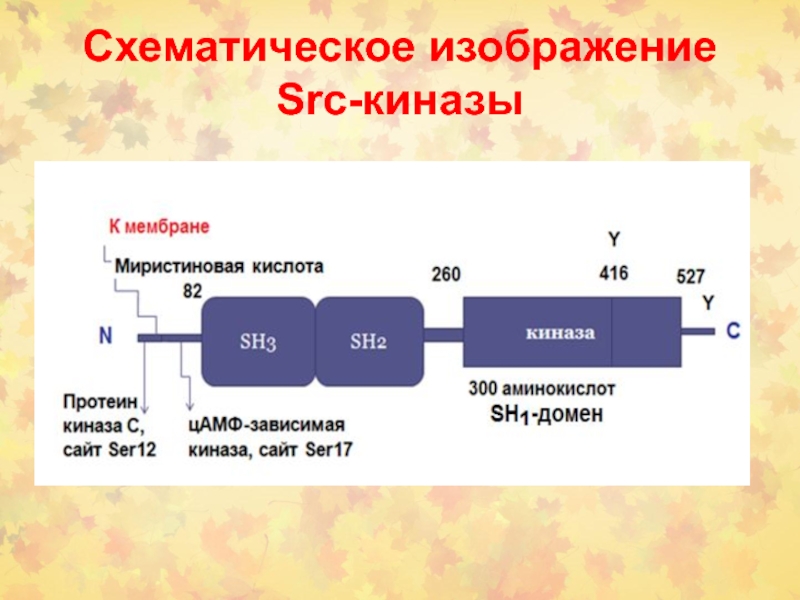
Слайд 4
Схематическое изображение Src-киназы
Слайд 8Семейство белков RAS
Суперсемейство RAS состоит из нескольких семейств белков:
RAS, RHO, RAB, ARF, RAC и RAN. Наиболее изученным из
низ являются белки RAS. Геном млекопитающих содержит 3 гена RAS, кодирующих небольшие ГТФ-азные белки молекулярной массой 21 kDa, обозначаемые как H-RAS (Harvey-RAS), N-RAS (neuroblastoma-RAS) и K-RAS (Kristen-RAS), последний имеет две изоформы K-RAS4A и K-RAS4B, образуемые через альтернативный сплайсинг. KRAS4A слабо экспрессируется в клетках человека, в отличие от KRAS4B, который является доминантной формой. Кроме того, в геноме млекопитающих было идентифицировано более чем 150 RAS-подобных гена.
Белки этого семейства также регулируют многие физиологические процессы, пролиферацию, дифференцировку и выживание клетки.
Слайд 10
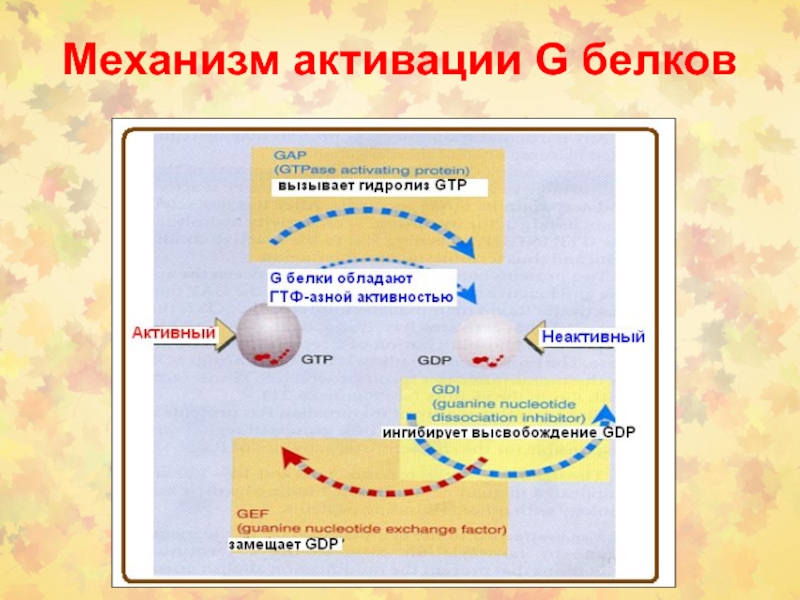
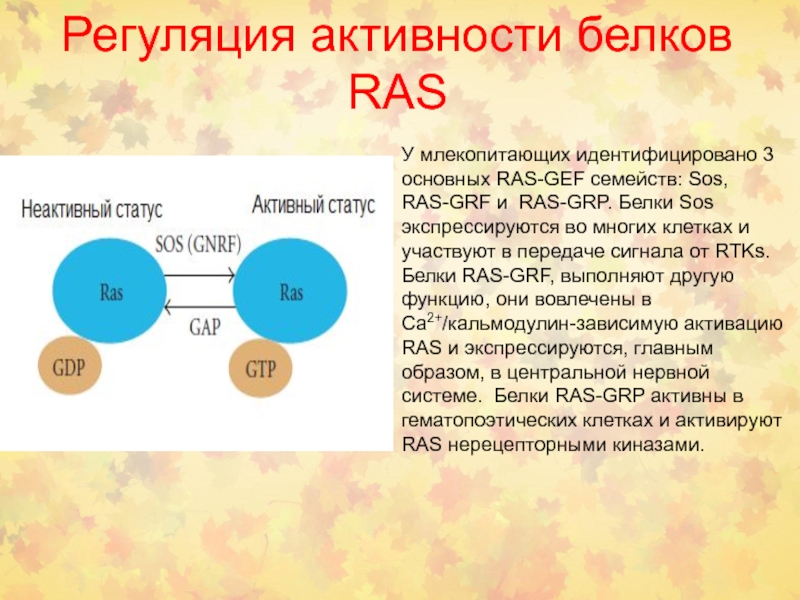
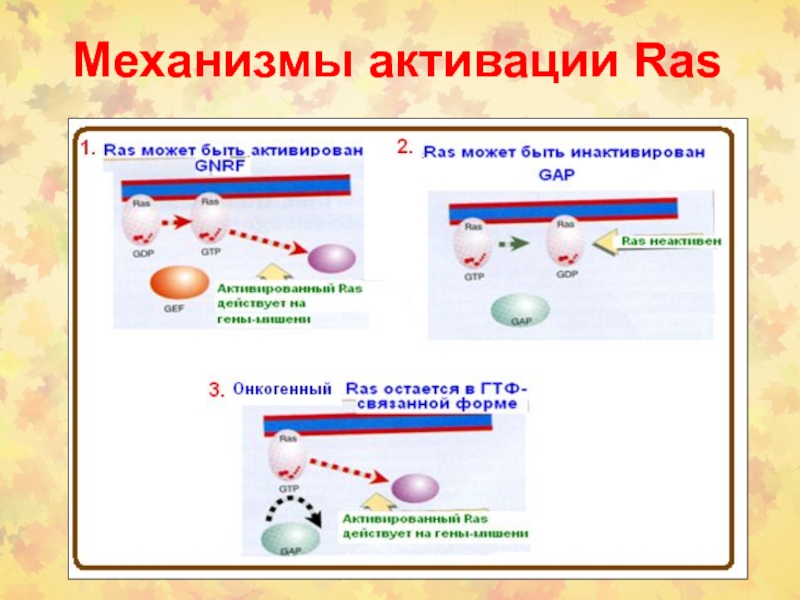
Регуляция активности белков RAS
У млекопитающих идентифицировано 3 основных RAS-GEF
семейств: Sos, RAS-GRF и RAS-GRP. Белки Sos экспрессируются во многих
клетках и участвуют в передаче сигнала от RTKs. Белки RAS-GRF, выполняют другую функцию, они вовлечены в Са2+/кальмодулин-зависимую активацию RAS и экспрессируются, главным образом, в центральной нервной системе. Белки RAS-GRP активны в гематопоэтических клетках и активируют RAS нерецепторными киназами.
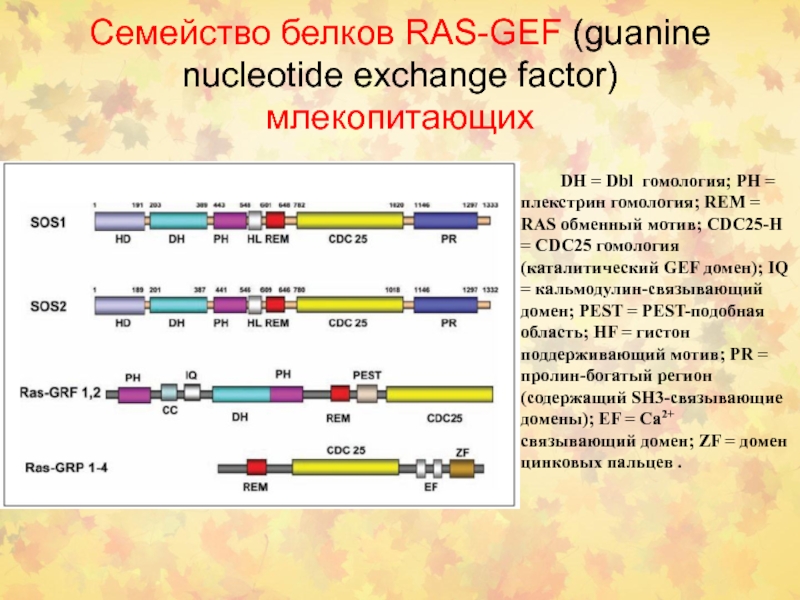
Слайд 12Семейство белков RAS-GEF (guanine nucleotide exchange factor) млекопитающих
DH = Dbl
гомология; PH = плекстрин гомология; REM = RAS обменный мотив;
CDC25-H = CDC25 гомология (каталитический GEF домен); IQ = кальмодулин-связывающий домен; PEST = PEST-подобная область; HF = гистон поддерживающий мотив; PR = пролин-богатый регион (содержащий SH3-связывающие домены); EF = Ca2+ связывающий домен; ZF = домен цинковых пальцев .
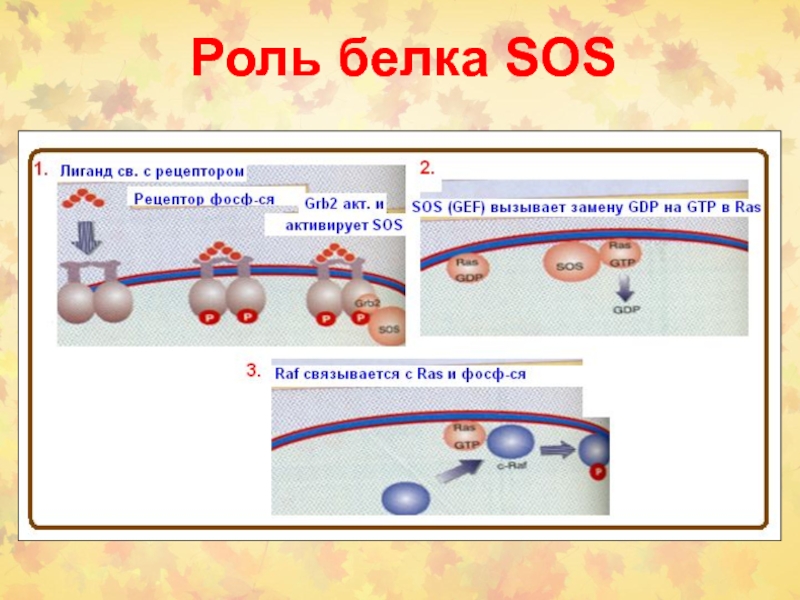
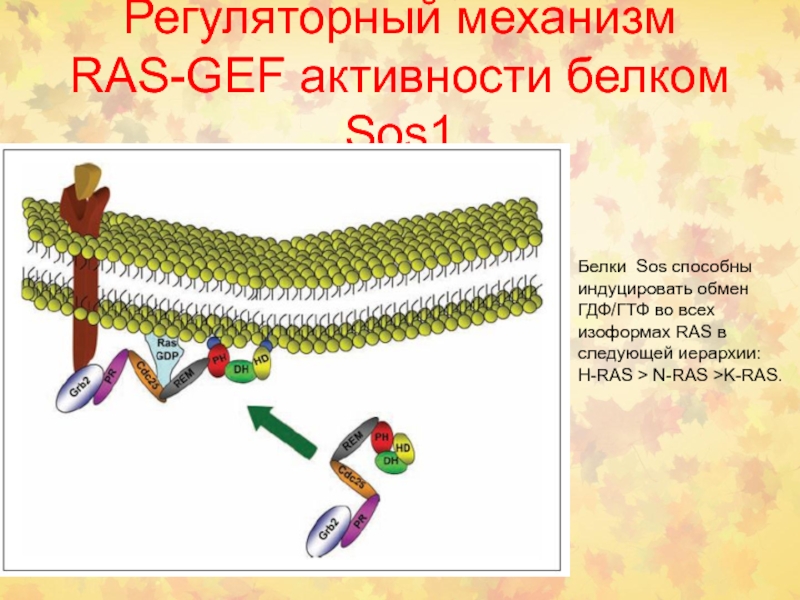
Слайд 14Регуляторный механизм RAS-GEF активности белком Sos1
Белки Sos способны индуцировать обмен
ГДФ/ГТФ во всех изоформах RAS в следующей иерархии:
H-RAS >
N-RAS >K-RAS.
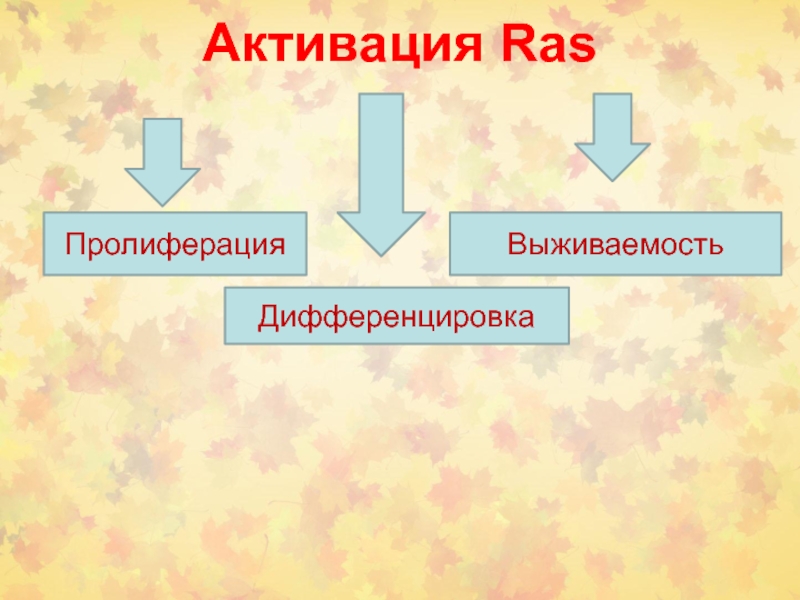
Слайд 15Активация Ras
Пролиферация
Дифференцировка
Выживаемость
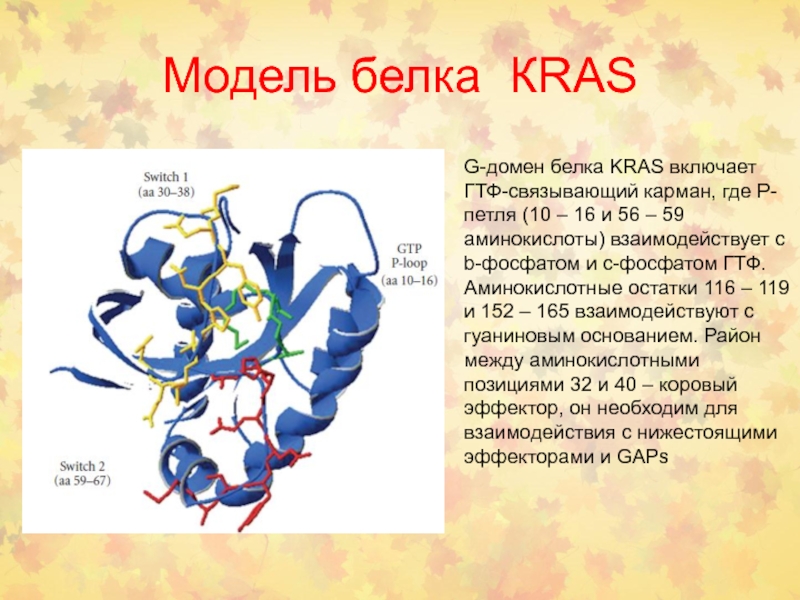
Слайд 16Модель белка КRAS
G-домен белка KRAS включает ГТФ-связывающий карман, где Р-петля
(10 – 16 и 56 – 59 аминокислоты) взаимодействует с
b-фосфатом и c-фосфатом ГТФ. Аминокислотные остатки 116 – 119 и 152 – 165 взаимодействуют с гуаниновым основанием. Район между аминокислотными позициями 32 и 40 – коровый эффектор, он необходим для взаимодействия с нижестоящими эффекторами и GAPs
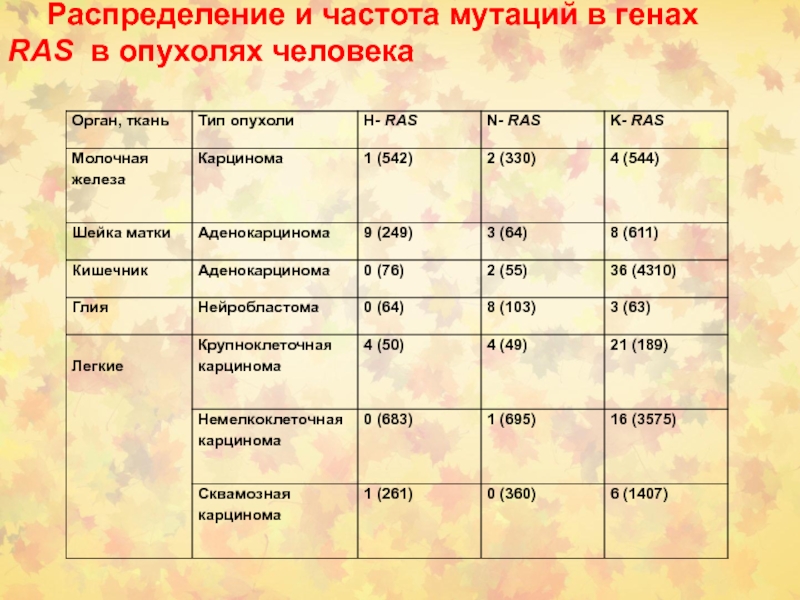
Слайд 18Распределение и частота мутаций в генах
RAS в опухолях человека
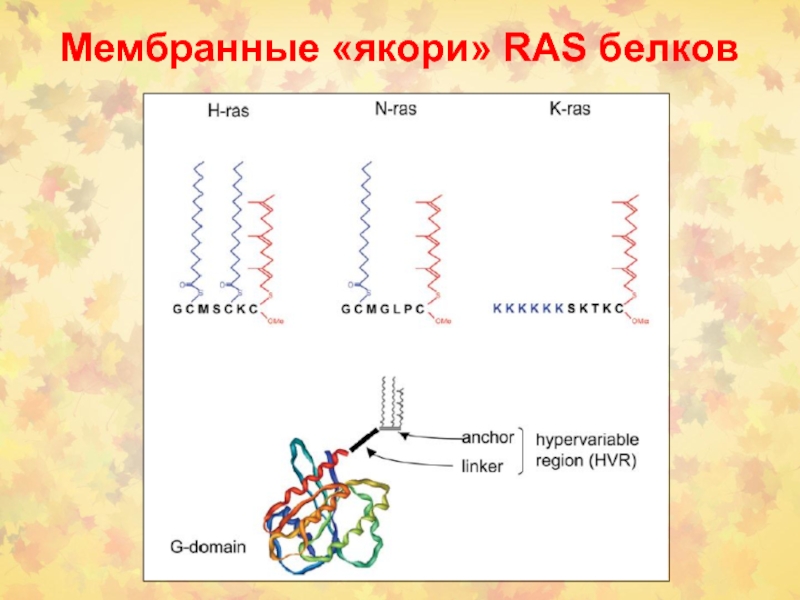
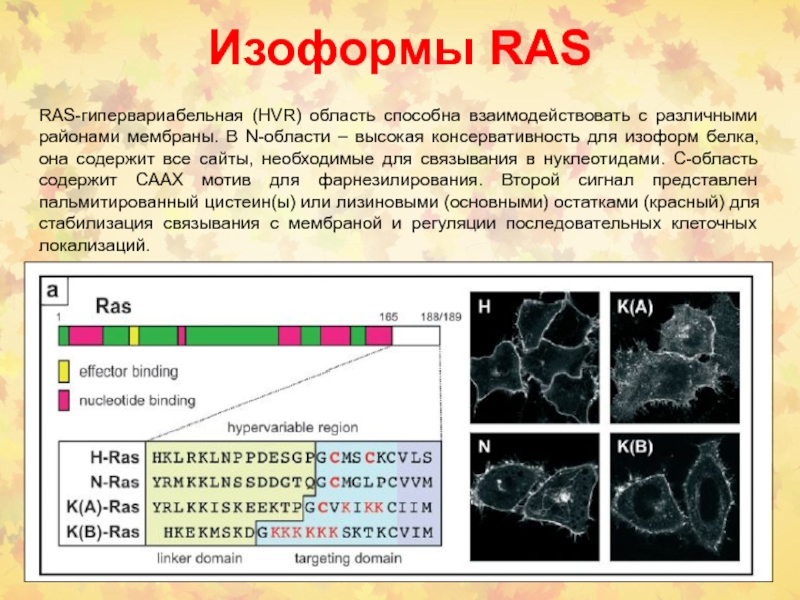
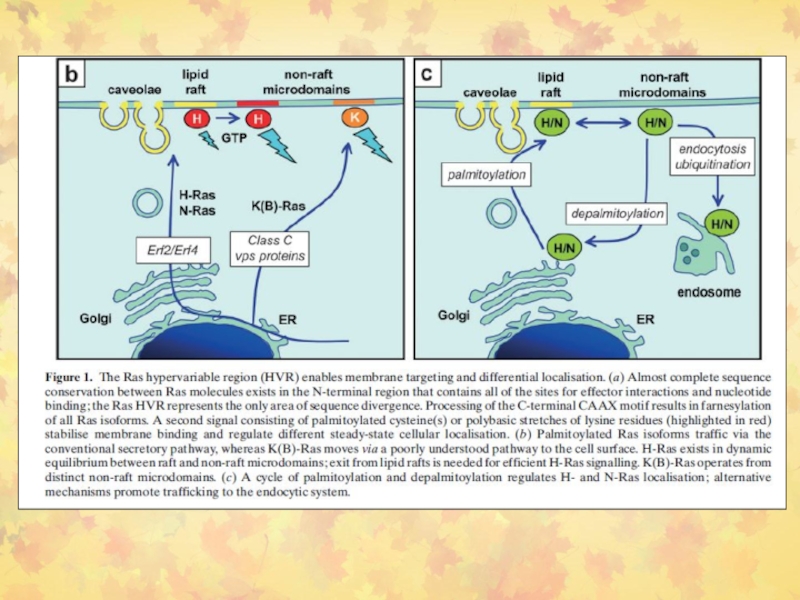
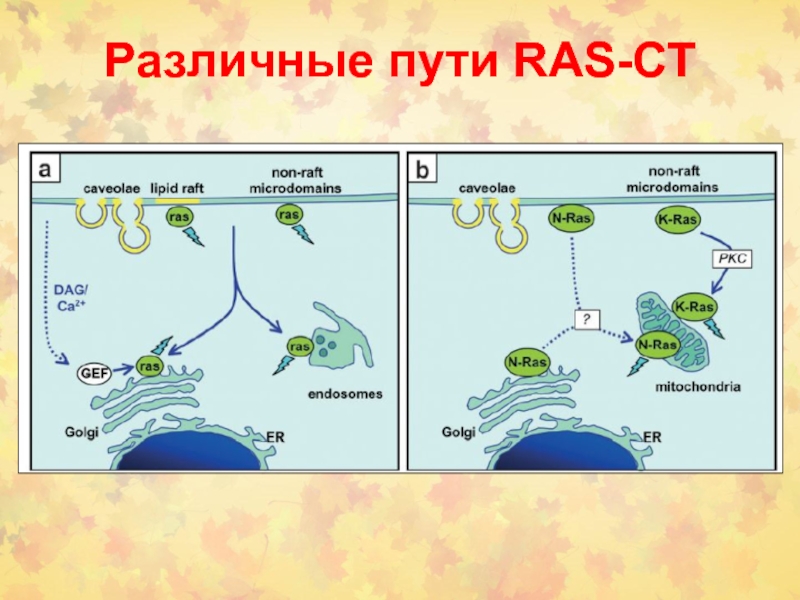
Слайд 20Изоформы RAS
RAS-гипервариабельная (HVR) область способна взаимодействовать с различными районами мембраны.
В N-области – высокая консервативность для изоформ белка, она содержит
все сайты, необходимые для связывания в нуклеотидами. C-область содержит СААХ мотив для фарнезилирования. Второй сигнал представлен пальмитированный цистеин(ы) или лизиновыми (основными) остатками (красный) для стабилизация связывания с мембраной и регуляции последовательных клеточных локализаций.
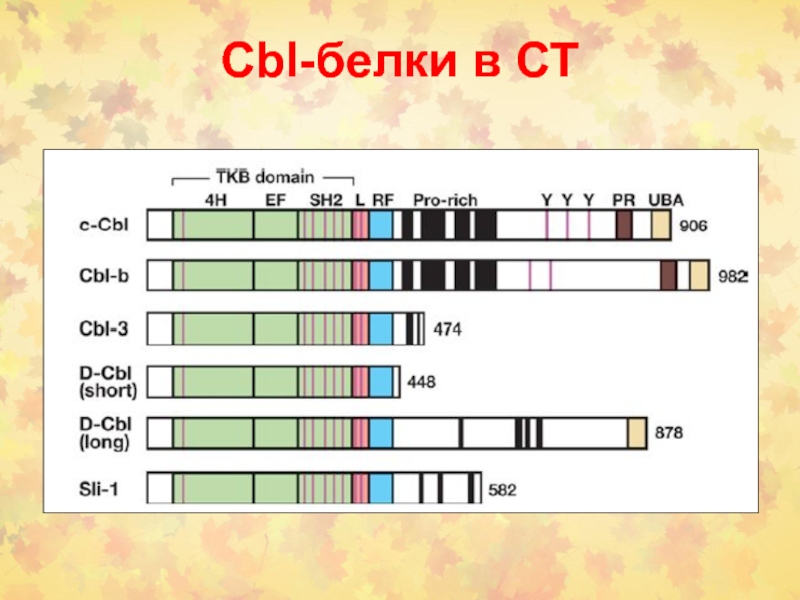
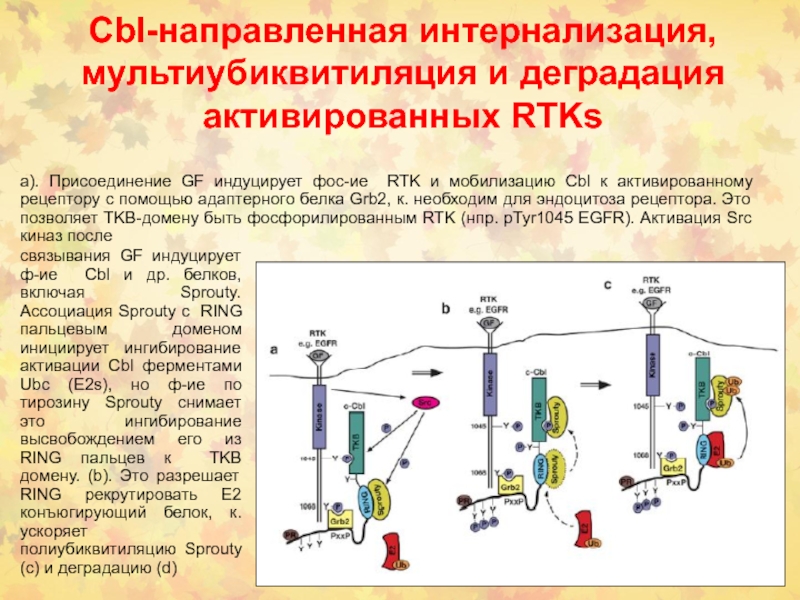
Слайд 27Cbl-направленная интернализация, мультиубиквитиляция и деградация активированных RTKs
а). Присоединение GF индуцирует
фос-ие RTK и мобилизацию Cbl к активированному рецептору с помощью
адаптерного белка Grb2, к. необходим для эндоцитоза рецептора. Это позволяет TKB-домену быть фосфорилированным RTK (нпр. pTyr1045 EGFR). Активация Src киназ после
связывания GF индуцирует ф-ие Cbl и др. белков, включая Sprouty. Ассоциация Sprouty с RING пальцевым доменом инициирует ингибирование активации Cbl ферментами Ubc (E2s), но ф-ие по тирозину Sprouty снимает это ингибирование высвобождением его из RING пальцев к TKB домену. (b). Это разрешает RING рекрутировать E2 конъюгирующий белок, к. ускоряет полиубиквитиляцию Sprouty (с) и деградацию (d)
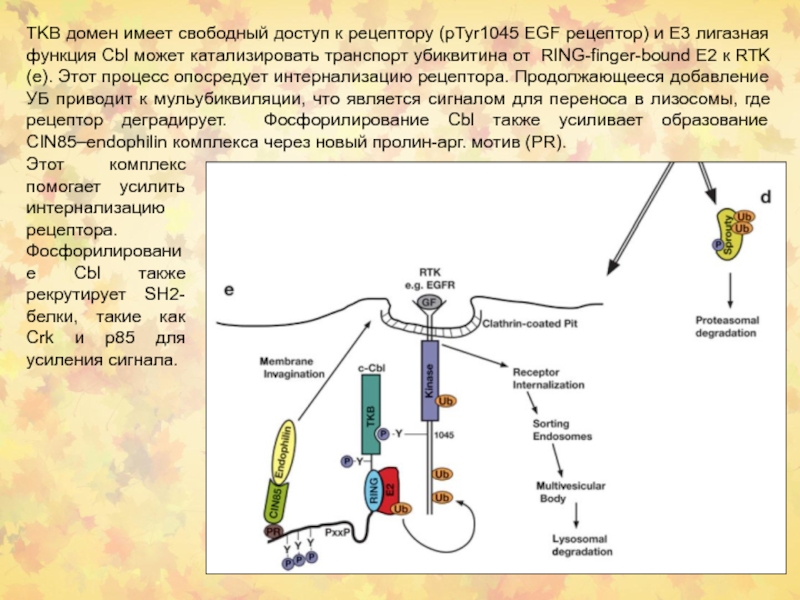
Слайд 28TKB домен имеет свободный доступ к рецептору (pTyr1045 EGF рецептор)
и E3 лигазная функция Cbl может катализировать транспорт убиквитина от
RING-finger-bound E2 к RTK (e). Этот процесс опосредует интернализацию рецептора. Продолжающееся добавление УБ приводит к мульубиквиляции, что является сигналом для переноса в лизосомы, где рецептор деградирует. Фосфорилирование Cbl также усиливает образование CIN85–endophilin комплекса через новый пролин-арг. мотив (PR).
Этот комплекс помогает усилить интернализацию рецептора. Фосфорилирование Cbl также рекрутирует SH2-белки, такие как Crk и p85 для усиления сигнала.
Слайд 29
5.2.2. Цитозольные белки
(RAF и MAP)
Цитозольные белки принимают
сигнал от вышестоящих мембрано-ассоциированных белков, от рецепторов или адаптеров.
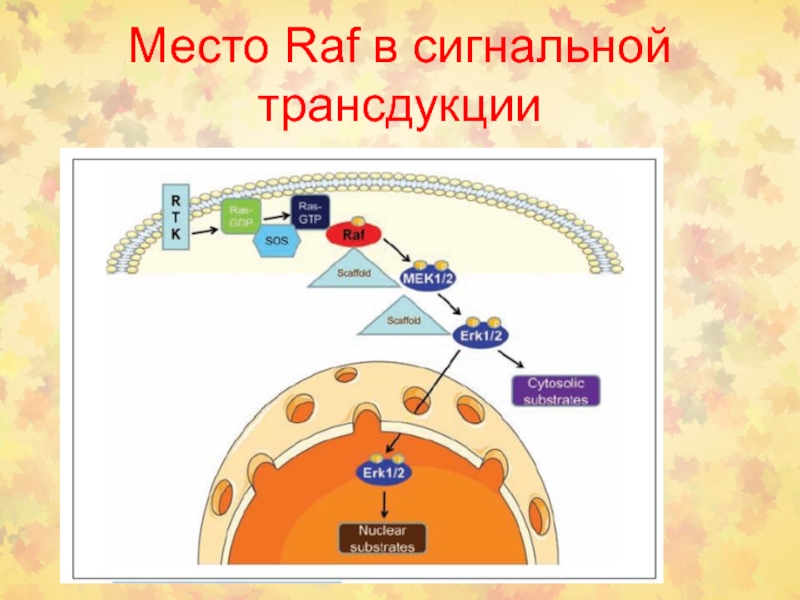
Слайд 31Место Raf в сигнальной трансдукции
Слайд 33Семейство белков Raf
Белки Raf были идентифицированы как прямые активаторы белков
MEK и эффекторы Ras.
Таким образом, стало ясно, что Raf
являются основным связывающим звеном между Ras- и MEK-ERK-сигнальными участками. Интересно, что у дрожжей нет Raf-киназы, а филогенетически древняя изоформа этого белка B-Raf появилась у позвоночных. У млекопитающих выявлено 3 изоформы Raf: Raf-1, B-Raf и A-Raf, которые имеют общую консервативную область (CR), но проявляют разные свойства . В свою очередь, CR область состоит из 3-х участков: CR1, CR2, CR3.
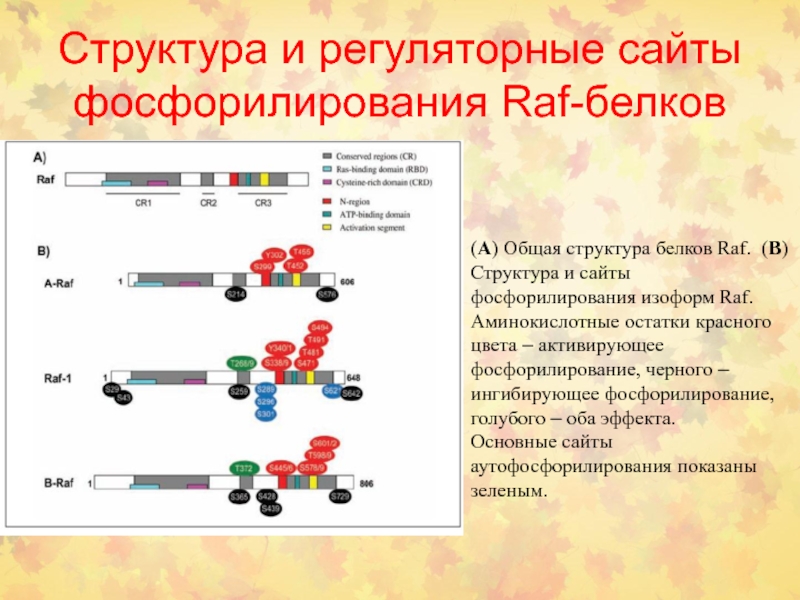
Слайд 34Структура и регуляторные сайты фосфорилирования Raf-белков
(A) Общая структура белков
Raf. (B) Структура и сайты фосфорилирования изоформ Raf. Аминокислотные остатки
красного цвета – активирующее фосфорилирование, черного – ингибирующее фосфорилирование, голубого – оба эффекта.
Основные сайты аутофосфорилирования показаны зеленым.
Слайд 41
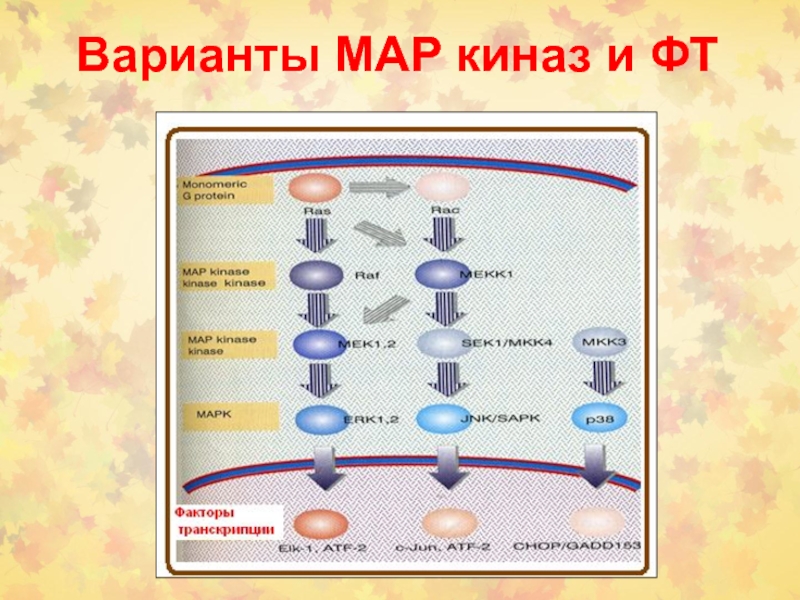
Активированные белки Raf передают сигнал к нижестоящим цитозольным белкам MAP
(mitogen active protein) или MAPK (MAP kinase), которые объединяются в
семейство МЕК. Эта группа включает 4 различных каскада, которые называются по компоненте, стоящей после МАР киназы.
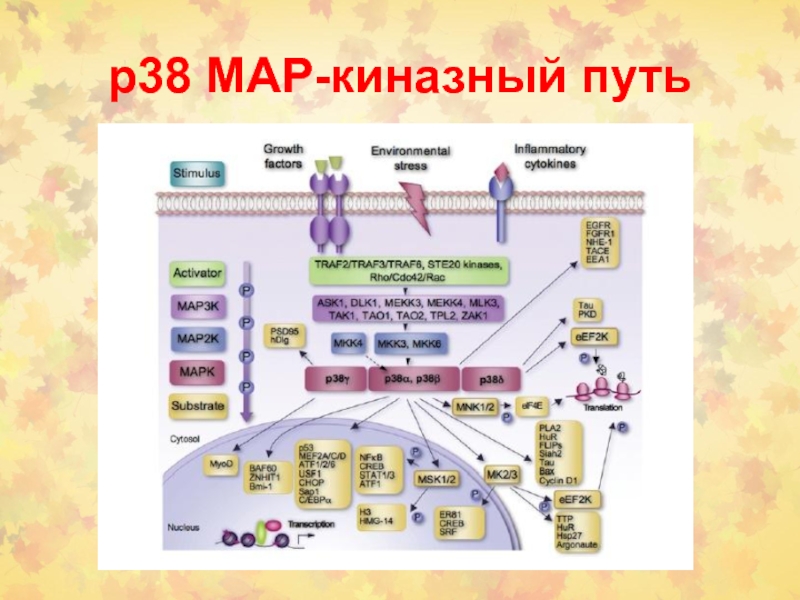
Характеристика МАР киназ
ERK1/2 каскад передает,
г.о., митогенные сигналы,
P38 и JNK – активированные стрессом, ERK5 – оба пути
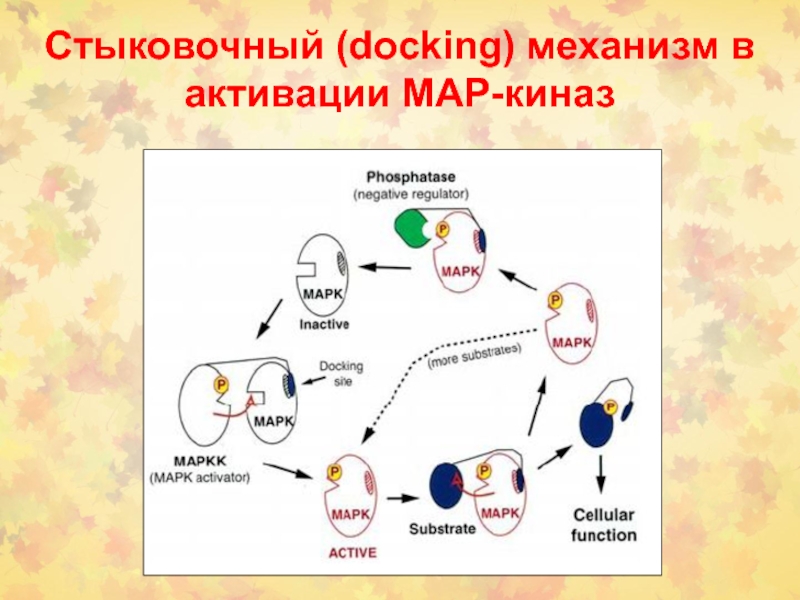
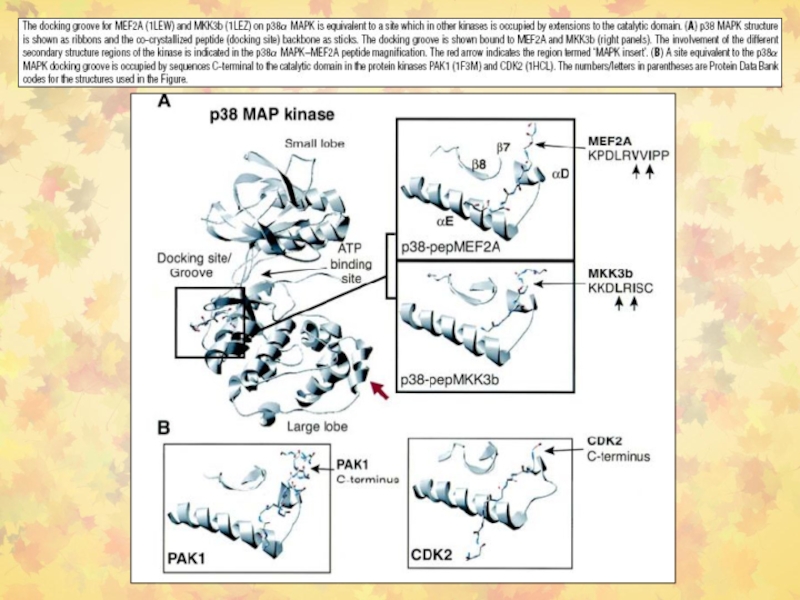
Слайд 43Стыковочный (docking) механизм в активации МАР-киназ
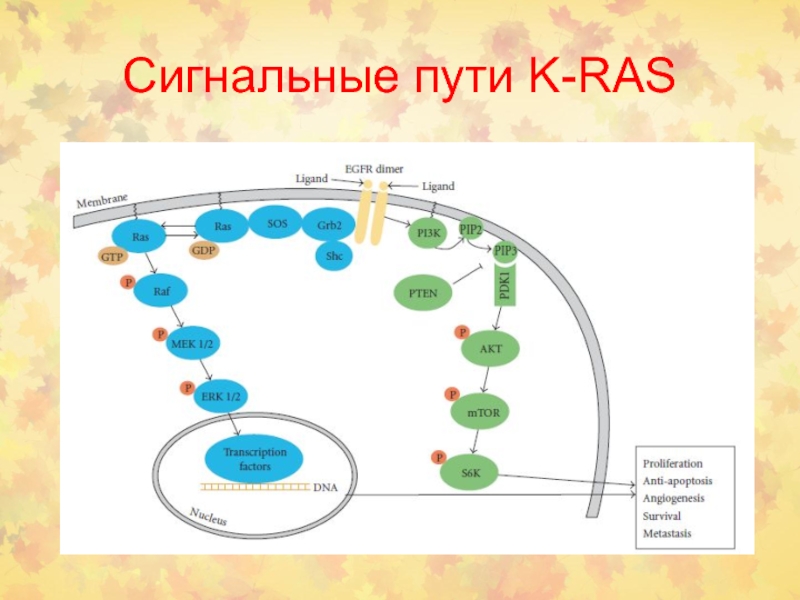
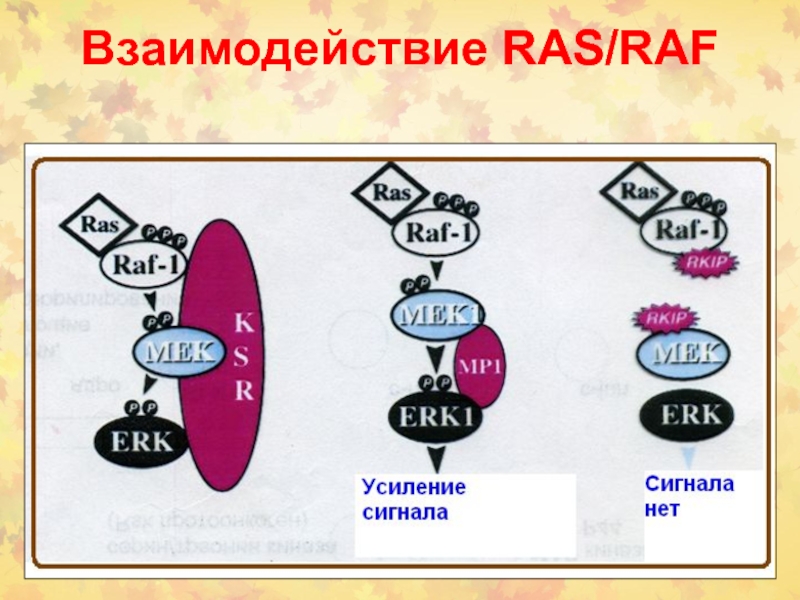
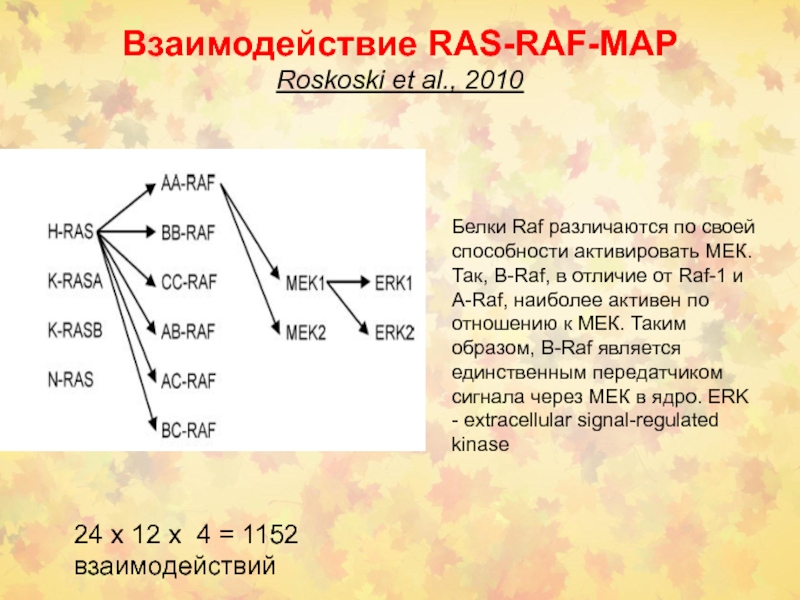
Слайд 44Взаимодействие RAS-RAF-MAP
Roskoski et al., 2010
24 х 12 х 4 =
1152
взаимодействий
Белки Raf различаются по своей способности активировать МЕК. Так,
B-Raf, в отличие от Raf-1 и A-Raf, наиболее активен по отношению к МЕК. Таким образом, B-Raf является единственным передатчиком сигнала через МЕК в ядро. ERK - extracellular signal-regulated kinase
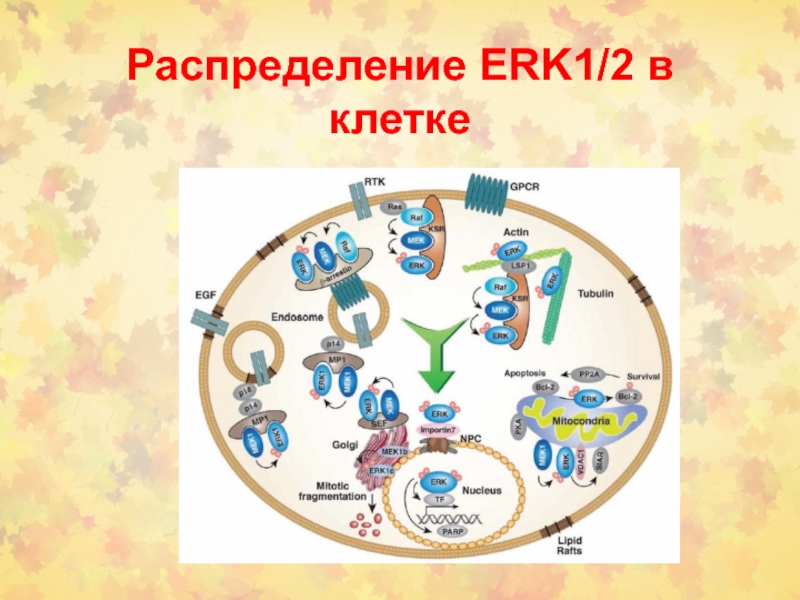
Слайд 45ERK1/2 киназы
ERK1/2 – генные продукты ERK1 (MAPK3) и ERK2
(MAPK1).
MEK1/2-опосредованное фосфорилирование ERK1/2 (Thr и Tyr в последовательности
Thr-Xaa-Tyr)
Известно более 200 субстратов ERK1/2, в том числе ФТ Elk1, c-Fos и c-Jun.
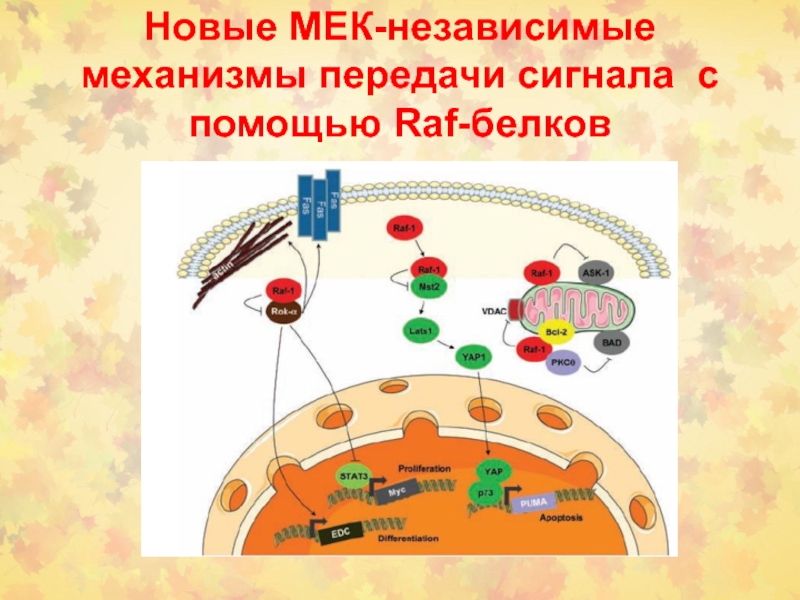
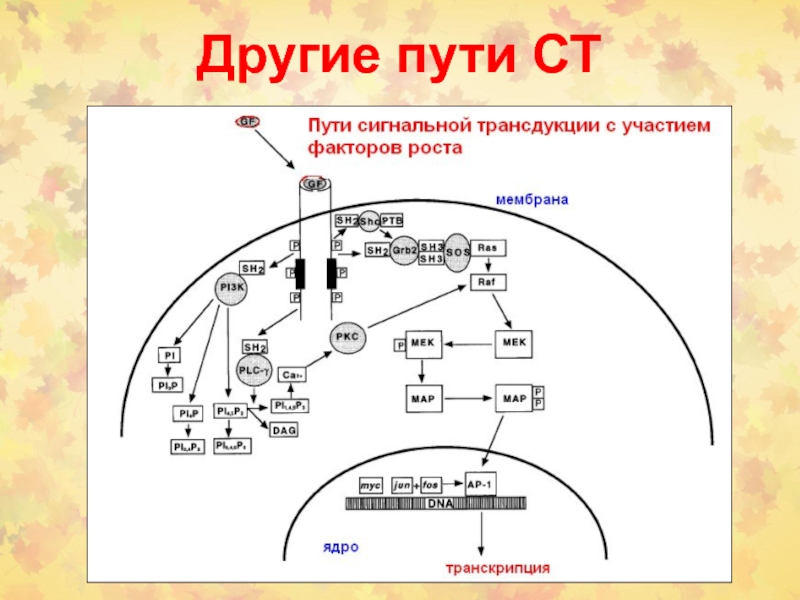
Слайд 47Новые МЕК-независимые механизмы передачи сигнала с помощью Raf-белков
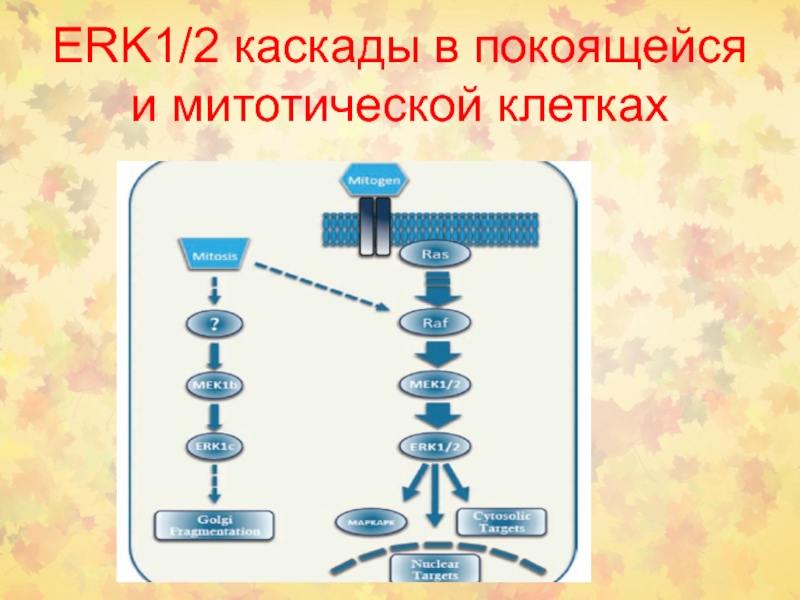
Слайд 48ERK1/2 каскады в покоящейся и митотической клетках
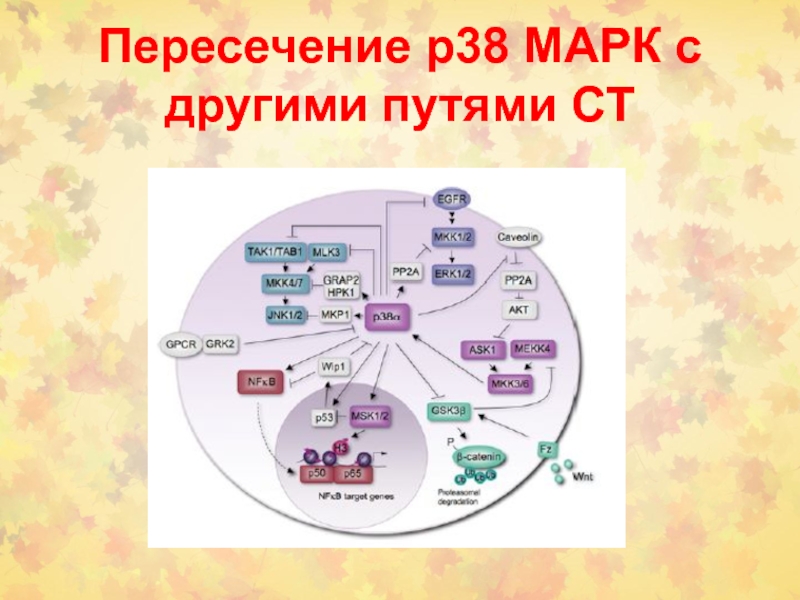
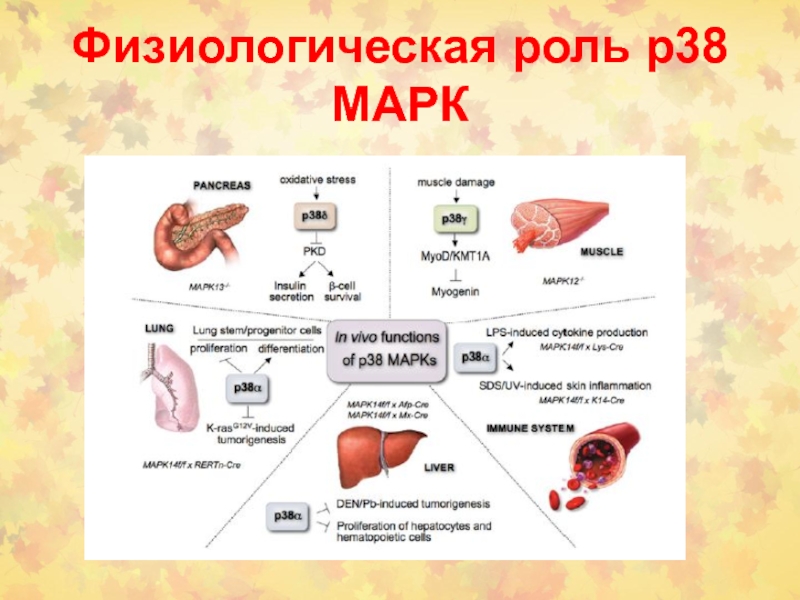
Слайд 51Пересечение р38 МАРК с другими путями СТ
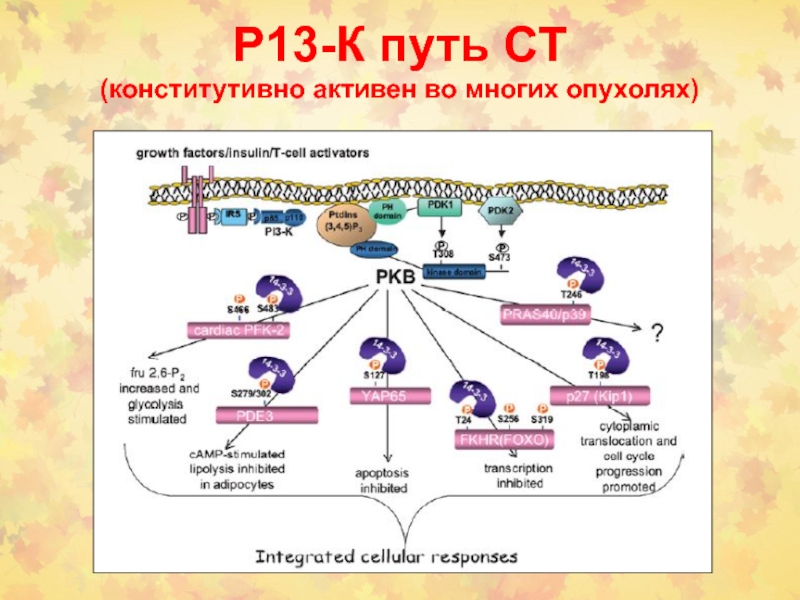
Слайд 57Р13-К путь СТ
(конститутивно активен во многих опухолях)
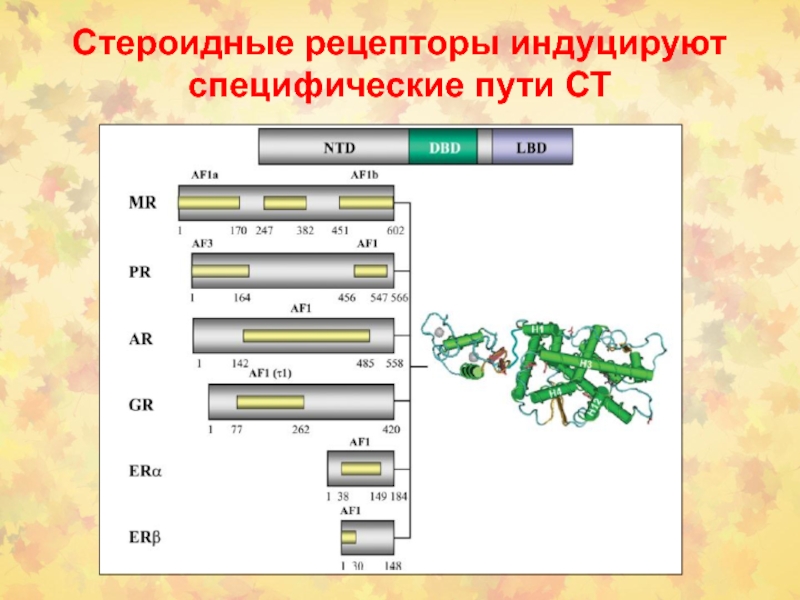
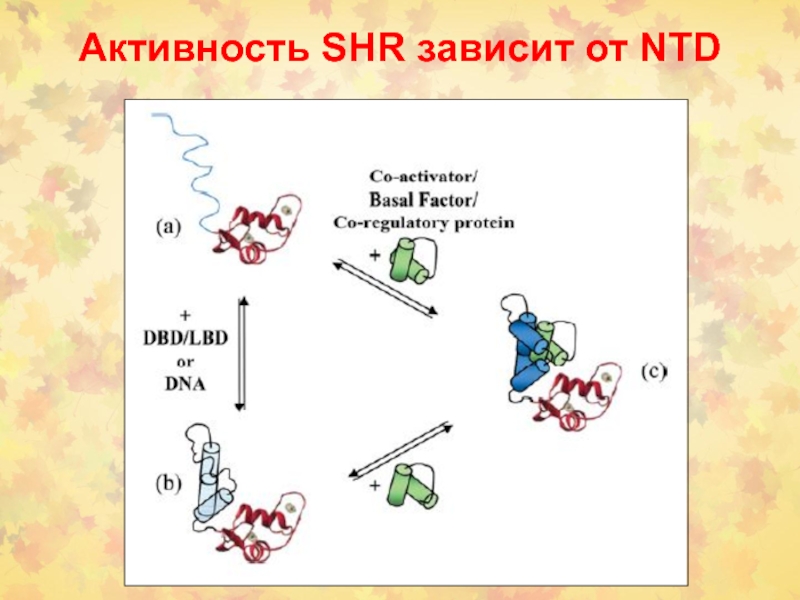
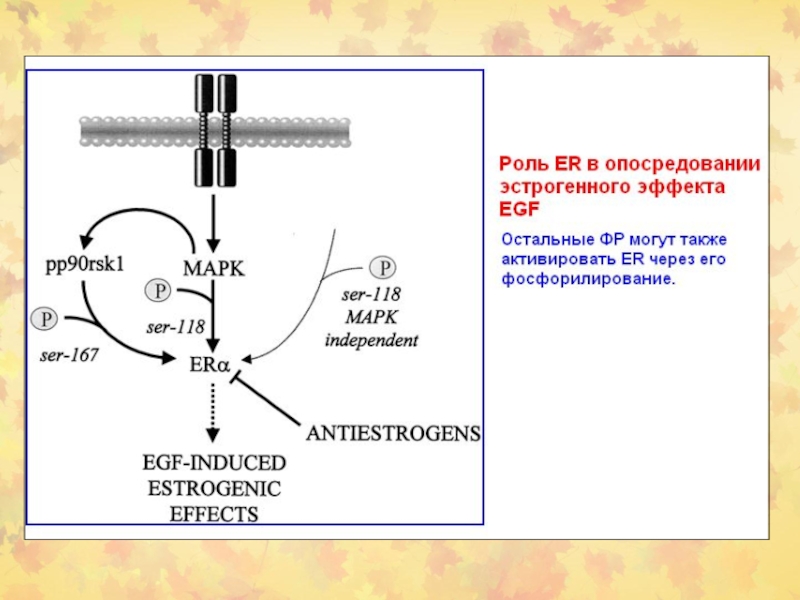
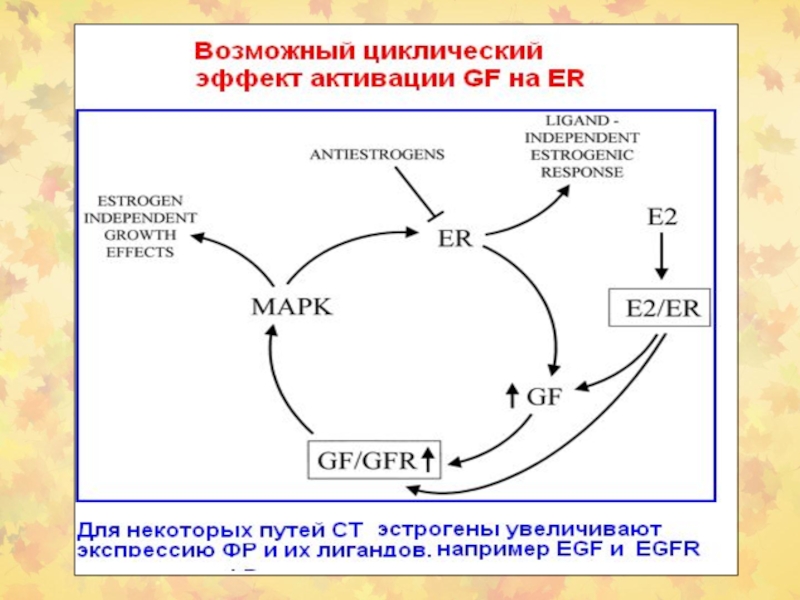
Слайд 61Стероидные рецепторы индуцируют специфические пути СТ
Слайд 65NOTCH1-сигнальный путь
Взаимодействие NOTCH1 рецептора с Delta-like и Jagged лигандами, экспрессирующимися
на поверхности соседних клеток индуцирует протеолитическое расщепление рецептора, в первую
очередь, ADAM 10 металлопротеиназа (S2 cleavage) и затем γ-secretase комплекс (S3 cleavage), которые высвобождают внутриклеточный домен NOTCH1 (ICN1) из мембраны . ICN1 транслоцируется в ядро и взаимодействует с ДНК через RBPJ/CSL – ДНК-связывающие белки, рекрутируют коактиваторы для экспрессии генов-мишеней NOTCH1
Слайд 66Онкогенные формы NOTCH1 при T-ALL
Аберрантная активация NOTCH может происходить из-за
мутаций. (А) рецептор дикого типа; (b) Транслокация NOTCH1 в TCR
локус индуцирует усеченные формы NOTCH1. (c) NOTCH1 HD мутации класса 1 дестабилизируют структуру HD-LNR повторов, ответственных за поддержание конфигурации рецептора (d) NOTCH1 H1545P мутации повреждают защиту от S2 расщепления у HD-LNR (e) NOTCH1 HD мутации класса 2 располагают S2 МР сайт расщепления вне HD-LNR комплекса (f) NOTCH1 JME усиливает выделение HD-LNR повторного комплекса из мембраны (g) NOTCH1 ΔPEST у C-конца рецептора нарушает деградацию активного NOTCH1 в ядре.
Слайд 67Распределение мутаций при лейкемии (T-ALL)
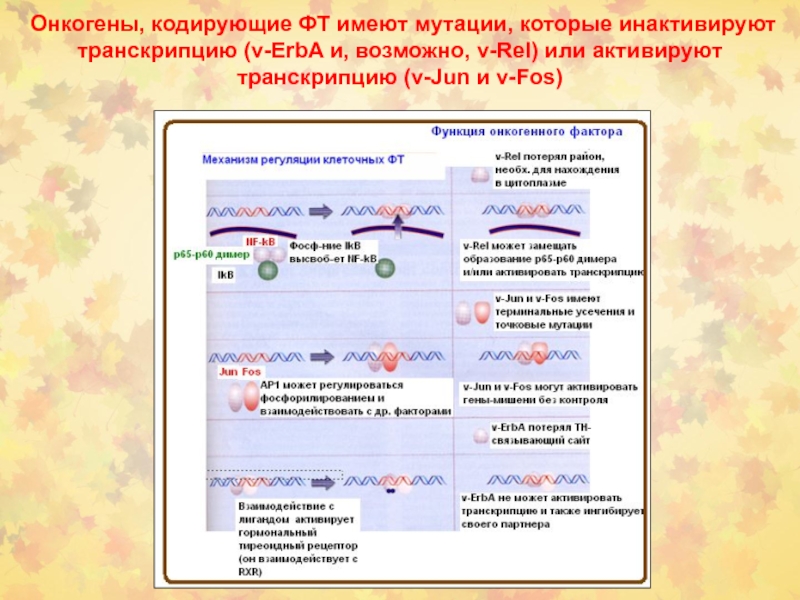
Слайд 70Онкогены, кодирующие ФТ имеют мутации, которые инактивируют транскрипцию (v-ErbA и,
возможно, v-Rel) или активируют транскрипцию (v-Jun и v-Fos)
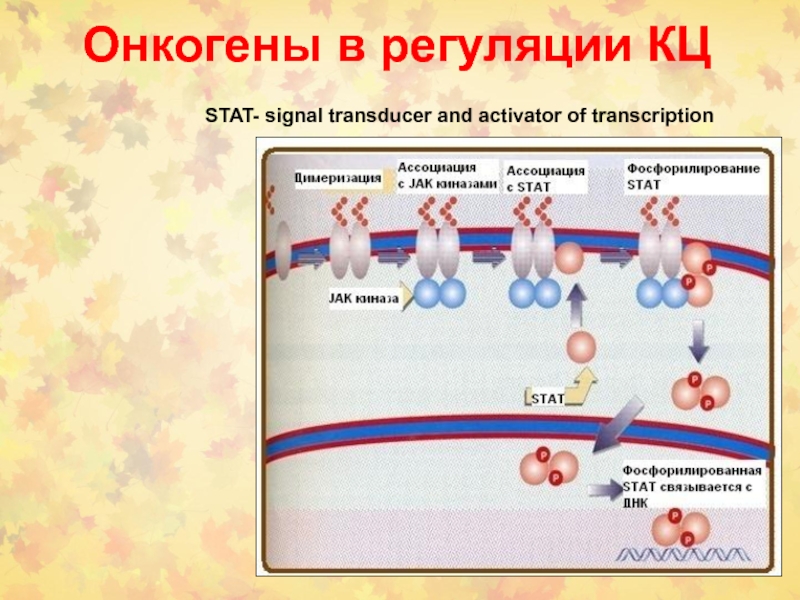
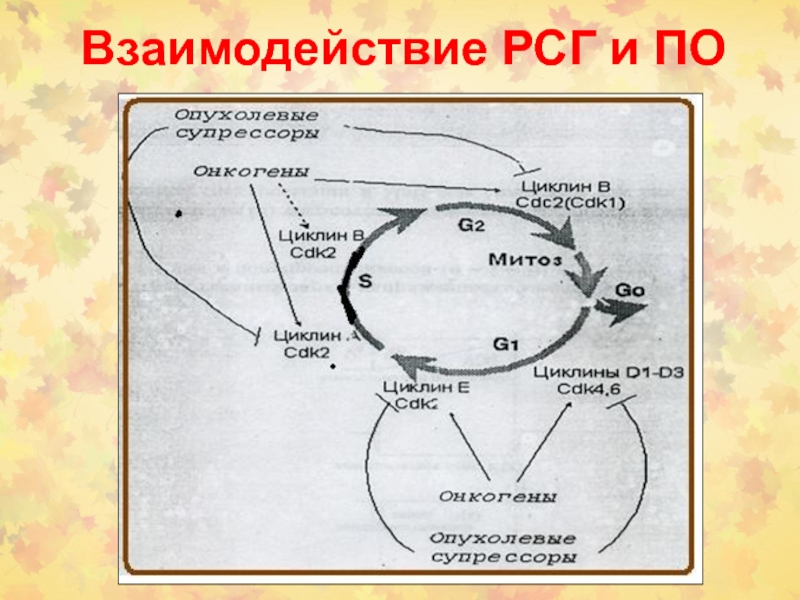
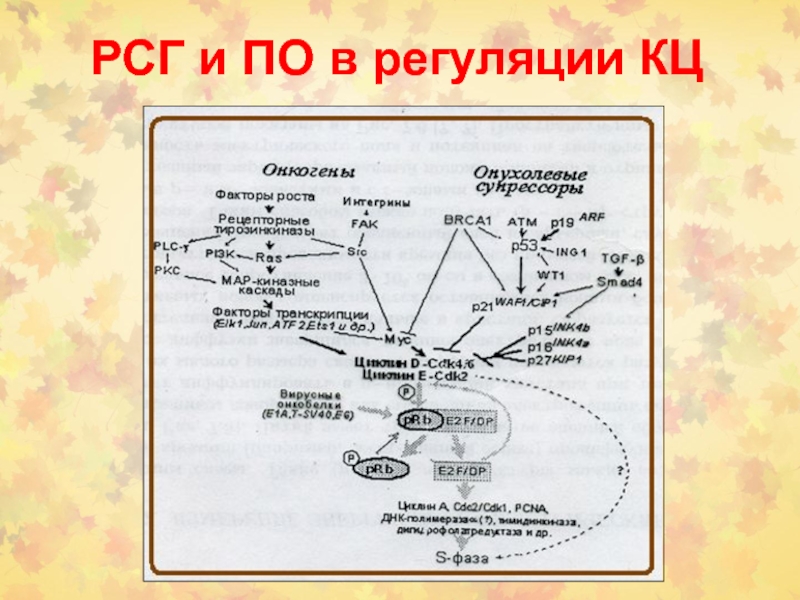
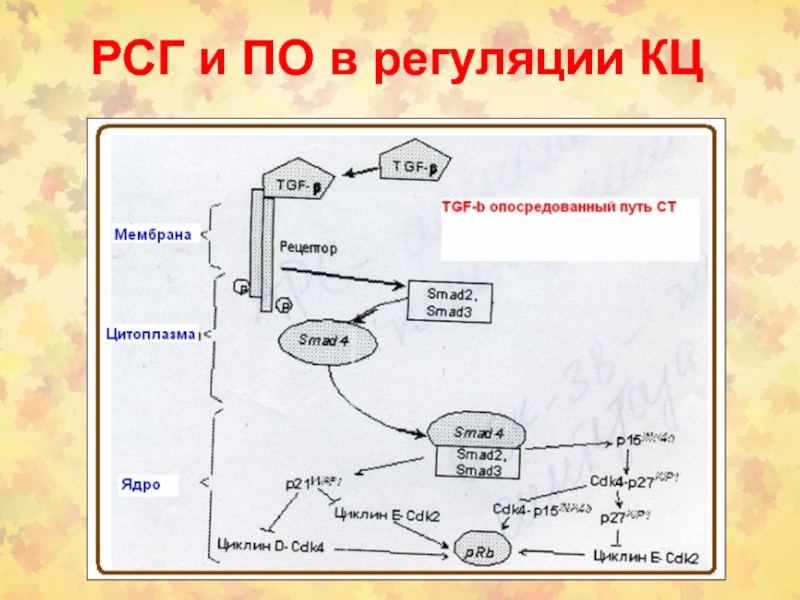
Слайд 72Онкогены в регуляции КЦ
STAT- signal transducer and activator of transcription
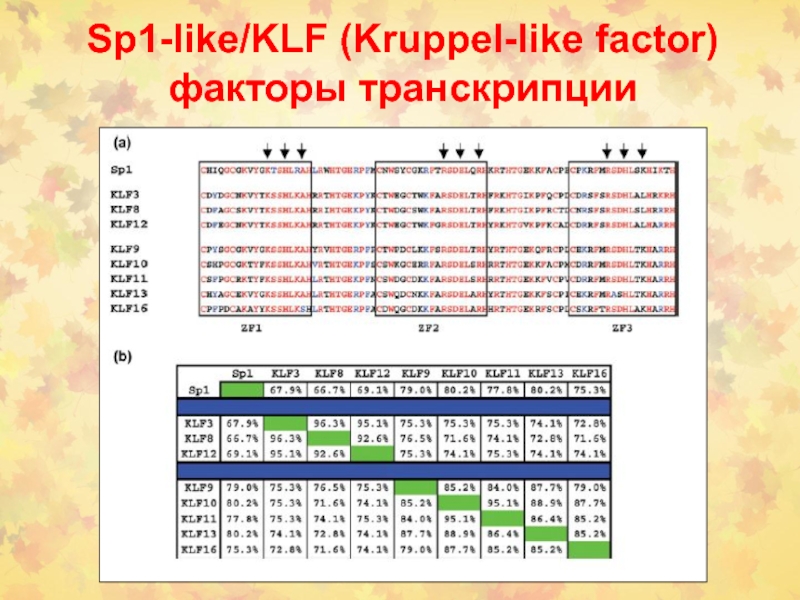
Слайд 73Sp1-like/KLF (Kruppel-like factor) факторы транскрипции
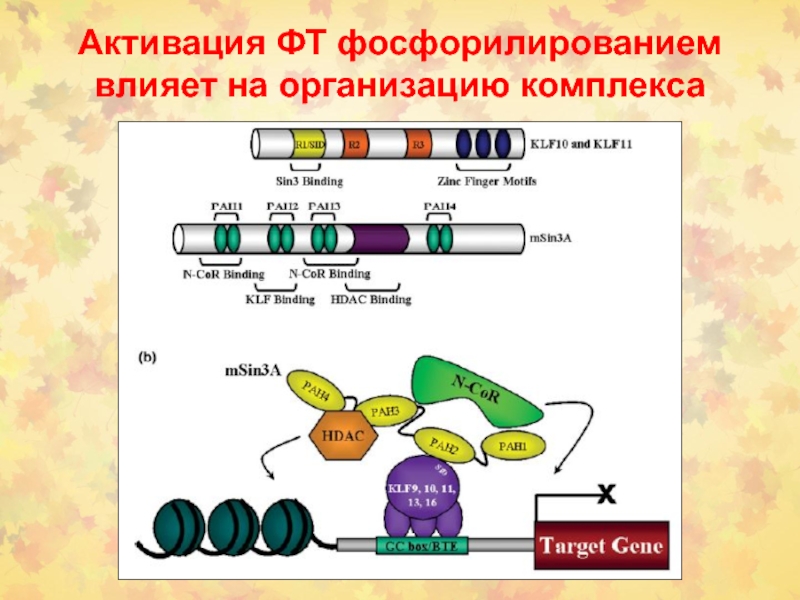
Слайд 74Активация ФТ фосфорилированием влияет на организацию комплекса
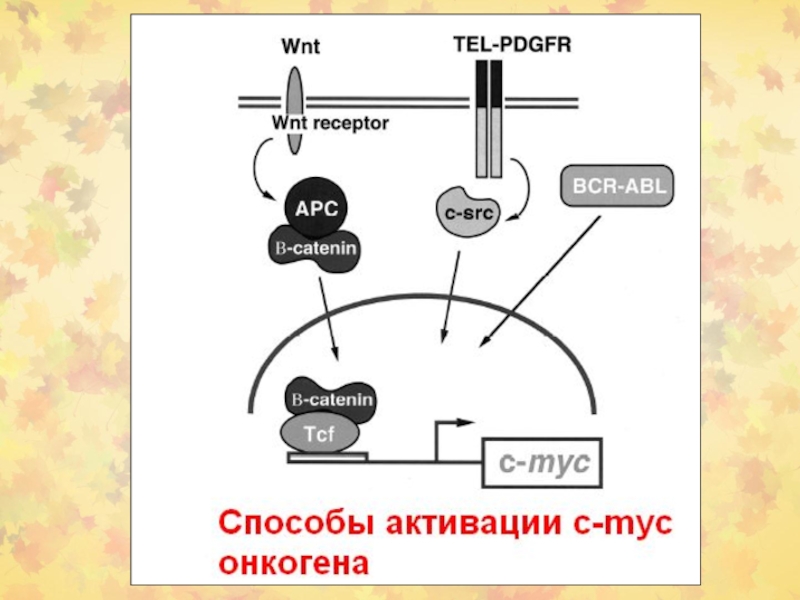
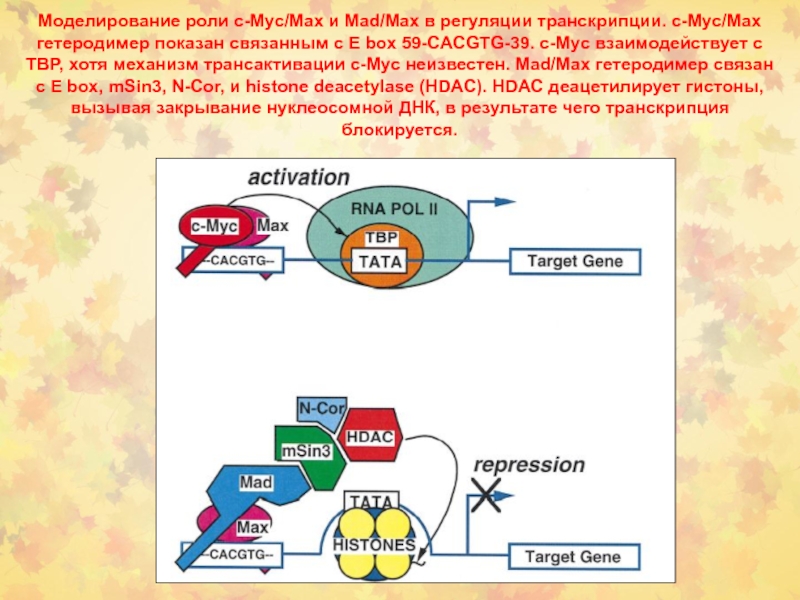
Слайд 76Моделирование роли c-Myc/Max и Mad/Max в регуляции транскрипции. c-Myc/Max гетеродимер
показан связанным с E box 59-CACGTG-39. c-Myc взаимодействует с TBP,
хотя механизм трансактивации c-Myc неизвестен. Mad/Max гетеродимер связан с E box, mSin3, N-Cor, и histone deacetylase (HDAC). HDAC деацетилирует гистоны, вызывая закрывание нуклеосомной ДНК, в результате чего транскрипция блокируется.
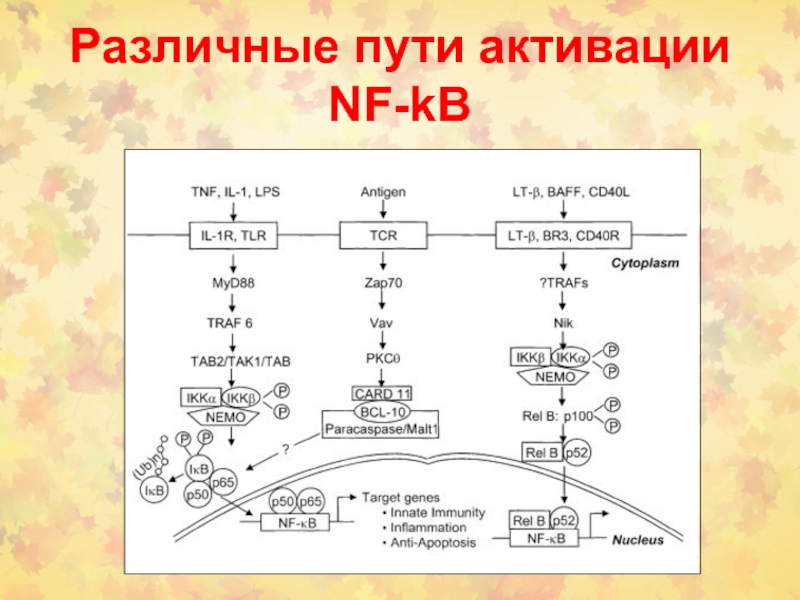
Слайд 80NF-kB семейство
(p50/p105), NF-kB2 (p52/ p100), RelA (p65), Rel (c-Rel) и
RelB.
Для них характерно: Rel homology domain (RHD), который опосредует связывание
с ДНК, димеризацию и связывание с группой ингибиторов IkB
IkB киназный комплекс (IKK) состоит из 3-х субъединиц: IKKa, IKKb и IKKg/NEMO и убиквитина.
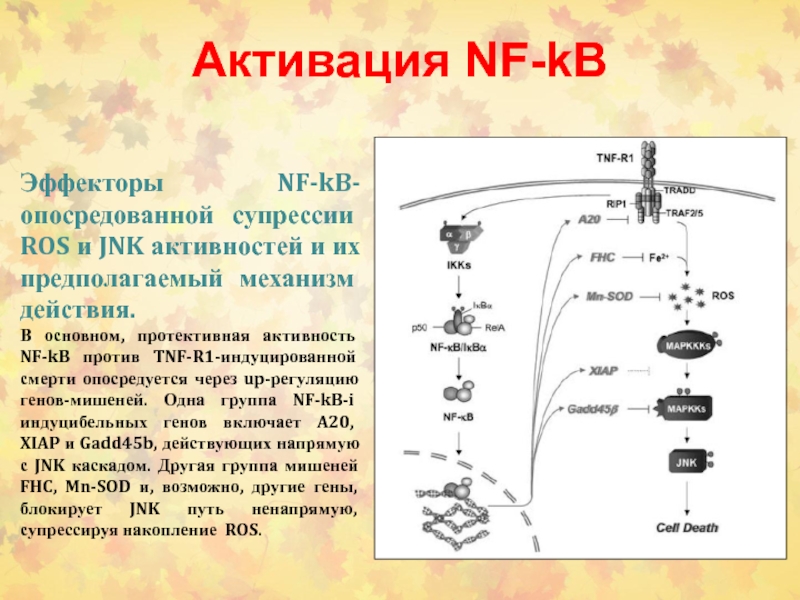
Слайд 81Активация NF-kB
Эффекторы NF-kB-опосредованной супрессии ROS и JNK активностей и их
предполагаемый механизм действия.
В основном, протективная активность NF-kB против TNF-R1-индуцированной
смерти опосредуется через up-регуляцию генов-мишеней. Одна группа NF-kB-i индуцибельных генов включает A20, XIAP и Gadd45b, действующих напрямую с JNK каскадом. Другая группа мишеней FHC, Mn-SOD и, возможно, другие гены, блокирует JNK путь ненапрямую, супрессируя накопление ROS.
Слайд 83Пространственная структура фактора транскрипции NF-кB
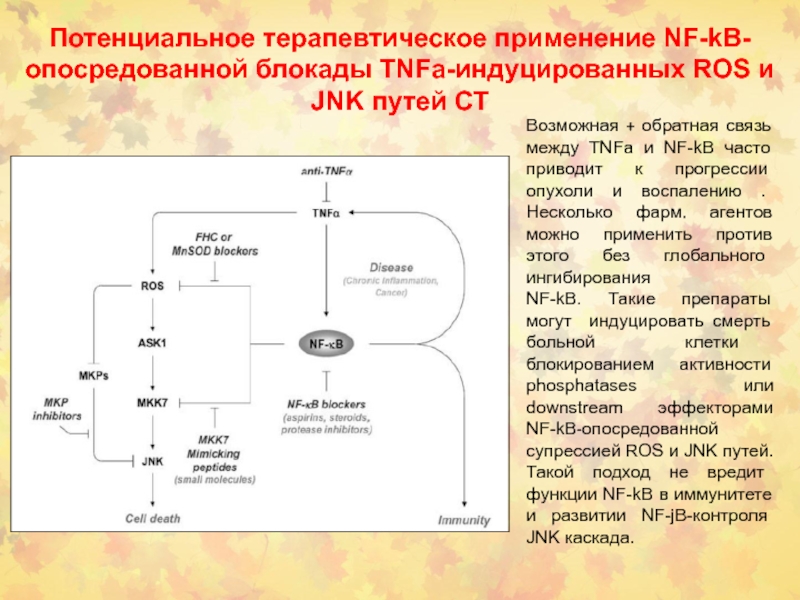
Слайд 84Потенциальное терапевтическое применение NF-kB-опосредованной блокады TNFa-индуцированных ROS и JNK путей
СТ
Возможная + обратная связь между TNFa и NF-kB часто приводит
к прогрессии опухоли и воспалению . Несколько фарм. агентов можно применить против этого без глобального ингибирования
NF-kB. Такие препараты могут индуцировать смерть больной клетки блокированием активности phosphatases или downstream эффекторами NF-kB-опосредованной супрессией ROS и JNK путей. Такой подход не вредит функции NF-kB в иммунитете и развитии NF-jB-контроля JNK каскада.
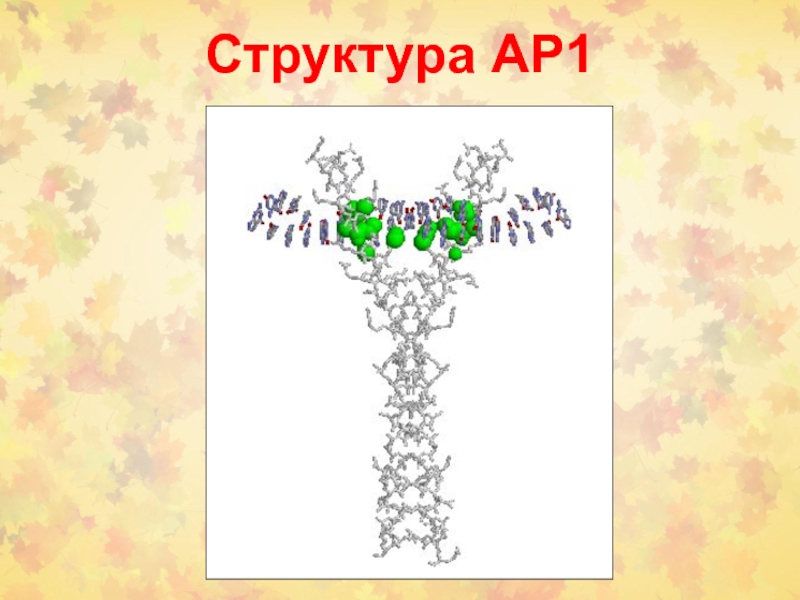
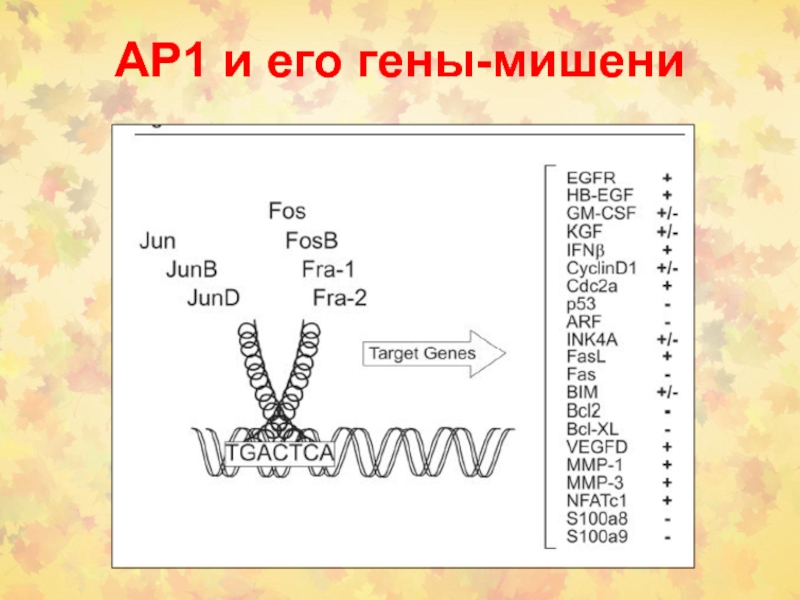
Слайд 85АР1 семейство
Activator protein 1 (AP-1) семейство белков – содержат лейциновый
зиппер (bZIP). Они регулируют многие клеточные процессы, включая пролиферацию, выживание,
рост, дифференцировку, апоптоз, трансформацию.
У млекопитающих это гомо- или гетеродимеры, которые формируются jun (c-jun, junB, junD), fos (c-fos, fra-1, fra-2) или atf белками.
Слайд 89Функции Jun и Fos белков (мыши) - продолжение
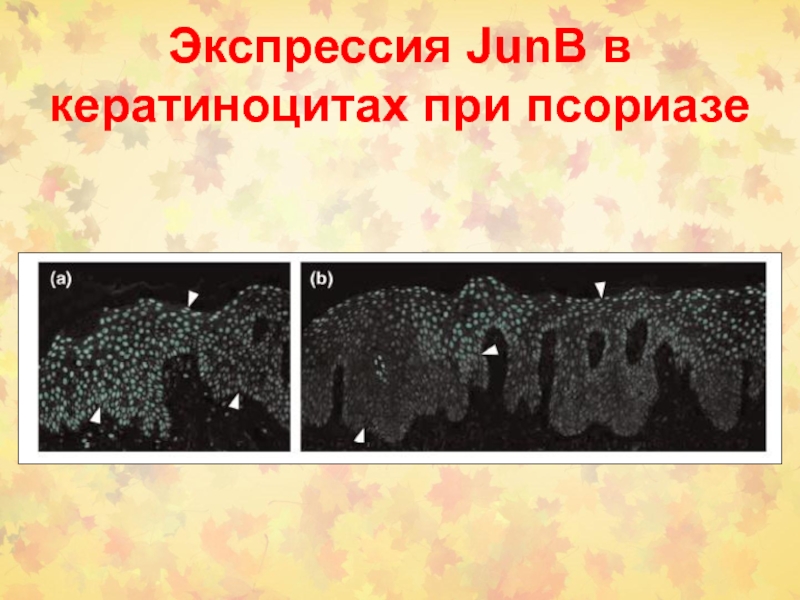
Слайд 90Экспрессия JunB в кератиноцитах при псориазе
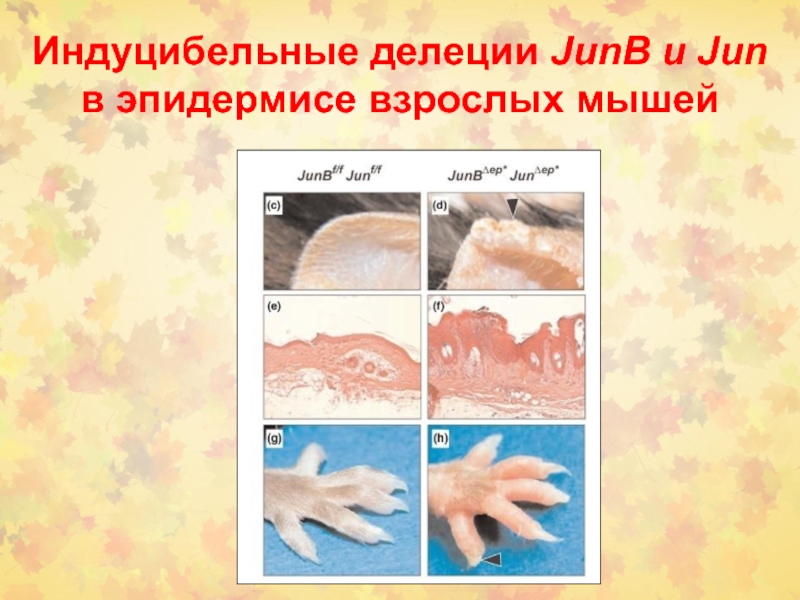
Слайд 91Индуцибельные делеции JunB и Jun в эпидермисе взрослых мышей
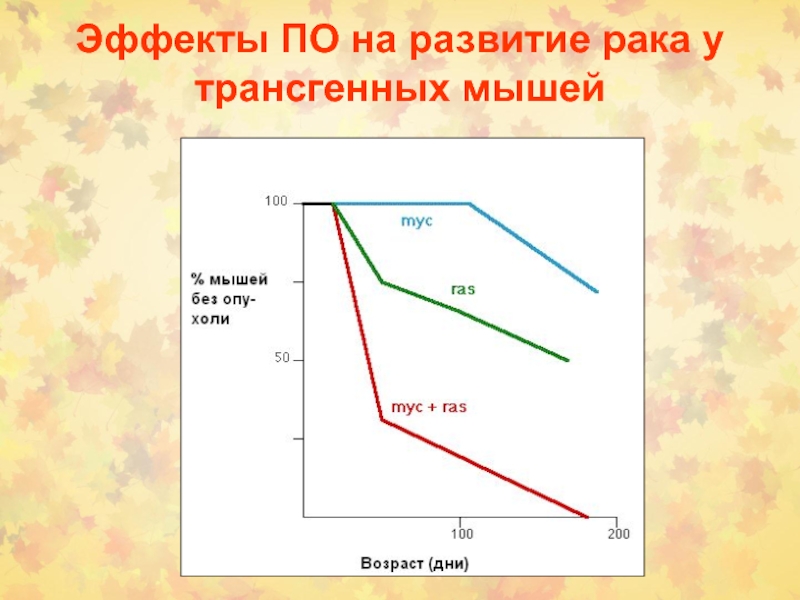
Слайд 92Эффекты ПО на развитие рака у трансгенных мышей
Слайд 97Сигнальные молекулы – мишени в терапии рака
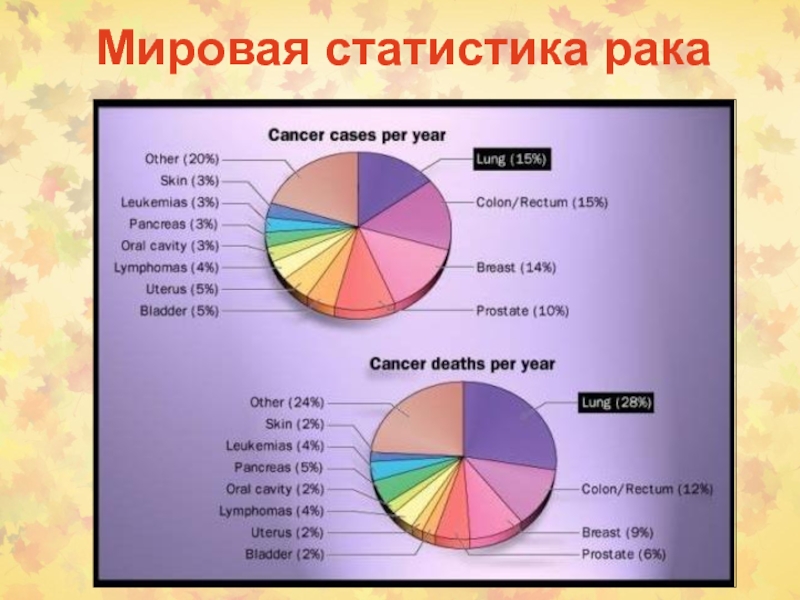
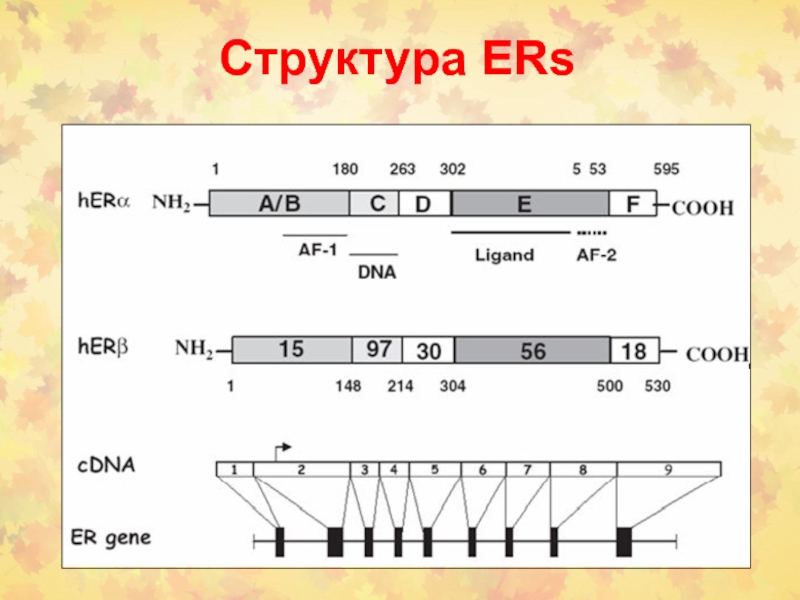
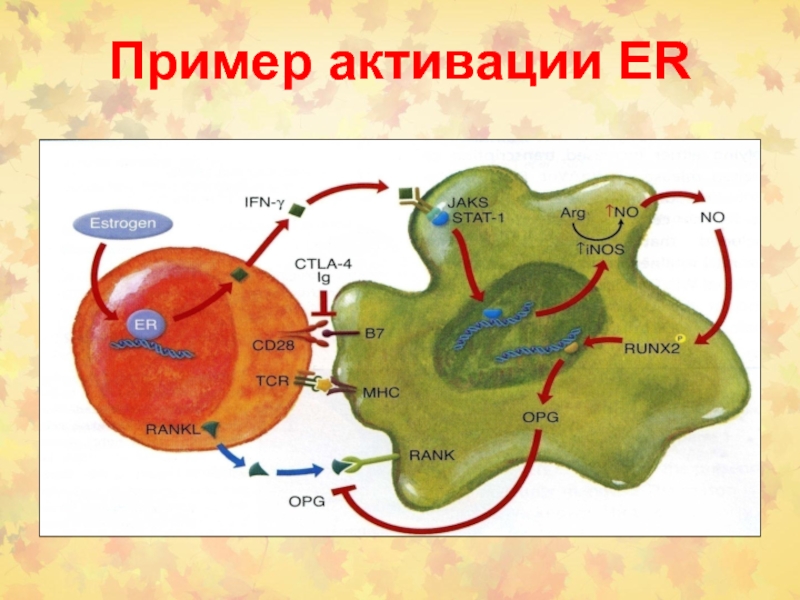
Слайд 98Механизмы гормонального канцерогенеза
- генотоксичный (повреждение ДНК метаболитами эстрогенов)
- эпигенетический (активация
ERs)
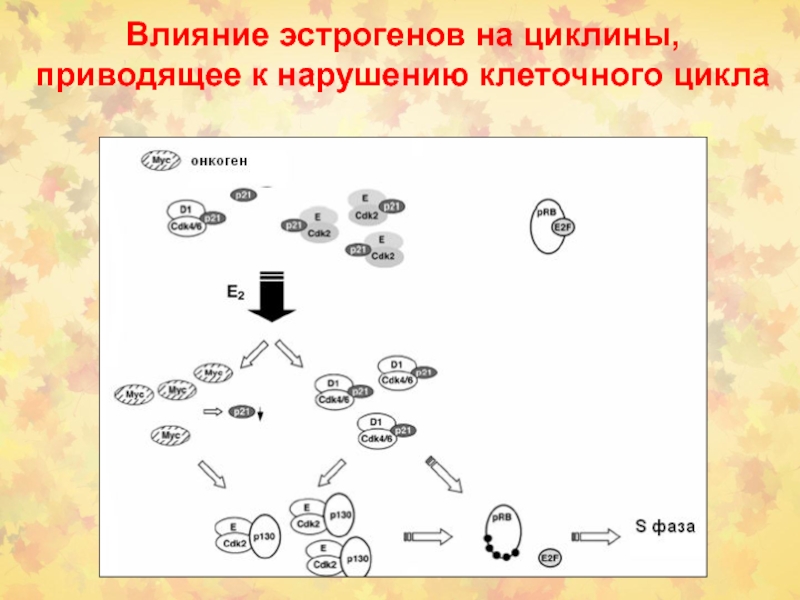
Слайд 100Влияние эстрогенов на циклины, приводящее к нарушению клеточного цикла
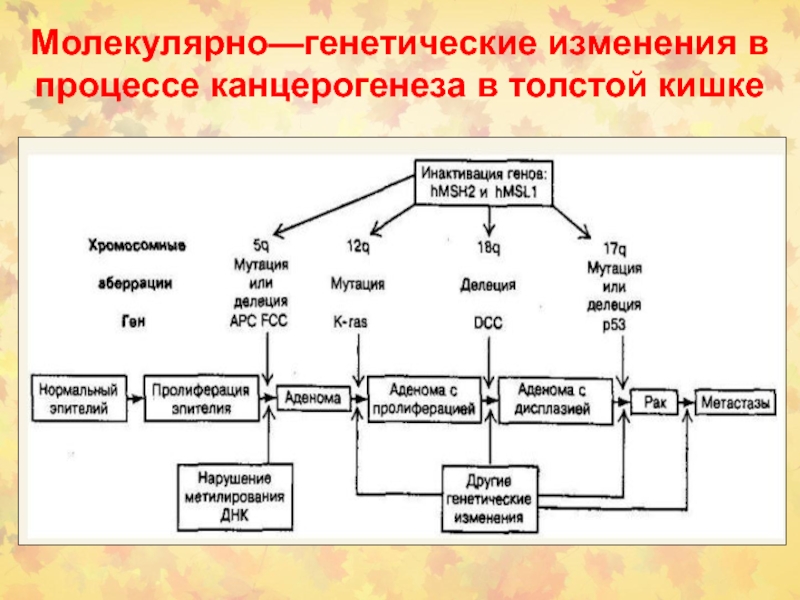
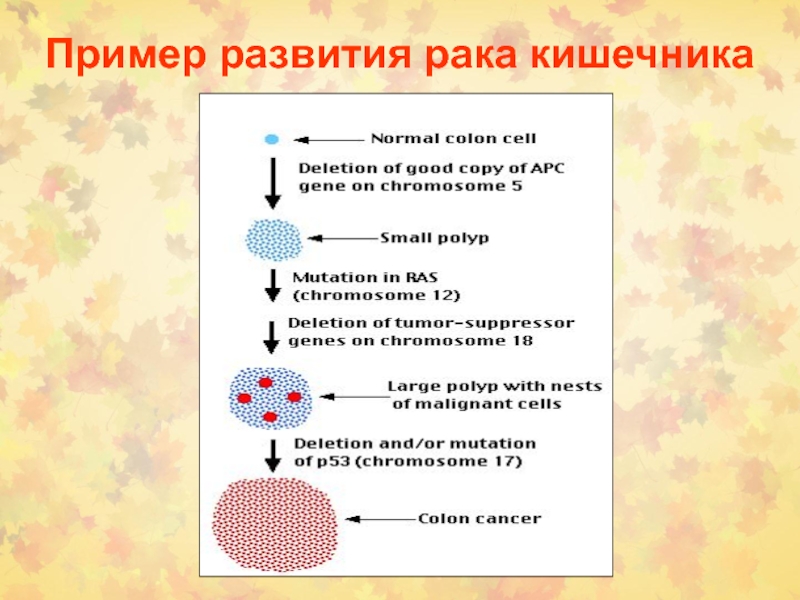
Слайд 104Молекулярно—генетические изменения в процессе канцерогенеза в толстой кишке
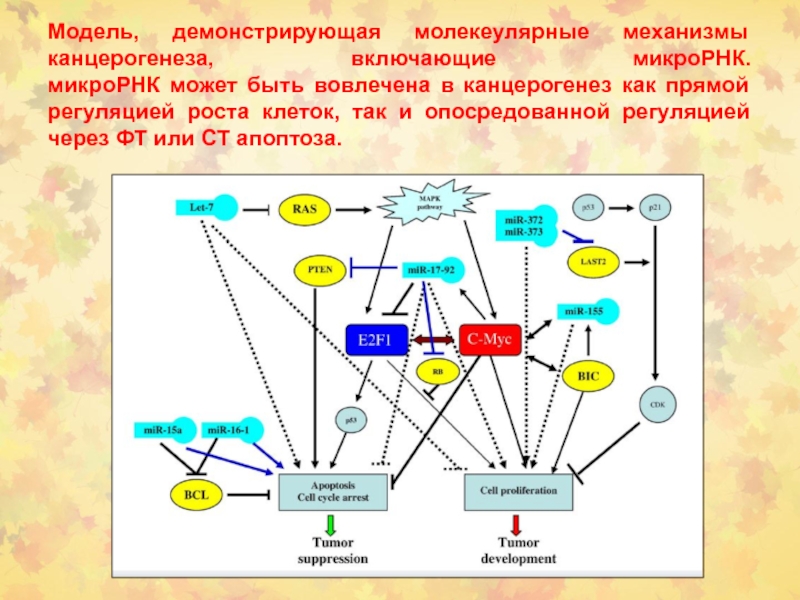
Слайд 107Модель, демонстрирующая молекеулярные механизмы канцерогенеза, включающие микроРНК.
микроРНК может быть вовлечена
в канцерогенез как прямой регуляцией роста клеток, так и опосредованной
регуляцией через ФТ или СТ апоптоза.
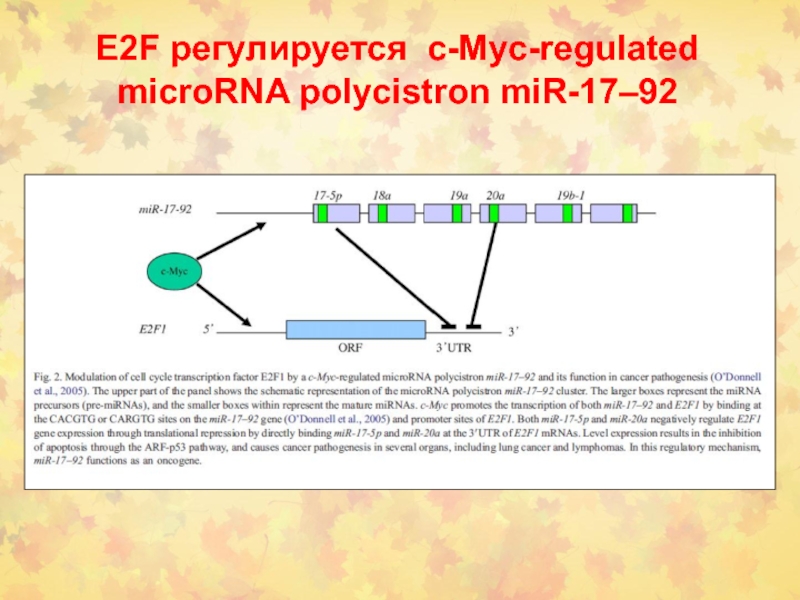
Слайд 108E2F регулируется c-Myc-regulated microRNA polycistron miR-17–92
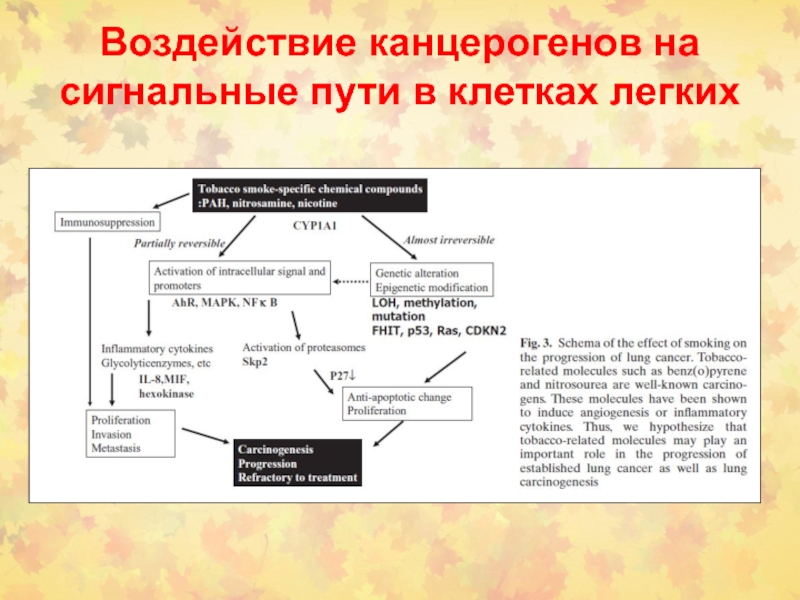
Слайд 109Воздействие канцерогенов на
сигнальные пути в клетках легких
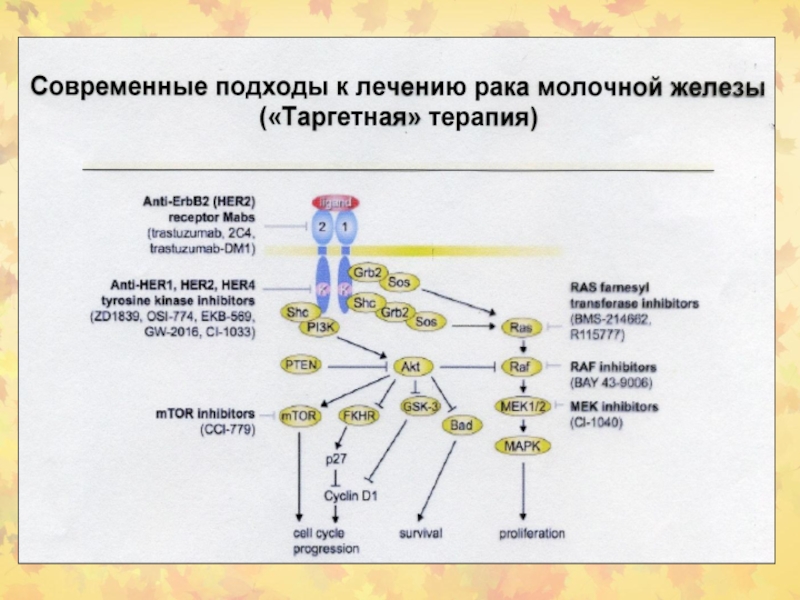
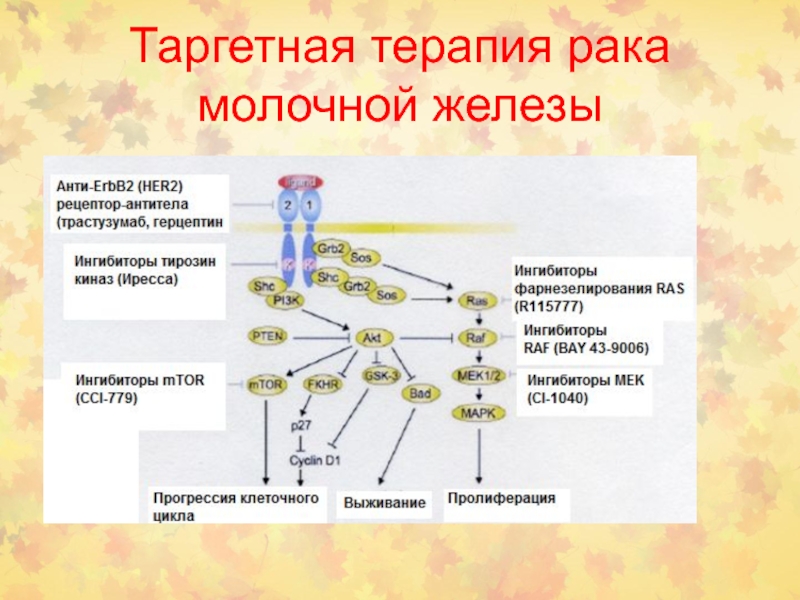
Слайд 110Таргетная терапия рака молочной железы
Слайд 111
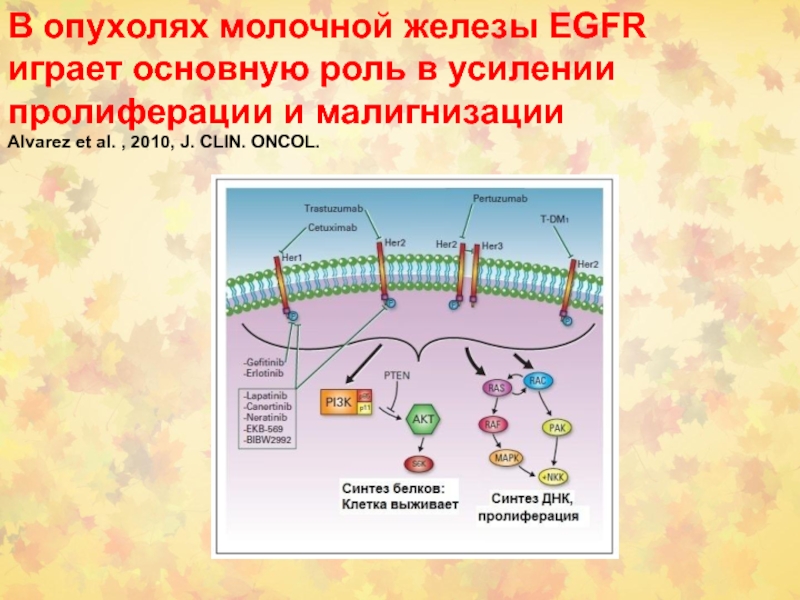
В опухолях молочной железы EGFR играет основную роль в усилении
пролиферации и малигнизации
Alvarez et al. , 2010, J. CLIN. ONCOL.
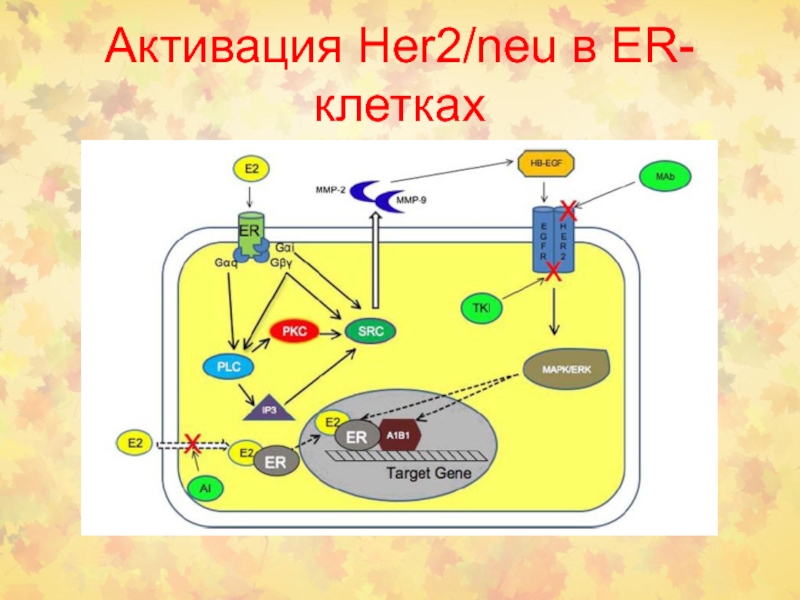
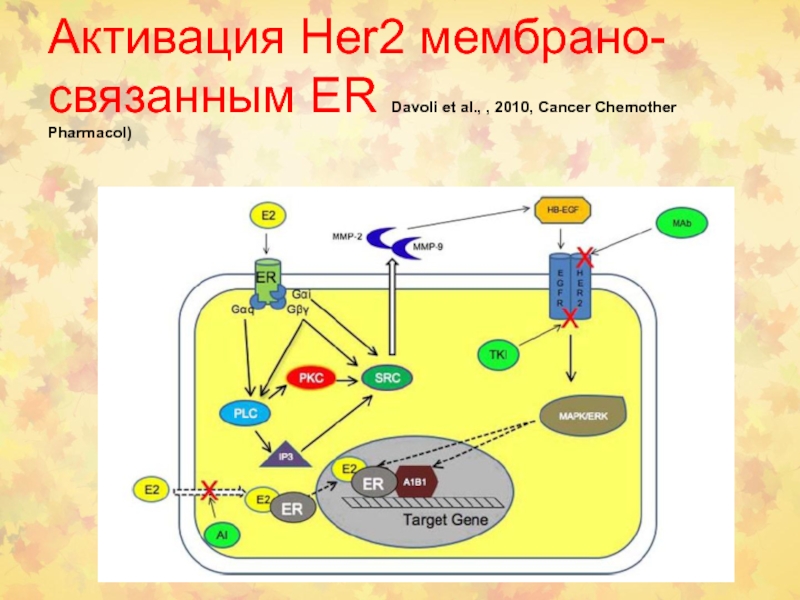
Слайд 112Активация Her2 мембрано-связанным ER Davoli et al., , 2010, Cancer
Chemother Pharmacol)
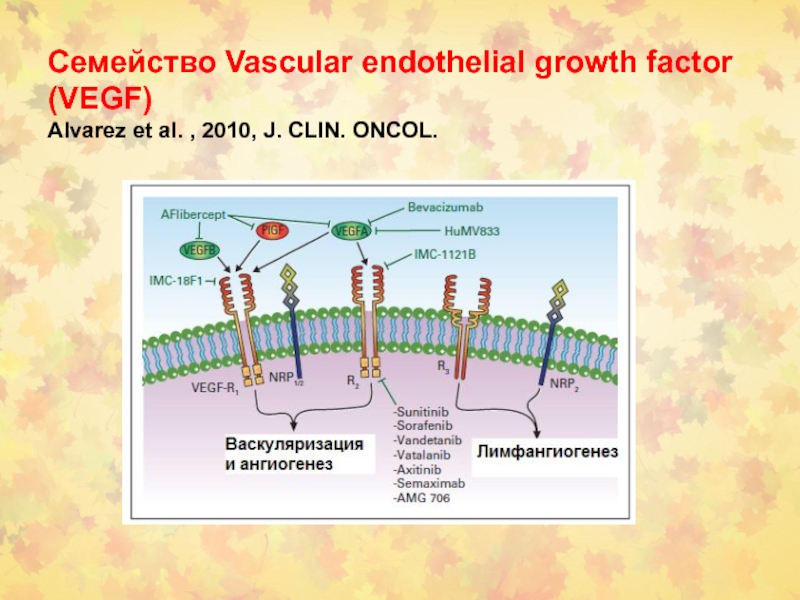
Слайд 113
Семейство Vascular endothelial growth factor (VEGF)
Alvarez et al. ,
2010, J. CLIN. ONCOL.
Слайд 114
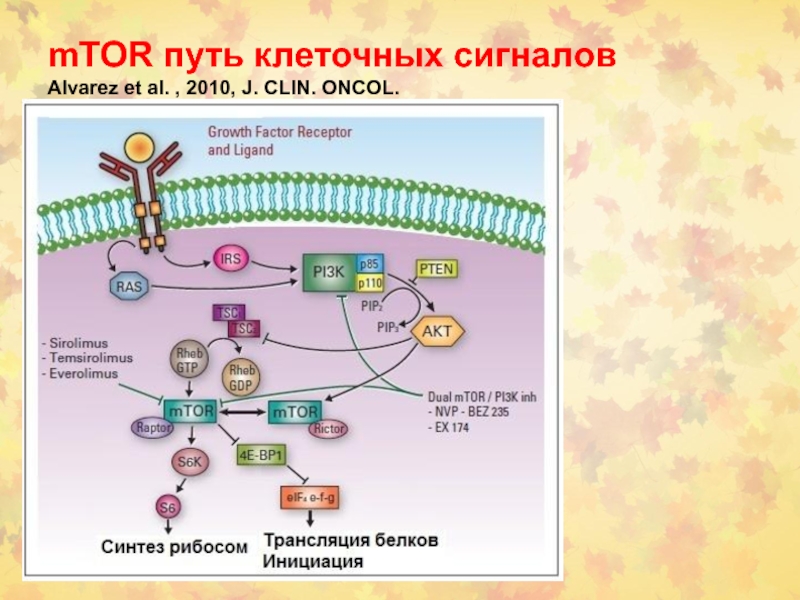
mTOR путь клеточных сигналов
Alvarez et al. , 2010, J. CLIN.
ONCOL.
Слайд 115Таргетная терапия в лечении рака легкого
NSCLC – немелкоклеточный рак легкого
vascular endothelial growth factor (VEGF)
Bevacizumab ингибирует VEGF
Cetuximab – Mab против
epidermal growth factor receptor (EGFR)
Gefitinib и erlotinib - монотерапия
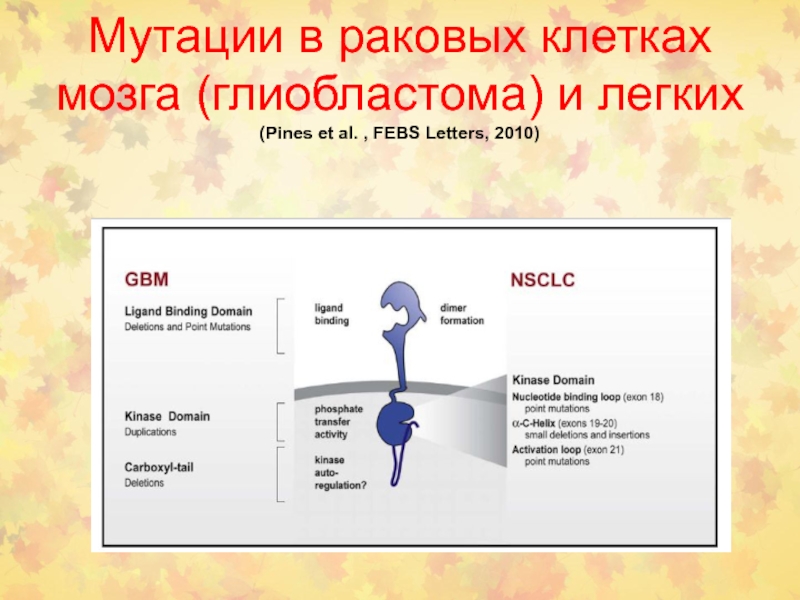
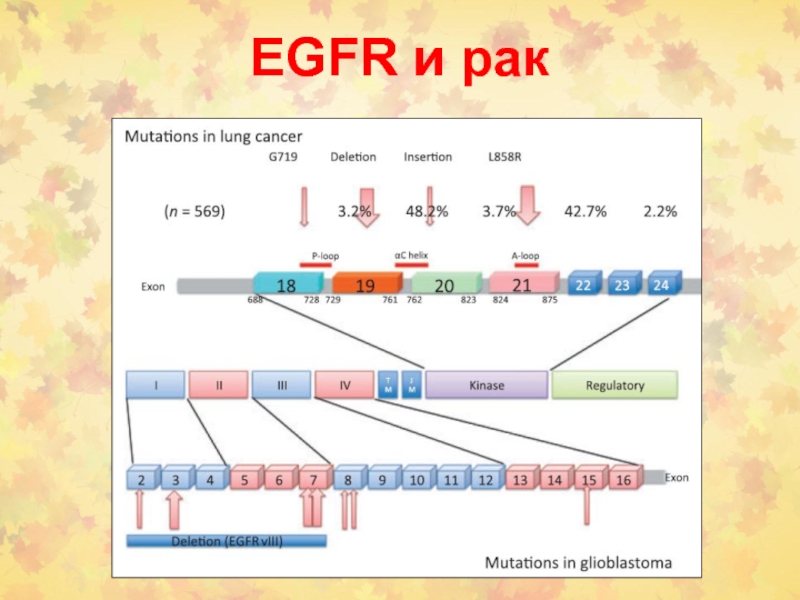
Слайд 116Мутации в раковых клетках мозга (глиобластома) и легких (Pines et
al. , FEBS Letters, 2010)
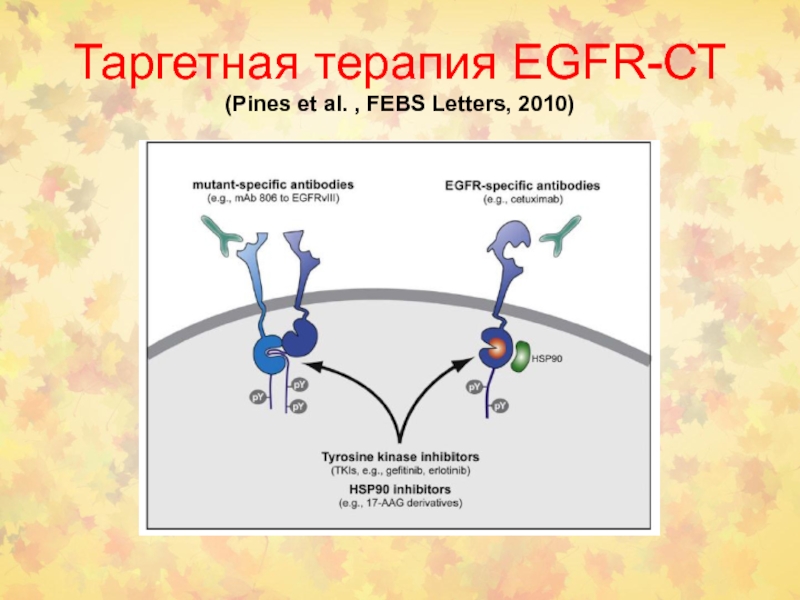
Слайд 117Таргетная терапия EGFR-СТ (Pines et al. , FEBS Letters, 2010)
Слайд 119Таргетная терапия в лечении рака кишечника
Panitumumab – антитела против EGFR,
связывают лиганд-связывающий экстраклеточный домен, ингибируя димеризацию рецептора
Слайд 120Мутации в опухолях кишечника (586 случаев)
Kopper L. Pathol. Oncol.
Res. (2010)
Среди 208 больных, принимавших панитумумаб, 17% с диким типом
KRAS показали объективный ответ, но не пациенты с мутациями (84 больных)
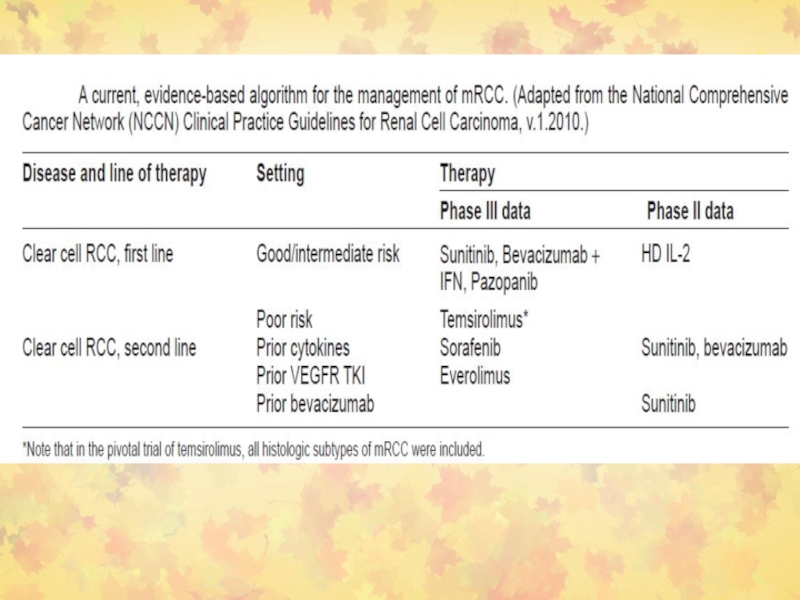
Слайд 121Ренальная карцинома
2 категории терапии:
(1) vascular endothelial growth factor receptor (VEGFR)-направленная
терапия
(2) Ингибиторы mTOR (аналоги рапамицина).
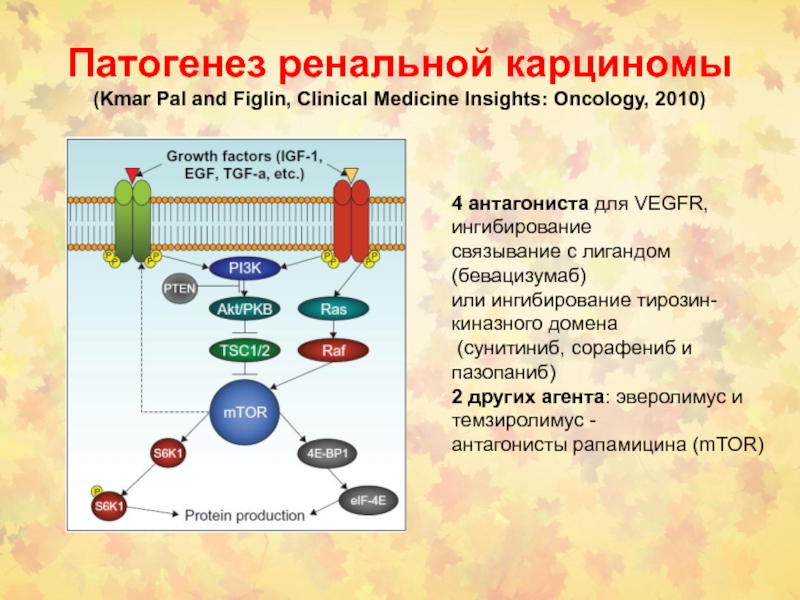
Слайд 122Патогенез ренальной карциномы
(Kmar Pal and Figlin, Clinical Medicine Insights:
Oncology, 2010)
4 антагониста для VEGFR, ингибирование
связывание с лигандом (бевацизумаб)
или ингибирование тирозин-киназного домена
(сунитиниб, сорафениб и пазопаниб)
2 других агента: эверолимус и темзиролимус -
антагонисты рапамицина (mTOR)
Слайд 125Применение ингибиторов RAF
B-RAF мутации встречаются в 30–60% меланом, 30–50% тиреоидного
рака, 5–20% рака кишечника
Ингибиторы RAF киназ (Sorafenib) эффективно блокируют
MEK1/2 и ERK1/2 активацию в клетках, содержащих онкогенный B-RAF Val600Glu (активирующая мутация).
Ингибиторы RAF киназ приводят к парадоксальному увеличению активности RAF в клетках, содержащих дикий тип B-RAF или активированный мутантный RAS. C-RAF играет ключевую роль в усилении MEK-ERK активации.
Слайд 126
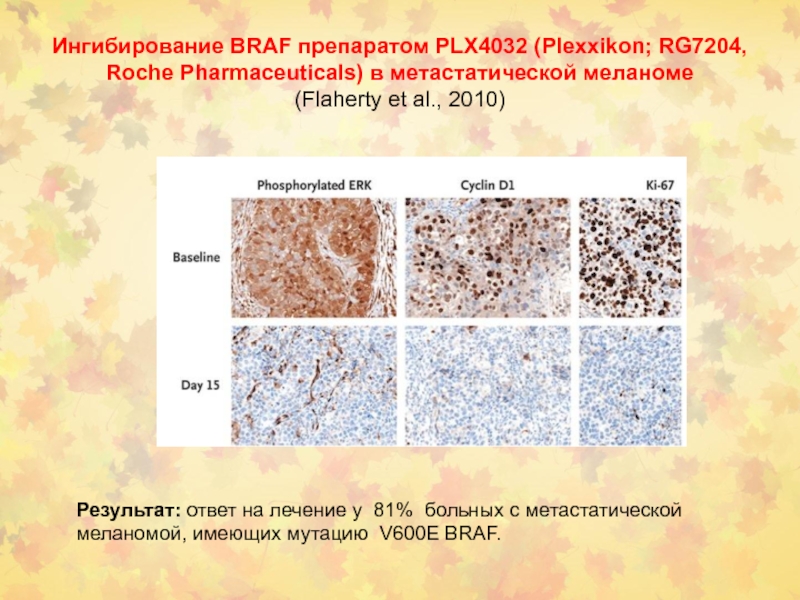
Ингибирование BRAF препаратом PLX4032 (Plexxikon; RG7204, Roche Pharmaceuticals) в метастатической
меланоме
(Flaherty et al., 2010)
Результат: ответ на лечение у 81%
больных с метастатической меланомой, имеющих мутацию V600E BRAF.
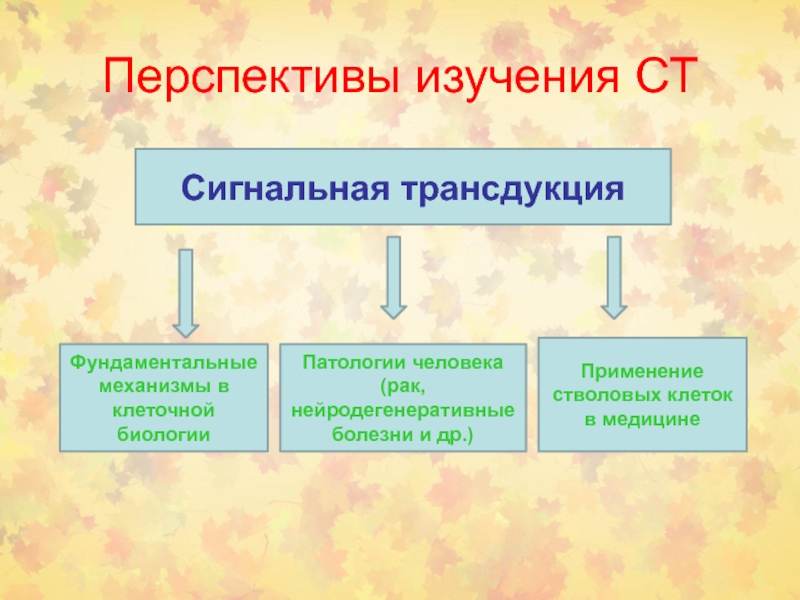
Слайд 127Перспективы изучения СТ
Сигнальная трансдукция
Фундаментальные механизмы в клеточной биологии
Патологии человека (рак,
нейродегенеративные болезни и др.)
Применение стволовых клеток в медицине